Навигация
Водородный показатель рН
1. Водородный показатель рН
В пробирку наливают 5 мл исследуемой воды, 0. 1 мл универсального индикатора, перемешивают и по окраске раствора оценивают величину рН.
Розово - оранжевая рН около 5
Светло-желтая pH - 6
Светло – зелёная рН - 7
Зеленовато-голубая рН - 8
рН можно определить с помощью индикаторной бумаги, сравнивая её окраску со шкалой. По индикаторной бумаге более точное определение, чем визуально.
2. Жесткость воды Природная вода обязательно содержит растворённые соли и газы (азот , кислород и др.). Присутствие в воде ионов Mg2+ и Са2+ и некоторых других, способных образовывать твёрдые осадки при взаимодействии с анионами жизненных органических кислот, входящих в состав различных мыл (например, со стеарат-ионом С17Н35СОО2-), обуславливает так называемую жёсткость воды. [9]
Во всех просмотренных мной научных источниках, понятие жёсткости воды обычно связано с катионами кальция (Са2+) и в меньшей степени магния (Mg2+). В действительности, все двухвалентные катионы в той или иной степени влияют на жёсткость. Они взаимодействуют с анионами, образуя соединения (соли жёсткости) способные выпадать в осадок. Одновалентные катионы (например, натрий Na+) таким свойством не обладают.
В данной таблице приведены основные катионы металлов, вызывающие жёсткость, и главные анионы, с которыми они ассоциируются:
| Катионы | Анионы |
| Кальций (Са2+) | Гидрокарбонат (HCO3-) |
| Магний (Mg2+) | Сульфат (SO42-) |
| Стронций (Sr2+) | Хлорид (Cl-) |
| Железо (Fe2+) | Нитрат (NO3-) |
| Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жёсткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трёхвалентное железо (Fe3+) также влияют на жёсткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, "вклад" в жёсткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Чем выше концентрация указанных двухзарядовых катионов Mg2+ и Са2+ в воде, тем вода жёстче. Наличие в воде этих катионов приводит к тому, что при использовании, например при стирке, обычного мыла (но не синтетического моющего средства) часть его расходуется на образование с этими катионами нерастворимых в воде соединений так называемых жирных кислот (мыло представляет собой смесь натриевых и калиевых солей этих кислот):
2С17 Н35 СОО- + Са2+ = (С17Н 35СОО)2Са
2С17Н 35 СОО- + Мg2+ = (С17Н 35СОО)2Mg
и пена образуется лишь после полного осаждения ионов.
Временная жёсткость воды обусловлена наличием в воде гидрокарбонатов, например, гидрокарбоната кальция Ca(HCO3)2 и магния Mg(HCO3)2.
При кипячении воды гидрокарбонаты разлагаются с образованием осадка среднего или основного карбоната:
Ca(HCO3)2 = СаСО3 + СО2+ Н2О,
Mg(HCO3)2 = Мg2 (ОН) 2 СО3 + 3СО2 + Н2О,
и жёсткость воды снижается. Поэтому гидрокарбонатную жёсткость называют временной.
Остальная часть жёсткости, сохранившаяся после кипячения воды, называется постоянной жёсткостью (или некарбонатная). Она обусловлена присутствием в ней сульфатов, хлоридов и других растворимых соединений кальция и магния, которые хорошо растворимы и так просто не удаляются.
Также различают и общую жёсткость воды. Она определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жёсткости.[2]
Общая и временная жесткость воды определяется путем титрования пробы воды растворами точно известной концентрации, а постоянная рассчитывается по разнице между общей и временной жесткостью.
Метод определения общей жесткости основан на образовании прочного комплексного соединения трилона Б с ионами кальция и магния.
Определение ионов железа
Оборудование и реактивы: 50% раствор KNCS, HCl-24%
Приближенное определение ионов Fe
| Окрашивание, видимое при рассмотрение пробирки сверху вниз на белом фоне | Примерное содержание ионов железа Fe+3 |
| Отсутствие Едва заметное желтовато-розовое Слабое желтовато-розовое Желтовато-розовое Желтовато-красное Ярко-красное | менее 0, 05 от 0, 05до 0, 1 от 0, 1 до 0, 5 от 0, 5 до 1, 0 от 1, 0 до 2, 5 более 2, 5 |
Определение
К 10мл исследуемой воды прибавляют 1-2 капли HCl и 0, 2 мл (4 капли) 50%-го раствора KNCS. Перемешивают и наблюдают за развитием окраски. Примерное содержание железа находят по таблице2. Метод чувствителен, можно определить до 0, 02 мг/л.
Fe3+ + 3NCS- = Fe(NCS)3
Определение сульфатов (качественное определение с приближённой количественной оценкой)
Оборудование и реактивы: Штатив лабораторный с пробирками, пипетки 5 и 10 см3 с делениями на 0, 1 см3, колбы мерные вместимостью 100, 500 и 1000 см3, пробирки колориметрические с притертой пробкой и отметкой на 10 см3, палочки стеклянные, воронки стеклянные, HCl(1:5), BaCl2. (5%), калий сернокислый, серебро азотнокислое, вода дистиллированная. Подготовка к анализу. Приготовление основного стандартного раствора сернокислого калия: 0, 9071 г K2SO4 растворяют в мерной колбе вместимостью 1 дм3 в дистиллированной воде и доводят объем раствора дистиллированной водой до метки. 1 см3 раствора содержит 0, 5 мг сульфат-иона.
Приготовление рабочего стандартного раствора сернокислого калия
Основной раствор разбавляют 1 : 10 дистиллированной водой. 1 см3 раствора содержит 0, 05 мг сульфат-иона.
Приготовление 5 %-ного раствора хлористого бария
5 г ВаСl2 растворяют в дистиллированной воде и доводят объем до 100 см3.
Приготовление 1, 7 %-ного раствора азотнокислого серебра
8, 5 г AgNO3 растворяют в 500 см3 дистиллированной воды и подкисляют 0, 5 см3 концентрированной азотной кислоты.
Проведение анализа
В колориметрическую пробирку диаметром 14-15 мм наливают 10 см3 исследуемой воды, добавляют 0,5см3 соляной кислоты (1:5). Одновременно готовят стандартную шкалу. Для этого в такие же пробирки наливают 2, 4, 8 см3 рабочего раствора сернокислого калия и 1, 6; 3, 2; 6, 4 см3 основного раствора K2SO4 и доводят дистиллированной водой до 10 см3, получая таким образом стандартную шкалу с содержанием: 10, 20, 40, 80, 160, 320 мг/дм3 сульфат-иона. Прибавляют в каждую пробирку по 0, 5 см3 соляной кислоты (1:5), затем в исследуемую воду и образцовые растворы по 2 см3 5 %-ного раствора хлористого бария, закрывают пробками, перемешивают и сравнивают со стандартной шкалой.
Определение иона свинца (качественное)
Йод калий дает в растворе с ионами свинца характерный осадок PbI2: Исследования производятся следующим образом. К испытуемому раствору прибавить немного KI, после чего, добавив CH3COOH, нагреть содержимое пробирки до полного растворения первоначально выпавшего мало характерного желтого осадка PbI2. Охладить полученный раствор под краном, при этом PbI2 выпадет снова, но уже в виде красивых золотистых кристаллов Pb2+ +2I- . = PbI2
Определение ионов меди (качественное)
В фарфоровую чашку поместить 3-5мл исследуемой воды, выпарить досуха, затем прибавить 1каплю конц. раствора аммиака. Появление интенсивно синего цвета свидетельствует о появлении меди
2Сu2+ +4NH4. ОН = 2[Cu(NH3)4]2+ +4H2O
Определение органических веществ в воде
Оборудование и реактивы: пробирки, пипетка на 2мл, HCl (1:3), KMnO4
Определение: Наливают в пробирки 2 мл фильтрата пробы, добавляют несколько капель соляной кислоты. Затем готовят розовый раствор KMnO4 и приливают его к каждой пробе по каплям. В присутствии органических веществ KMnO4 будет обесцвечиваться. Можно считать, что органические вещества полностью окислены, если красная окраска сохраняется в течение одной минуты. Посчитав количество капель, которое потребуется для окисления всех органических веществ, узнаем загрязненность пробы[5]
Методы устранения жёсткости воды
Для избавления от временной жёсткости необходимо просто вскипятить воду. При кипячении воды гидрокарбонаты разлагаются с образованием осадка среднего или основного карбоната:
Ca(HCO3)2 = СаСО3 + СО2+ Н2О,
Mg(HCO3)2 = Мg2 (ОН) 2 СО3 +3СО2 + Н2О,
и жёсткость воды снижается. Поэтому гидрокарбонатную жёсткость называют временной.
Умягчить жёсткую воду можно и обработкой воды различными химическими веществами. Так, временную (карбонатную) жёсткость можно устранить добавлением гашеной извести:
Са2+ +2НСО-3 + Са2+ + 2ОН- = 2СаСО3+ 2Н2О
Mg2+ +2НСО-3 + Са2+ + 4ОН- = Mg(ОН) 2+2СаСО3+ 2Н2О.
При одновременном добавлении извести и соды можно избавиться от карбонатной и некарбонатной жёсткости (известково-содовый способ). Карбонатная жёсткость при этом устраняется известью (см. выше), а некарбонатная - содой:
Са2+ + СО2-3 = СаСО3 Mg2+ + СО2-3 = Mg СО3
и далее Mg СО3 + Са2+ + 2ОН- = Mg(ОН) 2+СаСО3
Вообще, с постоянной жёсткостью бороться труднее. Кипячение воды в данном случае не приводит к снижению её жёсткости. [10]
Для борьбы с постоянной жёсткостью воды используют такой метод, как вымораживание льда. Необходимо просто постепенно замораживать воду. Когда останется примерно 10 % жидкости от первоначального количества, необходимо слить не замершую воду, а лёд превратить обратно в воду. Все соли, которые образую жёсткость, остаются в незамерзшей воде.
Ещё один способ борьбы с постоянной жёсткостью - перегонка, т.е. испарение воды с последующей её конденсацией. Так как соли относятся к нелетучим соединениям, то они остаются, а вода испаряется.
Также, чтобы избавиться от постоянной жёсткости, можно, например, к воде добавить соду:
СаСl2 + Na2CO3 = CaCO3 + 2NaCl.
В настоящее время для борьбы с жёсткой водой существуют и более современные способы, чем кипячение воды или вымораживание, например, установка фильтров-умягчителей. Они смягчают воду и в результате, она обладает лучшими вкусовыми качествами и более благоприятно воздействует на кожу человека.[4]
Способы очистки воды
Способы очистки воды сегодня, могут порадовать своим многообразием от почти бесплатных и народных до высокотехнологичных и дорогих.
Очистка воды частичным замораживанием
Очистка воды по принципу обратного осмоса
Очистка воды озоном
Очистка воды методом опреснения воды
Подбирая систему водоочистки для своего жилища, надо отдавать себе отчет в том, что вода будет использоваться как в хозяйственно-бытовых целях, так и для питья и приготовления пищи.
Такие системы подразделяют на те, которые устанавливаются там, где вода поступает в дом, и на те, которые ставятся в точке пользования, например, на кухне. Первые делают воду "хозяйственно-бытовой": с ней нормально работает стиральная машина, можно помыть посуду, ополоснуться под душем. Вторые - готовят питьевую воду.
Очистка воды частичным замораживанием
Метод очистки воды от растворенных в ней веществ весьма прост. Он основан на эффекте вымораживания примесей. Ведь при замерзании вода образует кристаллы чистого льда. А вот "рассол" с примесями остается в жидком состоянии и располагается в ячейках между кристаллами. Кроме того, "рассол" имеет больший удельный вес и постепенно проникает сквозь пористую массу кристаллов, собираясь в центральной и отчасти нижней зоне объема. Остается слить "рассол" в мойку, подождать, когда лед почти весь растает, выбросить оставшуюся сосульку и использовать совершенно чистую воду для приготовления пищи. Чистую талую воду можно пить.
Такой способ получения воды не требует особых расходов - подойдет обычный домашний холодильник с большой морозильной камерой.
В каждом доме найдется невысокая кастрюля объемом до 3 литров с широкой горловиной. Заполните ее на две трети водопроводной водой, прикройте крышкой, поставьте в морозильную камеру на подкладку из фанеры. Времени на замерзание примерно половины исходного объема воды потребуется около 12 часов. Это позволит повторить цикл в сутки еще раз и получить до 6 литров пресного льда, вполне достаточно для 3-4 человек. Еще удобнее использовать пластиковые бутылки из-под минеральной воды. Тогда можно получить гораздо больший объем талой воды, так как бутылки удобно размещать в морозильной камере.
Если же у вас есть время и желание получить и употреблять идеальную «живую» талую воду, есть рецепт для гурманов - поставьте контейнер в морозилку и подождите примерно час-два, пока сверху не образуется тонкий слой льда. Это так называемое место дейтерия, где скапливаются все возможные тяжелые элементы, его удаляют. Точно также и вынимайте воду чуть раньше, чтобы она замерзла не совсем. В центре бутылки остался небольшой участок незамерзшей воды, где концентрируются возможные примеси, ножом пробивают отверстие и эту воду тоже сливают, оставшийся лед растаивают и получают талую воду.
Исследовательская часть
Изучив способы очистки воды и методики определения химических показателей, я решила определить качественный состав примесей и проверить, насколько отличаются две пробы воды из одного колодца: сырая вода и размороженная ( талая) вода.
Для своих исследований я использовала воду из колодцев в деревне Новоселки (№1) и деревне Моствилишки (№2). Глубина обоих колодцев составляет более 8 метров. Было взято по три пробы воды из каждого колодца: первая проба в октябре, вторая и третья- в марте. Сразу отмечу, что весеннее таяние снега не повлияло на состав воды. Из каждой пробы было взято по два литра воды. Из них один литр был подвергнут заморозке, а потом оттаиванию. При этом строго соблюдались рекомендации по получению размороженной воды. В результате для исследований я имела обычную колодезную и размороженную воду.
С данными пробами были проведены следующие исследования.
I. Определены физические показатели воды:1. Мутность
2. Прозрачность
3.Осадок
4.Запах
II Определены химические показатели воды:
1. Определение pH универсальным индикатором
2. Определение органических веществ в воде
3. Определение концентрации катионов железа
4. Определение сульфатов
5. Определение ионов свинца
6. Определение ионов меди.
7. Исследование осадка в пламени спиртовки.
III Определена масса осадка после кипячения
Физические показатели воды колодцев №1 и №2
1.Для определения мутности воду взбалтывают, наливают в пробирку так, чтобы высота воды была равна 10 см и рассматривают в проходящем свете. Мощность выражается в условных единицах: слабая, заметная, сильная.
Результат: Вода в обоих пробах не мутная
2.Определили прозрачность воды путем чтения шрифта через столб воды. На листок с шрифтом поставили стакан. Воду наливали в стакан постепенно, следя за четкостью шрифта до тех пор, пока буквы станут плохо различимы. Высота столба воды, налитой в цилиндр, выраженная в сантиметрах, явилась показателем прозрачности.
Результаты: Вода в обоих пробах прозрачна. Высота столба воды равна высоте стакана -15 см
4.Осадок воды обусловлен оседанием взвешенных частиц, которые имелись в воде. Описывается осадок после отстоя воды как ничтожный, незначительный, заметный, большой.
Результаты: В обоих пробах осадка нет.
5.Определили запах воды. Запах определяется при комнатной температуре и при нагревании до 50о – 60°С. Характеризуя качество (гнилостный, болотный, землистый …) силу запаха определяют по пятибалльной шкале:
Результаты: В обоих пробах запах не ощущается (0 баллов).
Таким образом, по физическим свойствам колодезная и размороженная вода не отличаются.
Химические показатели колодезной воды:
1. Показатель рН
Пробы №1, №2 - рН равен 7
2. Определение органических веществ в воде
Обе пробы отрицательны
3. Определение концентрации катионов железа
Обе пробы (колодец №1 и 2)- незначительное изменение окраски раствора, что свидетельствует о присутствии ионов железа
4.Определение сульфатов
Незначительное помутнение раствора, что свидетельствует об образовании осадка сульфата бария, а значит, о наличии сульфат- ионов в воде.
5.Определение ионов свинца
Обе пробы отрицательны
6.Определение ионов меди.
Обе пробы отрицательны
7.Исследование осадка в пламени спиртовки.
Пламя окрасилось в кирпично- красный цвет, что свидетельствует о присутствии кальция в воде в виде солей, которые обеспечивают жесткость воды.
В талой воде результаты опытов 3 и 4 отрицательны.
Определение массы осадка в колодезной воде и размороженной воде
Колодец №1: проба №1 - колодезная вода, проба №1а – талая вода
Колодец №2: проба №2- колодезная вода, проба № 2а – талая вода
Все пробы прокипятила, дала осадку отстояться, а затем выпарила раствор и взвесила осадки.
Масса осадка, полученного при кипячении колодезной воды
Проба №1 -0,150г
Проба №2 – 0,130г
Масса осадка, полученного при кипячении размороженной воды
Проба №1а- 0,03г
Проба №2а- 0,02 г
Разница в массе осадка составила
1. 0.150: 0.03=5
2. 0,130: 0,02 =6,5, в среднем масса осадка в талой воде в 6 раз меньше массы осадка в колодезной воде
К осадку я добавила соляной кислоты, началось бурное выделение газа, что характерно для карбонатов, следовательно, осадок состоит из карбонатов кальция и магния.
Выводы и рекомендации
Проблема качества питьевой воды затрагивает очень многие стороны жизни человеческого общества в течение всей истории его существования. В настоящее время питьевая вода - это проблема социальная, политическая, медицинская, географическая, а также инженерная и экономическая. Без всякого преувеличения можно сказать, что высококачественная вода, отвечающая санитарно-гигиеническим и эпидемиологическим требованиям, является одним из непременных условий сохранения здоровья людей. Но чтобы она приносила пользу, ее необходимо очистить от всяких вредных примесей и доставить чистой человеку.
Проведенные мною исследования показали наличие в колодезной воде примесей, которые можно удалить путем замораживания воды и получения талой воды. Талая вода пригодна для питья в сыром виде. При кипячении талая вода теряет свои чудесные свойства, но является очень чистой водой. Такую воду можно использовать для приготовления чая, пищи и особенно для приготовления детского питания.
Выводы:
1. В размороженной (талой) воде содержится примесей меньше, чем в колодезной: масса осадка, образуемого после кипячения размороженной воды, в среднем в 6 раз меньше, чем при кипячении колодезной воды.
2. Приготовить размороженную воду можно в домашних условиях.
3. Заморозку можно использовать как способ очистки воды в домашних условиях.
Список используемой литературы
Кочергин Б.Н. Химический словарь школьника. - Минск: «Народная асвета», 1990г.
Потапов В.М., Хомченко Г.П. Химия. - М.: «Высшая школа», 1982г.
Скоробогатов Г.А., Калинин А.И. Осторожно! Водопроводная вода! Ее химические загрязнения и способы доочистки в домашних условиях - СПб.: Изд-во С.-Петерб. ун-та, 2003.)
Похожие работы
... оболочки Земного шара постоянно обмениваются углекислотой с горными породами, растительным и животным миром, что также способствует стабилизации климата. 2. Вода, дарующая жизнь 2.1 Вода и жизнь. Вода и здоровье Питьевая вода - важнейший фактор здоровья человека. Практически все ее источники подвергаются антропогенному и техногенному воздействию разной интенсивности. Санитарное состояние ...
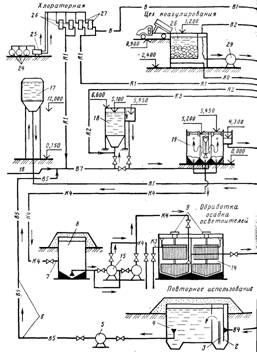
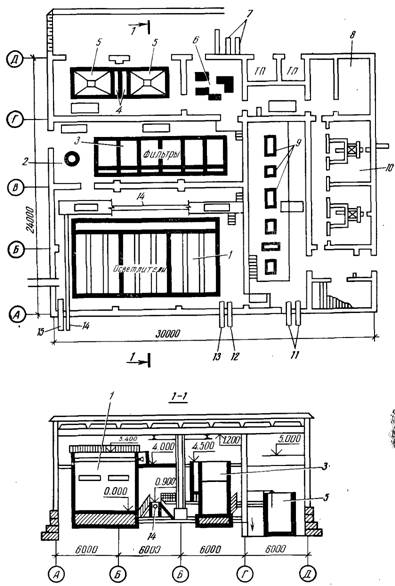
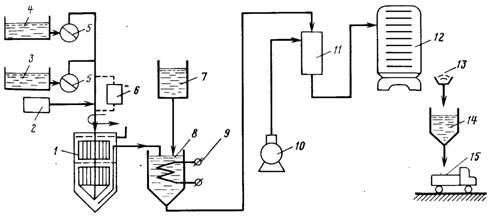
... . Каналы и трубы обвязки сооружений должны быть рассчитаны с запасом на возможность пропуска воды после реконструкции отдельных водоочистных сооружений или целых блоков. При проектировании генерального плана водоочистного комплекса необходимо предусматривать минимальную протяженность путей перемещения реагентов; максимально возможную механизацию погрузочно-разгрузочных работ и смены загрузки ...
... высококачественную питьевую воду, которая по своим структурным и биофизическим характеристикам максимально должна соответствовать свойствам внутриклеточной воды организма. В природе такой питьевой воды сегодня становится все меньше и меньше. Отсюда следует, что для жизни человека необходима не просто питьевая вода чистая, доочищенная или альпийская, нужна питьевая вода, которая имеет определенную ...
... в период брожения). Безопарным способом обычно готовят ситнички, московские калачи, московские булочки, рожки, рогалики, а также хлеб из пшеничной муки высшего и I сортов с низкой кислотностью. 3 Технологические процессы, протекающие при созревании теста 3.1 Приготовление теста Для каждого сорта хлеба существуют унифицированные рецептуры, в которых указывают сорт муки и расход каждого вида ...






0 комментариев