Навигация
Статистическая обработка результатов
2.5 Статистическая обработка результатов
Статистический анализ осуществлялся с помощью программы Statistica 7 с использованием t-критерия Стьюдента.
Различие считалось достоверным при уровне значимости Р<0,05.
Все исследования выполнены в лаборатории функциональной биохимии нервной системы института Высшей нервной деятельности и нейрофизиологии РАН.
Автор выражает глубокую благодарность за оказанную всестороннюю помощь при выполнении работы сотрудникам лаборатории функциональной биохимии нервной системы института Высшей нервной деятельности и нейрофизиологии РАН, отдельно к.б.н. Онуфриеву Н.В. и д.б.н., профессору Гуляевой Н.В.
Глава 3. Полученные результаты и их обсуждение
Экспрессия белков клеточного цикла и Cdk 5 имеет различный уровень в исследованных отделах мозга и зависит от функционального состояния сусликов.
Гибернация достоверно снижает в гиппокампе уровень экспрессии Cdc 2, Cdk 2 и Cdk 4, а экспрессия MCM 2 и Cdk 5 имеет лишь тенденции к снижению по сравнению с контролем (активные животные) (рис.2) . Экспрессия циклинов. А и В1 остаётся практически на том же уровне, что и у активных сусликов. У спонтанно пробудившихся животных уровень экспрессии исследуемых белков также существенно не изменялся по сравнению с контролем. Однако на стадии пробуждения при температуре + 25°С была выявлена положительная корреляция между циклином В1 и МСМ 2 (r = 0,97 ,p < 0,05). Возможно, на стадии пробуждения при температуре + 25°С образование МСМ 2 идет однонаправленно с биосинтезом Сn B1 в отличие от пробуждения при температуре + 10°С (известно, что комплекс МСМ 2/МСМ4 является субстратом для комплекса Cdc2/Cn B1 in vitro). МСМ 2 является маркёром репликации ДНК, его уровень возрастает при переходе клетки из фазы G1 в S фазу клеточного цикла. А циклин В1 активируется в конце фазы G2, образуя комплекс с Cdc 2, небходимый для начала последней стадии цикла – М фазы (собственно митоза).
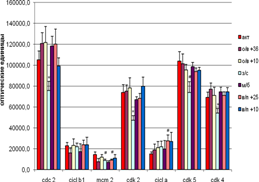
Рис. 2 Экспрессия исследуемых белков в гиппокампе сусликов CITELLUS UNDULATUS на разных стадиях гибернационного цикла
Отличия от группы контрольных животных: * - p < 0,05; # - p < 0,1.
В коре больших полушарий мозга на экспрессию белков влияла температура окружающей среды, при которой животные находились на стадиях вхождения в спячку и выхода из неё (рис. 3). Достоверными являются различия уровня экспрессии Cdk 5 и Cdk 4 внутри групп вхождения и выхода из спячки; Cdc 2 и MCM 2 – внутри группы входа из спячки; циклина В1 – внутри группы вхождения в спячку. Так,по сравнению с контрольной группой животных на стадии пробуждения при +10°С достоверно возрастал уровень экспрессии Cdc 2, MCM 2 и Cdk 4 . При +25°С достоверно снижалась экспрессия Cdk 4; на уровне тенденций экспрессия Cdc 2 снижалась, а циклина В1 и MCM 2 - повышалась. При вхождении в спячку при +10°С достоверно возрастала экспрессия MCM 2 и Cdk 4,снижалась экспрессия Cdk 5 ; а при + 36°С на уровне тенденций изменялась только экспрессия Cdk 4 (уменьшалась).
У спящих животных по сравнению с контрольной группой различий в экспрессии исследуемых белков не наблюдалось. В межбаутный период достоверно уменьшалась экспрессия циклина В1 и увеличивалась экспрессия Cdk 4, экспрессия Cdk 5 имела тенденцию к снижению. В межбаутный период была выявлена отрицательная корреляция между Cdk 2 и циклином В1 (r = - 0,98 ,p < 0,05).
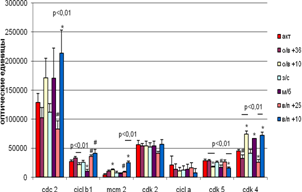
![]()
Рис. 3 Экспрессия исследуемых белков в коре больших полушарий мозга сусликов CITELLUS UNDULATUS на разных стадиях гибернационного цикла
Отличия от группы контрольных животных: * - p < 0,05; # - p < 0,1.
В мозжечке не наблюдается достоверных различий внутри групп вхождения и выхода из спячки при различных температурных режимах содержания животных (рис. 4). Однако на стадии вхождения в спячку (в сравнении с контролем) наблюдается достоверное увеличение экспрессии Cdk 2 как при + 36°С, так и при + 10°С, а Cdk 4 – только при + 10°С. Экспрессия МСМ2 и циклина А увеличивается на уровне тенденций. Выход из спячки при + 10°С сопровождается достоверным увеличением экспрессии Cdc 2 и Cdk 2 , а Cdk 4 и Cdk 5- увеличением на уровне тенденций. При пробуждении при температуре +25°С тенденции к увеличению экспрессии имеют циклин В1, МСМ2, Cdk 2 , Cdk 4 и Cdk 5.
У спящих животных достоверно снижалась экспрессия только Cdc 2.
Успонтанно пробудившихся животных достоверно возрастала экспрессия только Cdk 4, а количество остальных белков колебалось на уровне контроля.
Положительная корреляция была выявлена между Cdc 2 и циклином В1 (r = 0,97 ,p < 0,05) на стадии вхождения в спячку при температуре + 10°С , отрицательная – на стадии пробуждения при температуре + 25°С между Cdk 2 и циклином А. Наверное различную роль играют Cdc 2 и циклин В1 на стадии вхождения в спячку, когда пролиферация снижается и при пробуждении, когда она более вероятна.
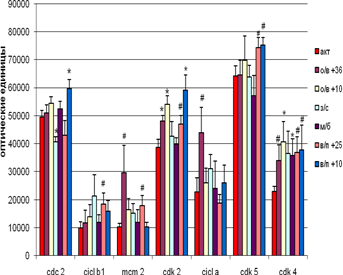
Рис.4 Экспрессия исследуемых белков мозжечке сусликов CITELLUS UNDULATUS на разных стадиях гибернационного цикла
Отличия от группы контрольных животных: * - p < 0,05; # - p < 0,1.
В стволе мозга гибернация не вызывала достоверных изменений в экспрессии исследуемых белков, только уровень МСМ2 имел тенденцию к увеличению.
В межбаутный период экспрессия белков изменялась недостоверно.
Уровень экспрессии циклина А достоверно повышался при вхождении в спячку при температуре +36˚С и при выходе из неё при температуре +25˚С, на уровне тенденции – при пробуждении при температуре +10˚С. Достоверным является различие в экспрессии Cdk 2 в группе выхода из спячки при разных температурных режимах (при температуре +25˚С – уменьшалась, а при +10˚С - увеличивалась ). Различия наблюдаются только внутри группы и отсутствуют при сравнении с активными и межбаутными. Хотя при низкой температуре тела во время выхода выхода из спячки экспрессия некоторых белков в основном повышается!
Отрицательные корреляции были выявлены между Cdk 2 и циклином А (r = -0,99 ,p < 0,05) на стадии пробуждения при температуре +10˚С и между Cdk 2 и циклином В1 при вхождении в спячку при температуре +36˚С.
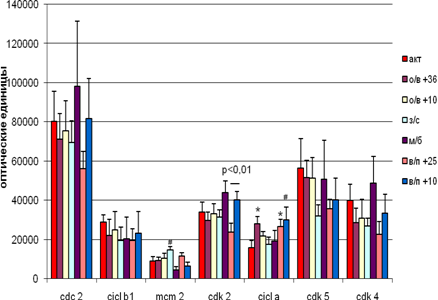
Рис. 5 Экспрессия исследуемых белков стволе мозга сусликов CITELLUS UNDULATUS на разных стадиях гибернационного цикла
Отличия от группы контрольных животных: * - p < 0,05; # - p < 0,1.
Особенностью метаболизма мозга является интенсивный окислительный обмен. Основным субстратом энергетического метаболизма мозга является глюкоза [ 14 ]. Клетки головного мозга утилизируют 20% кислорода, потребляемого организмом, хотя сам мозг составляет около 2% от массы тела [ 14, 17 ], что обуславливает потенциальную возможность образования большого количества АФК в процессе окислительного фосфорилирования. Это обстоятельство предопределяет потребность мозга в высоком уровне кровоснабжения.
В различные периоды гибернационного цикла существенно меняется интенсивность метаболических процессов и интенсивность энергетического обмена в тканях, в том числе и головном мозге [ 35, 39 ]. Но именно ведущая роль в функциональных нейрохимических процессах в мозге принадлежит несомненно белково – нуклеиновому метаболизму [ 3 ]. В течение спячки сусликов наблюдается подавление синтеза белков в головном мозге и очень резкая активация образования белков при побуждении [ 4 ]. Поэтому можно ожидать, что уровень экспрессии белков клеточного цикла и Сdk 5 в различных отделах мозга будет зависеть от физиологического состояния животных в период гибернации.
Ряд данных указывает на то, что при гибернации повышается устойчивость головного мозга к повреждающим факторам. Например, Фрерих и Халенбек установили, что срезы гиппокампа у гибернирующих 30-ти линейных сусликов имеют повышенную толерантность к гипоксии и агликемии [ 25 ]. Зои с сотр. показали, что в состоянии зимней спячки значительно снижается в мозге вызванный повреждением окислительный стресс [ 42].
При гибернации существенно изменяется липидный состав мембран клеток мозга [ 7 ]. Кроме того, при переходе сусликов от бодрствования к спячке происходит латеральное разделение липидов мембран [ 15 ]. В результате этого образуются большие липидные области содержания ненасыщенных жирных кислот, а белки скапливаются в отдельные узкие зоны. Изменение липидного состава и их упаковки при гибернации направлено на сохранение структурной целостности и функциональных свойств мембран.
Последние данные показывают, что в мозге гибернирующих сусликов связанный с микротубулином белок tau гиперфосфорилирован по всем шести сайтам (S199, T205, S214, S262, S396, S404). Интересно, что только три из этих сайтов (S199, S262 и S404) являются дефосфорилированными у пробуждающихся животных, что предполагает обратимое фосфорилирование указанных сайтов [ 28 ]. У активных летом сусликов наблюдается самый низкий уровень уровень фосфорилирования. Известно, что белок tau аномально гиперфосфорилирован в мозге особей с болезнью Альцгеймера и других tau – патологий и, как предполагают, играет важную роль в патогенезе этих заболеваний. А поскольку механизмы, приводящие к аномальному фосфорилированию tau остаются неясными, то последние наблюдения обратимого фосфорилирования этого белка во время гибернации являются идеальной физиологической моделью для изучения данного процесса in vivo.
Выводы
1. Экспрессия белков клеточного цикла и Cdk 5 имеет различный уровень в исследованных отделах мозга и зависит от функционального состояния сусликов.
2. Температура тела сусликов влияет на экспрессию белков клеточного цикла и Cdk 5 в коре больших полушарий и стволе мозга на стадиях вхождения в спячку и выхода из неё.
3. Наличие корреляционных связей между циклинами и соответствующими киназами позволяет предположить, что в отделах мозга сусликов на стадиях вхождения в спячку и выхода из неё появляются клетки на поздних фазах клеточного цикла.
Литература
1. Белоусов А.Б. Роль центральной нервной системы в контроле зимней спячки // Усп. физиол. наук. – 1993. – Т. 24, № 2. – С. 109-126.
2. Дарзалиа В., Хелманн У., Линдвалл О., Кокаиа З. Нейрогенез в стареющем головном мозге после инсульта // Инсульт. – 2007, № 1.
3. Демин М.М., Шортанова Т.Х., Эмирбеков Э.З. Нейрохимия зимней спячки млекопитающих. Л.: Наука, 1988. –137 с.
4. Жегунов Г.Ф. , Микулинский Ю.Е. Активация синтеза белка в тканях сусликов при пробуждении после зимней спячки // Укр. биохим. журн. 1987. Т. 59, № 3. С. 69-73.
5. Игнатьев Д.А., Сухова Г.С. Сухов В.П. Анализ изменений частоты сердцебиений и температуры суслика Citellus Undulatus в различных физиологических состояниях // Общая биология – 2001. – Т. 62, №1. – С. 66-77.
6. Калабухов Н.И. Спячка млекопитающих. М.: Наука, 1985. – 259 с.
7. Коломийцева И.К., Перепелкина Н.И., Патрушев И.В., Попов В.И. Роль липидов в сборке эндоплазматического ретикулума и диктиосом якутского суслика Сitellus undulates при гибернации // Биохимия. – 2003. – Т. 68, вып. 7. – С. 954-967.
8. Крепс Е.М. Липиды клеточных мембран. Л.: Наука, 1981. - С.339.
9. Соломонов Н.Р. Основные итоги и задачи изучения зимней спячки грызунов Якутии // Эколого-физиологические характеристики природных гипометаболических состояний. – Пущино, 1992. – С. 29-34.
10. Штарк М.В. Мозг зимоспящих. Новосибирск: «Наука», 1970. – 240 c.
11. Шугалей Л.С. Молекулярные основы устойчивости зимоспящих животных к неблагоприятным условиям среды // Эколого-физиологические характеристики природных гипометаболических состояний: Сб. науч. тр. / Под ред. Колаевой С.Г. – Пущино, 1992. – С. 70-73.
12. Эмирбеков Э.З., Львова С.П., Кличханов Н.К. Биохимические изменения в крови при искусственной и естественной гипотермии // Пробл. криобиол. – 1995. - №1. – С.14-21.
13. Эмирбеков Э.З., Львова С.П., Мусаев Б.С., Мейланов И.С., Симмалавонг Сантисук, Бутаева П.Ш., Абдулаева М.З. Роль липидов мозга при гипотермии и самосогревании гомойотермных и зимоспящих животных // Биохим. аспекты холодовых адаптаций: Сб. науч. тр. - Харьков, 1991. – С. 166-175.
14. Ames I.A. CNS energy metabolism as related to function // Brain Research Rew. – 2000. – V. 34. – P. 42-68.
15. Azzam N.A., Hallenbeck J.M., Kachar B. Membrane changes during hibernation // Nature. – 2000. – V. 407. – P. 317-318.
16. Bradford M.M. A rapid and sensitive method for quantitation of microgram quantities of protein using the principle of protein bindong // Anal. Biochem. 1976. – V. 72. – P. 248-254.
17. Clarke D.D., Sokoloff L. Circulation and energy metabolism of the brain // Basic Neurochemistry: Molecular, Cellular and Meducal Aspects. Sigel G.J., Agranoff B.W., Alberts R.W., Fisher S.K., Uhler M.D. (Eds.) – Phyladelphia:Lippincott – Raven. – 1999. – P 637-669.
18. Christina G. von der Ohe, Craig C. Garner, Corinna Darian-Smith, H. Craig Heller. Synaptic Protein Dynamics in Hibernation. // Neurosciens. – 2007.- Nov 9; 149 (3).
19. Christina G. von der Ohe, Craig C. Garner, Corinna Darian-Smith, H. Craig Heller. Ubiquitos and Temperature - Dependent. // Neurosciens. – 2008.- Apr 9; 152 (4).
20. Copani Agata; Uberti Daniela; Sortino Maria Angela; Bruno Valeria; Nicoletti Ferdinando and Memo Mauritio. Activation of cell-cycle-associated proteins in neuronal death: a mandatory or dispensable path? Trends in Neuroscience. 2001 Jan; 24 (1): 25-31.
21. Copani А.; Sortino M. A.; Nicoletti F. and Stella Giuffrida A. M. Alzheimer’s Disease Research Enters a “New Cycle”: How Significant? // Neurochemical Research. 2002 Feb; 27 (Nos. 1/2): 173-176.
22. Drew K.L., Rice M.E., Kuhn T.B., Smith M.A. Neuroprotective adaptations in hibernation: therapentic implications for ischemia-reperfusion, traumatic brain injury and neurodegenerativedislases // Free Radic. Biol. Med. – 2001. –V. 31. – P. 563-573.
23. Droge W. Free Radicals in the Physiological control of cell Function // Physiol. Rev. – 2002. – V. 82. – P. 47-95.
24. Fang Zhou, Xiongwei Zhu, Rudy J. Castellani,Raphaela Stimmelmayr, George Perry, Mark A. Smith, and Kelly L. // Drew Hibernation, a Model of Neuroprotection // American Journal of Pathology, V. 158, No. 6, June 2001.
25. Frerichs K.U., Kennedy C., Sokoloff L., Hallenbeck J.M. Local cerebral blood flow during hibernation, a model of natural tolerance to «cerebral ishemia» // J Cereb Blood Flow Metab. – 1996. – V. 14. – P. 193-205.
26. Frerichs K.U., Hallenbeck J.M. Hibernation in ground squirrels induces stats and species-specific tolerance to hypoxia and aglycemia: an in vitro study in hippocampal slices // J. Cereb. Blood Flow. Metab. – 1998. – V. 18. – P. 168-175.
27. Hermes-Lima M., Zentenc-Sakin T. Animal response to drastic changes in oxygen akailability and physiological oxidative stress // Comp. Biochem. Physiol. C. Toxicol. Pharmacol. – 2002. – V/ 133/ - P. 537-556.
28. Jens Thorsten Stieler, Torsten Bullman, Franziska Kohl, Brian M. Barnes, Thomas Arendt. Physiological regulation of tau phosphorylation during hibernation. // J Neural Transm. – 2009 (116): 345 – 350.
29. Lipton Р. Ischemic cell death in brain neurons // Physiol. Rev. – 1999. – V. 79. – P. 1431-1568.
30. Nagy Zs. Cell cycle regulatory failure in neurones: causes and concequences. Neurobiology of Aging. 2002 (21): 761-769.
31. Nagy Zs.; Esiri M. M.; Cato A.-M. and Smith A. D. Cell cycle markers in the hippocampus in Alzheimer's disease // Acta Neuropathol. 1997 (94): 6-15.
32. Nurnberger F. The neuroendocrine system in hibernating mammals // Cell and Tissue. Res. – 1995. – V. 28. – P. 391-412.
33. Ohnuma Shin-ichi; Philpott Anna and A Harris William. Cell cycle and cell fate in the nervous system. Current Opinion in Neurobiology. 2001 (11): 66-73.
34. Storey K.B. Turning down the fires of life: metabolic regulation of hibernation and estivation // Mol. mech. metab. Arrest. – 2001. – P. 1-21.
35. Storey K.B., Storey J.M. Metabolic rate depression in animals: transcriptional and translational controls // Biol. Rev. Camp. Philos. Soc. – 2004. – V. 79. – P. 207-233.
36. Toien O., Drew K.L., Chao M.L., Rice M.E. Ascorbat dynamics ana oxygen consumption during arousal from hibernation in arctic ground squirrels // Am. J. Physiol. – 2001. – V. 281. – P. 572-583.
37. Van Brenkelen F., Martin S.L. Reversible depression of transcription during hibernation // J. Comp. Physiol. (B). – 2002-V. 172. – P. 355-361.
38. Wang L.C.H. Energetic and field aspects of mammalian torpor: the Richardson groundsquirrel // Strategus in Cold: Natural Torpidity and Thermogenesis // Eds L.C.H. Wang, J.W. Hudson, N.Y.: Acad. Press. – 1978. – P. 109-145.
39. Wang L.C.H., Lee T.F. Torpor and hibernation in mammals: metabolic, physiological, and biochemical adaptations // Handbook of physiology: Oxford univer. Press., 1996. - № 4. – P. 507-531.
40. Yeh J., Tam C.F., Catuirs E., Le T.T., Papa V., Pena L., Vasquez M., Vu C., Wang S., Lopez G.A. Changes in karious plasms lipid components, glucose, and insulin in spermophilus lateralis during hibernation // Comp. Biochem. Physiol. B. Biochem. Mol. Biol. – 1996. – V. 111. – P. 651-663.
41. Young J.S., Woodside J.V. Antioxidants in health and disease // J. Clin. Pathol. – 2001. V. 54. – P. 176-186.
42. Zhou G., Zhu X., Castellani R.J., Stinnelmayr R., Perry G., Smith M.A., Drew K. Hibernation, a model of neuroprotection // Am. J. Pathol. – 2001. – V. 158. – P. 2145-2151.
0 комментариев