Навигация
2.4 Кольоровість води
Кольоровість прісних вод визначається в умовних одиницях - градусах платиново-кобальтової шкали. Кольоровість води, яка перевищує 30°, береться як висока.
Колір природних вод залежить від забарвлення розчинених у ній речовин, завислих частинок та мікроорганізмів, що населяють водну товщу. Він зумовлений поєднанням властивостей водного середовища, берегів водойми та метеорологічними факторами. На колір води впливають завислі речовини автохтонного (внутрішньоводоймного) та алохтонного (надходять ззовні) походження [27].
Власний колір води (блакитний) виявляється лише у воді деяких чистих гірських озер. Цей колір залежить від вибіркового поглинання променів сонячного спектру: найперше у воді затухають найдовші світові хвилі (червоної частини спектру), а останніми — короткі хвилі його синьої частини. Сонячне світло, проходячи через воду, втрачає червоні промені, поступово перетворюючись з білого в синє.
Природні води можуть мати зелене, жовте, буре і навіть чорне забарвлення, що зумовлено переважно наявністю гумінових речовин.
Крім того, колір води часто змінюється внаслідок масового розвитку певних планктонних організмів («цвітіння»). Це так зване вегетаційне забарвлення. Зокрема, при «цвітінні» синьо-зеленими водоростями вода набуває відповідного кольору, а при їх розкладі — навіть темно-синього внаслідок виділення пігментів фікоціану і фікобілінів. Зелені водорості забарвлюють воду в зелений колір, діатомові надають їй жовтуватого відтінку, дуналіела солоноводна (Dunaliella salina), червона евглена (Euglena rubra) і примнезій маленький (Primnesium parvum) — червоного кольору.
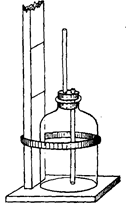
Кольоровість прісних вод визначається порівнянням досліджуваного зразку зі стандартними розчинами, виготовленими з хлорплатинату калію (К2РtСl6) та хлористого кобальту (СоСl2*6Н2О). Можна також приготувати стандарт з К2Сr2О7 та хлористого кобальту. Зважують на аналітичних вагах 0,0872 г К2Сr2О7 і 2 г хлористого кобальту, розчиняють реактиви у невеликій кількості дистильованої води в мірній літровій колбі, додають 1 мл концентрованої сірчаної кислоти (H2SO4) та доводять дистильованою водою до 1 л. Кольоровість цього розчину дорівнює 500°. Стандарти для порівняння готують розведенням вихідного розчину дистильованою водою, 1 л якої вміщує 1 мл концентрованої сірчаної кислоти.
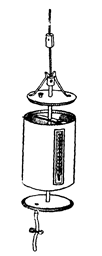
У випадку неможливості приготування повної шкали стандартів, кольоровість визначають у парних колориметричних циліндрах однакового діаметру з нефарбованого скла, поділених на мілілітри (від 1 до 100) і забезпечених знизу скляними кранами. В один з таких циліндрів наливають (до мітки) досліджувану воду, у інший - стандартний розчин, кольоровість якого не дуже відрізняється від кольоровості досліджуваної води (такий стандарт отримують розчиненням у 5, 10, 20 або 50 разів вихідного розчину в 500°). Дивлячись зверху униз (крізь увесь шар рідини) на білому фоні, зливають інтенсивніше зафарбовану рідину до тих пір, поки колір рідини в обох циліндрах не буде однаковим. Висота столбу рідини обернено пропорційна інтенсивності її зафарбування. Тому кольоровість досліджуваної води розраховують за формулою:
Кольоровість висота столба стандарту (мл)*кольоровість стандарту (градуси) (градуси) висота столба досліджуваної води (мл)
2.5 Вміст хімічних речовин
Під густиною розуміють масу одиничного об'єму води в кілограмах на 1 м3 — (кг/м3). Вона залежить від температури, наявності розчинних солей, а також від атмосферного тиску та вищерозташованих мас води.
Найбільша густина хімічно чистої води, яка практично не має розчинених солей, при температурі 3,98°С дорівнює 1 г/см3. Із зниженням температури до 0°С, коли вода ще не перетворилась у лід, її щільність становить 998,87 кг/м3. При переході у стан льоду вона відразу зменшується до 916,7 кг/м3. Падає густина і при підвищенні температури води вище 4°С. При досягненні 30°С вона становить 995,67 кг/м3.
Збільшення густини води з підвищенням температури пояснюється зближенням молекул при таненні льоду, внаслідок чого зникають міжмолекулярні порожнини. Подальше зростання температури призводить до розходження молекул Н2О, внаслідок чого густина води стає меншою від одиниці. Зміна густини води при різних температурах характеризується такими показниками:

На густину води впливає, крім температури, також кількість розчинених солей. Із зростанням мінералізації дещо підвищується і густину води. Але між температурою, мінералізацією і густина води немає лінійної залежності. Тобто, густина води зменшується в меншій мірі, ніж це можна було чекати від ступеню зростання температури води і її мінералізації. Така властивість води обумовлює виключно важливу її роль у забезпеченні стійкості водних екосистем та підтриманні якості води. Наприклад, при змішуванні вод різної температури і мінералізації утворюється змішана вода, яка має дещо більшу густину, ніж кожна з них окремо. Так, при надходженні морської солоної води в Дніпровсько-Бузький лиман, де вона змішується з прісною, спостерігається ущільнення річкової води, що і обумовлює її зосередження переважно у придонних шарах. Перехідна зона між окремими масами води, які мають різну температуру і солоність і в якій спостерігається ущільнення вод, називається гідрологічним фронтом. Така зона може виявлятись на межі між прісними і солоними водами у гирлах річок (естуарний фронт), які впадають у море.
Подібні явища спостерігаються у Чорному морі біля берегів Криму як наслідок підйому глибинних більш холодних вод на поверхню під час згону вітром вод поверхневого шару. Таке явище отримало назву апвелінг [27].
Завдяки таким процесам відбувається міграція біогенних елементів з донних відкладень у фотичний шар води (шар води, в якому достатня кількість світла для синтезу рослинами органічної речовини з використанням сонячної енергії) і, як наслідок, активізація продукційної діяльності фітопланктону, зростання біомаси як фіто-, так і зоопланктону. Фактор густини води відіграє дуже важливу роль у житті пелагічних організмів. Найбільші коливання густини води спостерігаються в місцях гідрофронтів в екотонних екосистемах, розташованих на межі змішування морських солоних і прісних вод, що надходять з річковим стоком.
На відміну від морських вод з однотипним сольовим складом, прісні води різних ландшафтних зон за складом головних іонів суттєво відрізняються.
Згідно з класифікацією О.О. Альокіна [27], природні води поділяють за сольовим складом на три класи: гідрокарбонатні (С), сульфатні (S) і хлоридні (СІ). Кожен клас за переважаючими макрокомпонентами розбивається на три групи: кальцієву, магнієву та натрієву, а кожна група, в свою чергу, за кількісним співвідношенням іонів поділяється на чотири типи (І, II, III, IV).
Води типу І утворюються або в процесі хімічного видужування вивержених порід, або при обмінних процесах Са2+ та Mg2+ на Na+. Ці води найчастіше маломінералізовані.
Води типу II — змішані. Склад їх може бути пов'язаним генетично як з осадовими породами, так і з продуктами вивітрювання вивержених порід. До цього типу належать води більшості річок, озер та підземні води малої та помірної мінералізації.
Води типу III включають деяку частину сильно мінералізованих вод або вод, що зазнали катіонного обміну Na+ на Са2+ або Mg2+. До цього типу належать води океанів, морів, лиманів, реліктових водойм та багато інших сильно мінералізованих вод.
До типу IV, для якого характерним є відсутність НСО3-, належать кислі води. Це води боліт, шахтні, вулканічні води або води, що сильно забруднені промисловими стоками.
Характеристики вод позначаються так: клас — хімічним символом відповідного аніону (С, S, СІ), група — символом катіону (Са, Na, Mg). Приналежність до типу позначається римською цифрою в нижньому індексі, до групи — символом у верхньому індексі. Наприклад, СIICa — гідрокарбонатний клас, група кальцію, тип II; CIIIMg — хлоридний клас, група магнію, тип III і т. д. Класифікація якості поверхневих вод суші та естуаріїв за критеріями іонного складу наведена таблиці 2.1.
Таблиця 2.1
Класифікація якості поверхневих вод суші та естуаріїв за критеріями іонного складу
| Класи | Гідрокарбонатні (С) води | Сульфатні (S) води | Хлоридні (СІ) води | ||||||
| Група | Са | Mg | Na | Са | Мg | Na | Са | Mg | Na |
| Тип | І II III | І II III | І II III | II III IV | II III IV | І II III | II III IV | II III IV | І II III |
Загальна характеристика поверхневих вод суші за сольовим складом здійснюється на підставі таких основних показників, як загальна мінералізація, співвідношення іонів та вміст хлоридів і сульфатів.
На більшій частині Європейського континенту води річок мають невелику або середню мінералізацією і належать переважно до гідрокарбонатного класу, кальцієвої групи. Для степових і напівпустельних зон більш характерною є підвищена мінералізація вод сульфатного класу. В Європі такі річки займають лише 3 - 4 % площ усіх річкових басейнів. Ще менше річкових басейнів, води яких відносять до хлоридного класу натрієвої групи. Як правило, такі води характеризуються високою мінералізацією.
На території України річкові води належать переважно до карбонатного класу. Основними іонами сольового складу води Дніпра та його водосховищ є гідрокарбонати та Са2+, тобто вода належить до гідрокарбонатного класу групи кальцію другого типу (СIICa).
Мінералізація і вміст окремих іонів у воді певного водного об'єкта залежить від сезону року. У пік весняної повені мінералізація води в річках знижується внаслідок надходження снігових вод. Після закінчення весняної повені вміст солей знову підвищується. Особливо таке зростання солоності води стає відчутним у літню межень та взимку, коли в річці збільшується роль живлення ґрунтовими водами.
Формування сольового складу зарегульованих річкових систем визначається не тільки складом води, яка надходить із водозбірної площі, а й характером внутрішньоводоймних процесів. При багаторічному регулюванні стоку мінералізація води може підвищуватись лише до певного рівня, тобто до встановлення сольової рівноваги. Сезонні коливання мінералізації та іонного складу води великих водосховищ обумовлюються, головним чином, притоком річкових вод, а при каскадному їх розташуванні — надходженням води з вищерозташованих водосховищ та незарегульованих ділянок річки.
Для невеликих водосховищ у формуванні іонного складу води важливу роль відіграє також змив розчинених солей із прибережних схилів, надходження ґрунтових вод та атмосферних опадів, випаровування, відбирання води на господарські потреби.
Похожие работы
... та нітратний азот, аміаковий азот, хлориди, залізо загальне, важкі метали (Сu, Мn, А1, Сг, Ni). Згідно з матеріалами досліджень на якісний склад дренажних вод негативно впливає ряд чинників: антропогенні (літні табори для випасу худоби, несанкціоновані сміттєзвалища, залишки складів мінеральних добрив га пестицидів), природні (нітрифікація, амоштизація, мінералізація донних відкладень), а також ...
... . В умовах різкого зниження обсягів застосування добрив дуже важливо використовувати їх найбільш ефективно. Розділ 4. Основні напрямки іноваційно-екологічної конверсії промислових і аграрних підприємств 4.1 Конверсія промислових підприємств Розвиток екологічної кризи поставив складні задачі перед промисловим виробництвом. Виникла необхідність наукового аналізу взаємодії промислового ...

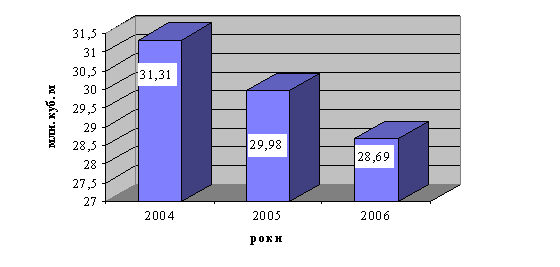
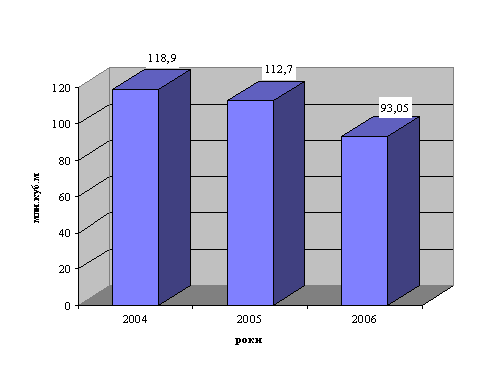
0 комментариев