Навигация
ХТ (холерный токсин) приводит к постоянной активации аденилатциклазы (подавляя ГТФ-азную активность Аs-субъединицы)
1. ХТ (холерный токсин) приводит к постоянной активации аденилатциклазы (подавляя ГТФ-азную активность Аs-субъединицы)
2. КТ (коклюшный токсин) тоже вызывает АDР-рибозилирование α-субъединицы. Однако в этом случае модификация G-белка препятствует его взаимодействию с рецепторами, поэтому при активации рецептора А не ингибируется.
По чувствительности к холерному и коклюшному токсинам G-белки можно разбить на четыре группы: чувствительные только к холерному токсину (Gs), только к коклюшному (Gi и Go), субстраты обеих токсинов (Gt) и G-белки, α-субъединицы которых не чувствительны ни к одному из токсинов.
Сопряжение с эффекторными системамиГТФ-связываюшие белки управляют несколькими мембранными ферментами и рядом ионных каналов.
Вероятно с G-белками взаимодействует цитоскелет, благодаря чему гормоны регулируют секрецию и эндоцитоз. Из мембранных и внутриклеточных мишеней G-белков лучше всего изучены аденилатциклаза и фосфодиэстераза ГМФ сетчатки глаза, активируемые, соответственно, Gzx и трансдуцином. Эти два фермента принципиально отличаются друг от друга по структуре и механизму их регуляции G-белками.
В отношении активации других G-белок зависимых систем ясности нет. G - белки опосредуют не только активирующее, но и ингибирующее действие агонистов на внутриклеточные эффекторные системы. G-белок зависимое ингибирование показано для аденилатциклазы, потенциалправляемых кальциевых каналов, фосфолипазы С, Nа/К-АТФазы.
Исходя из данных, можно предположить, что существует два механизма G-белок зависимого ингибирования аденилатциклазы. Один из них обусловлен действием βγ-субъединиц и, видимо, одинаков для всех G-белков, т.к βγ-субъединицы у них сходные. Второй механизм заключается в специфическом ингибировании аденилатциклазы α-субъединицей белка Gi.
Регуляция активности G-белковРазличают неактивную форму G-белка - комплекс αβγ-ГДФ и активированную форму αβγ-ГТФ. Активация G-белка происходит при взаимодействии с комплексом активатор-рецептор, изменение конформации G-белка снижает сродство α-субъединицы к молекуле ГДФ и увеличивает к ГТФ.
Замена ГДФ на ГТФ в активном центре G-белка нарушает комплементарность между α-ГТФ и βγ-субъединицами. Рецептор, связанный с сигнальной молекулой, может активировать большое количество молекул G-белка, таким образом обеспечивая усиление внеклеточного сигнала на этом этапе.
Активированная α-субъединица G-белка (α-ГТФ) взаимодействует со специфическим белком клеточной мембраны и изменяет его активность. Такими белками могут быть ферменты аденилатциклаза, фосфолипаза С, фосфодиэстераза цГМФ, Nа+-каналы, K+-каналы.
Следующий этап цикла функционирования G-белка - дефосфорилирование ГТФ, связанного с α-субъединицей, причём фермент, катализирующий эту реакцию, - сама α-субъединица.
Дефосфорилирование приводит к образованию комплекса α-ГДФ, который не комплиментарен специфическому белку мембраны (например аденилатциклазе), но имеет высокое сродство к βγ-протомерам. G-белок возвращается к неактивной форме - αβγ-ГДФ. При последующей активации рецептора и замене молекулы ГДФ на ГТФ цикл повторяется снова. Таким образом, αβγ-субъединицы G-белков совершают челночное движение, перенося стимулирующий или ингибирующий сигнал от рецептора, который активирован первичным посредником (например, гормоном), на фермент, катализирующий образование вторичного посредника.
Некоторые формы протеинкиназ могут фосфорилировать α-субъединицы G - белков. Фосфорилированная α-субъединица не комплиментарна специфическому белку мембраны, например аденилатциклазе или фосфолипазе С, поэтому не может участвовать в передаче сигнала.
АденилатциклазаФермент аденилатциклаза, катализирующий превращение АТФ в цАМФ - ключевой фермент аденилатциклазной системы передачи сигнала. Аденилатциклаза обнаружена во всех типах клеток.
Фермент относят к группе интегральных белков клеточной мембраны, он имеет 12 трансмембранных доменов. Внеклеточные фрагменты аденилатциклазы гликозилированы. Цитоплазматические домены аденилатциклазы имеют два каталитических центра, ответственных за образование цАМФ - вторичного посредника, участвующего в регуляции активности фермента протеинкиназы А.
На активность аденилатциклазы оказывают влияние как внеклеточные, так и внутриклеточные регуляторы. Внеклеточные регуляторы (гормоны, эйкозаноиды, биогенные амины) осуществляют регуляцию через специфические рецепторы, которые с помощью α-субъединиц G-белков передают сигналы на аденилатциклазу. αs-субъединица (стимулирующая) при взаимодействии с аденилатциклазой активирует фермент, αi-субъединица (ингибирующая) ингибирует фермент. В свою очередь, аденилатциклаза стимулирует проявление ГТФ-фосфатазной активности α-субъединиц. В результате дефосфорилирования ГТФ образуются субъединицы αs-ГДФ и αi-ГДФ, некомплементарные аденилатциклазе.
Из 8 изученных изоформ аденилатциклазы 4 - Са2+-зависимые (активируются Са2+). Регуляция аденилатциклазы внутриклеточным кальцием позволяет клетке интегрировать активность двух основных вторичных посредников цАМФ и Са2+.
ФосфолипазыФосфолипазы - ферменты класса гидролаз, катализирующие катаболизм глицерофосфолипидов. Различают фосфолипазы секреторные, входящие в состав панкреатического сока, и клеточные фосфолипазы. Клеточные фосфолипазы А1, А2, D, С различаются по специфичности к отщепляемой группе. Все фосфолипазы - кальций зависимые ферменты.
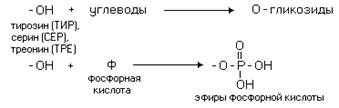
Фосфолипаза С - фермент, гидролизующий фосфоэфирную связь в глицерофосфолипидах. В клетках человека идентифицировано 10 изоформ фосфолилазы С, различающихся по молекулярной массе, локализации, способу регуляции, субстратной специфичности. В структуре всех изоформ фосфолипазы С отсутствуют гидрофобные домены, которые могли бы обеспечить их взаимодействие с мембраной. Однако некоторые формы фосфолипазы С связаны с мембраной с помощью гидрофобного "якоря" - ацильного остатка миристиновой кислоты или за счёт взаимодействия с поверхностью бислоя. Каталитическая активность всех изоформ фосфолипазы С зависит от ионов кальция.
Большинство фосфолипаз С специфично в отношении фосфатидилинозитолов и практически не гидролизует другие типы фосфолипидов. Активный фермент может гидролизовать до 50% от общего количества фосфатидилинозитолов клеточной мембраны. При гидролизе фосфатидилинозитол-4,5-бисфосфата (ФИФ2) образуются гидродугты диацилглицерол (ДАГ) и инозитол-1,4,5-трифосфат (ИФ3), служащие вторичными посредниками в трансмембранной передаче сигнала по инозитолфосфатному пути.
ПротеинкиназыВсе полярные сигнальные молекулы, действующие на клетку-мишень через мембранные рецепторы, осуществляют свою биологическую функцию путём фосфорилирования специфических белков и ферментов, регулирующих метаболизм в клетке. Фосфорилирование изменяет (увеличивает или уменьшает) их активность. Катализируют фосфорилирование белков (протеинов) протеинкиназы по аминокислотным остаткам серина, треонина, тирозина. Протеинкиназы могут быть субъединицей мембранного рецептора, например тирозиновая протеинкиназа рецептора инсулина, активность которой регулируется гормоном. другая группа - протеинкиназы, регулируемые вторичными вестниками гормонального сигнала (цАМФ, цГМФ, Са, ДАГ), например протеинкиназа А, протеинкиназа С, протеинкиназа G, кальмодулинзависимые протеинкиназы и др.
Похожие работы
... , вызывает уменьшение количества синтезируемых ферментов. Это последнее явление получило название репрессии синтеза ферментов. Оба явления — индукция и репрессия — взаимосвязаны. Согласно теории Жакоба и Моно в биосинтезе белка у бактерий участвуют по крайней мере три типа генов: структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру синтезируемого белка. ...
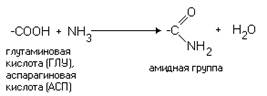
... белка - в различных сортах мяса и птицы содержится от 14 до 24% белка. Взаимозаменяемость первой и второй группы. Продукты двух первых групп являются наиболее важными поставщиками полноценного белка, с близкими по их аминокислотному составу и хорошей усвояемости организмом. Продукты первой и второй группы как источники белка в значительной степени могут заменять друг друга. Это означает, что их ...
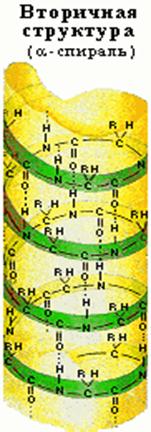
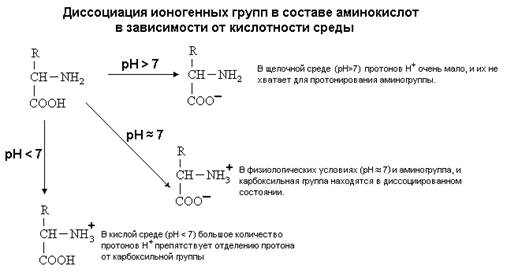
... + щелочная ср. NH2 R R R COOH COO – COO – Катион Амфион Анион Таким образом, фактором, определяющим поведение белка как катиона или аниона, является реакция среды, которая определяется концентрацией водородных ионов и выражается величиной рН. Однако ...
... равен 1/16 массы атома кислорода (кислородная единица массы). КОНФИГУРАЦИЯ И КОНФОРМАЦИЯ БЕЛКОВОЙ МОЛЕКУЛЫ Из всего сказанного можно заключить, что пространственная организация белков очень сложна. В химии существует понятие - пространственная КОНФИГУРАЦИЯ - жестко закрепленное ковалентными связями пространственное взаимное расположение частей молекулы (например: принадлежность к L-ряду ...
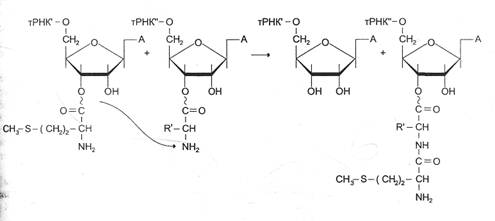
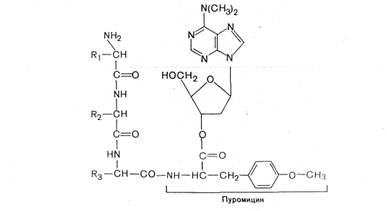
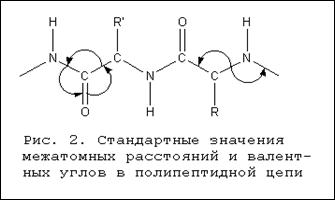
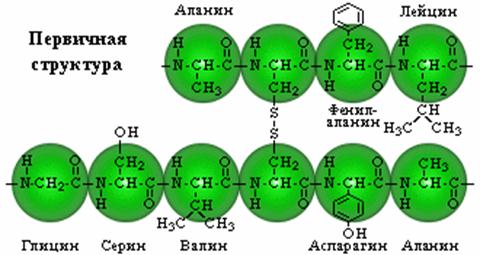


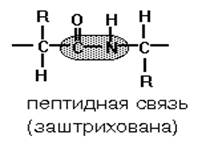
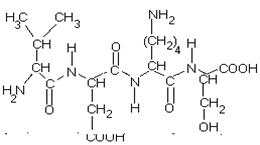
0 комментариев