Навигация
Процеси перегонки через газову фазу
2.4 Процеси перегонки через газову фазу
Процеси перегонки через газову фазу лежать в основі очищення простих речовин (елементів) і хімічних сполук, що володіють високою пружністю пари, наприклад, фосфору, сюрми, сірки, магнію, кальцію, цинку, рідких хлоридів елементів (наприклад, GeCl![]() , TiCl
, TiCl![]() , SiCl
, SiCl![]() ) проміжних продуктів у виробництві напівпровідникових і діелектричних матеріалів у формі летких з'єднань (нижчих галогенідів) і так далі.
) проміжних продуктів у виробництві напівпровідникових і діелектричних матеріалів у формі летких з'єднань (нижчих галогенідів) і так далі.
Розділення і очищення речовин сублімацією і дистиляцією. Сублімація (сублімація) є процесом безпосереднього переходу речовини з твердого стану в газоподібний. Сублімація як метод розділення і очищення можлива для тих речовин, які, будучи нагріті до температури нижче за точку плавлення характеризуються досить високим тиском пари. За наявності в речовині набору домішок більш леткі в порівнянні з основною речовиною домішки можуть бути відігнані при низькій температурі, а домішки менш леткі зосереджені в залишку після сублімації основного компоненту.
Дистиляція є процесом розділення рідкого розчину на його складові частини, що характеризуються відмінністю в тиску пари, шляхом їх випару і подальшій конденсації пари, що утворилася.
Розглянемо основи розділення і очищення речовин випаровуванням і конденсацією на прикладі подвійної системи, що складається з компонентів А і В, створюючих безперервний ряд твердих і рідких розчинів.
Якщо компоненти А і В дуже близькі між собою по складу, величині, будові молекул, а отже, і по властивостях і крім того, не утворюють між собою з'єднань і не асоційовані, то парціальний тиск насиченої пари кожного компоненту над розчином при постійній температурі буде пропорційний молярній долі його в розчині, тобто
![]()
![]()
де Р![]() і Р
і Р![]() - парціальний тиск пари компонентів А і В над розчином,
- парціальний тиск пари компонентів А і В над розчином,![]() і
і ![]() - їх молярні долі в розчині;
- їх молярні долі в розчині; ![]() і
і ![]() - тиск пари чистих компонентів А і В. Загальний тиск пари
- тиск пари чистих компонентів А і В. Загальний тиск пари ![]() , рівноважного з розчином, буде
, рівноважного з розчином, буде
![]()
![]()
так як ![]() =1-
=1-![]() , то
, то
![]() =
=![]() +
+![]() (
(![]() -
-![]() )
)
Приведені співвідношення є лінійними функціями щодо молярних доль, і їм відповідають прямі лінії на діаграмі, що виражає залежність спільного і парціального тиску пари від складу при постійній температурі (мал.5, а). Останнє рівняння відображає закон Рауля сформульований для ідеальних систем: відносне пониження тиску насиченої пари розчинника А чисельно дорівнює молярній долі розчиненої в ньому речовини В, і навпаки.
Ідеальні розчини в практиці спостерігаються відносно рідко, і їх створення не супроводиться тепловим ефектом або зміною об'єму. Для реальних розчинів спостерігається відхилення від лінійної залежності між тиском пари розчину і його складом (мал.5, б, в).
Розрізняють розчини з позитивними і негативними відхиленнями від закону Рауля. При позитивних відхиленнях тиск пари обох компонентів над розчинами і їх сума насправді більше, ніж це витікає із закону Рауля (мал.5, б, пунктирні лінії). Такі розчини, як правило утворюються з поглинанням теплоти і збільшенням об'єму, що термодинамічно і обумовлює таке відхилення. При негативних відхиленнях від закону Рауля дійсний тиск пари менше обчислених за законом Рауля (мал.5, в), і утворення таких розчинів, як правило супроводжується виділенням теплоти і зменшенням об'єму.
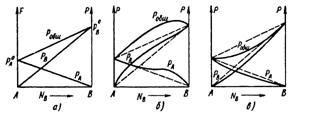
Мал.5. Графіки залежностей спільного і парціального тиску пари від складу в двокомпонентних системах: а — ідеальна система; б — система з позитивним відхиленням від закону Рауля; в — система з негативним відхиленням від закону Рауля (температура постійна)
Розглянемо залежність між складом пари над розчином і складом самого розчину. У загальному випадку відносний вміст компонентів розчину в парах відрізнятиметься від їх відносного вмісту в розчині. Лише у ідеальній системі компоненти якої володіють однаковим тиском пари в чистому стані, співвідношення компонентів в парі над розчином і в розчині рівні. У всіх інших ідеальних системах в газовій фазі в порівнянні з розчином завжди переважає той з компонентів, який має більший тиск пари в чистому вигляді. На мал.6. пунктиром показано сімейство типових кривих, що виражають залежність складу пари від складу розчину при постійній температурі в різних ідеальних системах в тому випадку, якщо більш летким є компонент В. Лінійна залежність (діагональ квадрата) відповідає випадку коли склади пари і розчину рівні між собою. Відхилення від лінійної залежності тим більше, чим більше різниця в тиску пари компонентів розчину в чистому стані.
Складність закону Рауля, залежність складу пари від складу розчину виражається складнішими кривими. Деякі типові з них показані на мал. суцільними лініями. Позитивні відхилення від закону Рауля обумовлюють утворення угнутості у верхній частині кривих, а негативні — у нижній частині. При значних відхиленнях в системі від закону Рауля відхилення кривих від ідеальних можуть бути настільки великі що нерідко спостерігаються перетини кривих з діагоналлю квадрата.
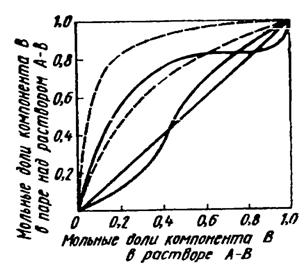
Мал.6. Графіки залежностей складу пари від складу розчину в різних системах
Залежність складу пари від складу розчину і спільного тиску в системі характеризується законами, відкритими Д. П. Коноваловим. Основний зміст цих законів можна проілюструвати, на діаграмах стану в координатах температура кипіння склад розчину і тиск пари склад розчину.
На мал.7. приведено три типові діаграми стану. На кожній з них прийнято будувати дві криві, одна з яких зв'язує параметри стану з складом пари, а інша з складом рідкої фази. Характерно, що на діаграмах температура кипіння склад розчину нижня крива відноситься до складів рідини а верхня до складів пари. На діаграмах же тиск пари склад розчину розташування кривих зворотне. Системи, що володіють мінімумом кривих температур кипіння, характеризуються максимумом на кривих тиску пари, і навпаки.
Другий закон Коновалова. Точки максимума або мінімума на діаграмах стану склад – тиск пари і склад – температура кипіння відповідають розчинам, склад яких одинаків з складом рівноважної їм пари.
Розчини, що відповідають цим точкам, називаються азеотропними. Системи з азеотропами в результаті дистиляції розділяються на один із двох чистих компонентів і відповідний азеотроп. Азеотроп не розкладається на компоненти при випаровуванні і тому для цього використовують екстракцію, кристалізацію або інші методи.
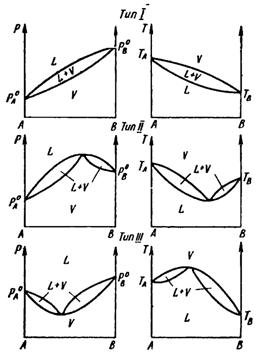
Мал.7. Діаграми стану склад – тиск пари Р і склад – температура кипіння Т для різних типів систем рідина L — пара V
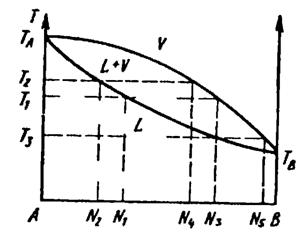
Мал.8. Схематичне зображення змін в складах розчину і пари при дистиляції
Системи, що описуються різними типами фазових діаграм, неоднаково поводяться при дистиляції.
Розглянемо спочатку просту систему, що відноситься до першого з трьох типів (мал.8.). Буквою В позначатимемо компонент, що має нижчу температуру кипіння.
Перший закон Коновалова. Якщо нагріти розчин складу ![]() мал. до температури кипіння
мал. до температури кипіння ![]() , то пара, рівноважна з цим розчином, має склад
, то пара, рівноважна з цим розчином, має склад ![]() , що збагачений компонентом В.
, що збагачений компонентом В.
Після випаровування певної кількості розчину залишок збагачується компонентом А і має склад, наприклад ![]() . Розчин цього складу закипить, якщо температура його підніметься до
. Розчин цього складу закипить, якщо температура його підніметься до ![]() . Пара, що знаходиться в рівновазі з цим розчином, має склад, що теж збагачений компонентом В в порівнянні з цим розчином. По мірі випаровування залишок розчину збагачується компонентом А, і температура кипіння відповідно підвищується. Врешті-решт в результаті випаровування в залишку міститиметься практично чистий компонент А і температура кипіння досягне
. Пара, що знаходиться в рівновазі з цим розчином, має склад, що теж збагачений компонентом В в порівнянні з цим розчином. По мірі випаровування залишок розчину збагачується компонентом А, і температура кипіння відповідно підвищується. Врешті-решт в результаті випаровування в залишку міститиметься практично чистий компонент А і температура кипіння досягне ![]() .
.
Якщо пару, що виділилася при ![]() складу
складу ![]() , сконденсувати і одержаний конденсат знову піддати дистиляції, то він буде кипіти при температурі
, сконденсувати і одержаний конденсат знову піддати дистиляції, то він буде кипіти при температурі ![]() і пара буде мати склад
і пара буде мати склад ![]() , тобто ще збагатиться компонентою В.
, тобто ще збагатиться компонентою В.
Повторюючи такий процес конденсації і дистиляції, можна врешті-решт досягти того, що пара, що виділяється, буде практично чистим компонентом В. Таким чином, проведений розгляд показує що в системах цього типу будь-яку подвійну суміш можна розділити шляхом дистиляції на чисті компоненти.
У системах же другого або третього типів розділення розчинів на чисті компоненти таким шляхом неможливе. Дійсно, провівши аналогічний розгляд процесу дистиляції системи що належить до другого або третього типу, можна показати, що ці системи розділяються на один з чотирьох чистих компонентів і відповідний азеотроп.
Азеотропні розчини зустрічаються в багатьох практично важливих системах: хлористий водень - вода, азотна кислота - вода, етиловий спирт - вода сірковуглець - ацетон і ін.
Для кількісної характеристики процесів розділення при дистиляції користуються коефіцієнтом розподілу
![]() ,
,
Де ![]() і N – мольні долі компонентів в парі і розчині відповідно.
і N – мольні долі компонентів в парі і розчині відповідно.
Для двохкомпонентної системи
![]() ;
; ![]()
Оцінку ефективності перерозподілу основного компонента і домішки між паровою і рідкою фазами проводять також за допомогою коефіцієнта розділення
 .
.
Для ідеальних розчинів коефіцієнт розділення не залежить від складу і може бути представлений як ![]() – коефіцієнт відносної летючості. В випадку реальних розчинів коефіцієнт розділення (відносної летючості) має вигляд
– коефіцієнт відносної летючості. В випадку реальних розчинів коефіцієнт розділення (відносної летючості) має вигляд
![]()
![]() ,
,
Де ![]() і
і ![]() – коефіцієнти активності компонент А і В і визначаються із співвідношення
– коефіцієнти активності компонент А і В і визначаються із співвідношення ![]() .
.
Похожие работы
... у змішувач. Отримане поживне середовище передають на стерилізацію та охолодження. Культивування продуцентів (Leuconostoc mesenteroides PCSIR-4) здійснюють до утворення полісахариду необхідної в’язкості (18 год) [8, 28]. Крім етапів синтезу продукту і їх очистки, технологія виробництва декстрану містить етап фракціонування. Фракціонування декстранів на виробництві проводять з використанням спирт ...
... іля за добу (з 9,7 годин у 1990 р. до 7,7 год. у 1993 р). Протягом 1994 р. негативні процеси, що намітилися в автотранспорті області, ще більше посилилися. Розділ 2. Динаміка простору системи міста 2.1 Оцінка розвитку міста у просторі Планувальна структура міста - це взаємне розташування основних функціональних зон і системи зв'язків між ними. По суті, це основа міста, яка визначає ...
... вартістю абсорбентів. Загальними недоліками методів абсорбції є утворення рідинних стоків і громіздкість апаратурного оформлення. [8]. 3.2 Адсорбційний метод Адсорбційний метод є одним з найпоширеніших засобів захисту повітряного басейну від забруднень. Основними промисловими адсорбентами є активоване вугілля, складні оксиди і імпрегновані сорбенти. Активоване вугілля (АВ) нейтральне по ві ...
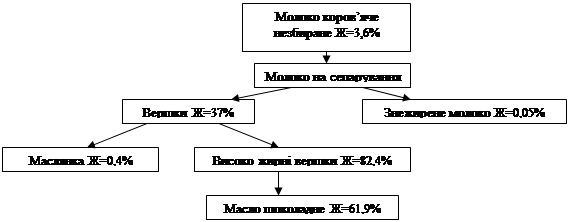
... год при температурі (40-45°С). Сепарування молока починають після поступання його в кількості, забезпечуючій безперервну роботу сепаратора протягом 20-30 хв. При виробництві масла шоколадного методом перетворення високожирних вершків масова частка жиру у вершках складає 37%. При сепаруванні молока суворо дотримуються правил експлуатації сепараторів. Після сепарування вершки та молоко знежирене ...
0 комментариев