Навигация
Экспериментальные исследования процесса горения и газификации угольной частицы
1.4. Экспериментальные исследования процесса горения и газификации угольной частицы.
Рассмотрим основные результаты экспериментальных исследований процесса горения и газификации угольной частицы;
Первые опыты по исследованию горения угольной частицы в потоке воздуха методом непрерывного взвешивания были проведены советским ученым В. И. Блиновым и американским исследователем Г.К. Хоттелем и сотрудниками.
Г. К. Хоттель и сотрудники проводили опыты с угольным шаром диаметром 2,5 см, подвешенным к чувствительным весам. Скорость горения замеряли при условии небольшого изменения диаметра частиц при различных температурах, 'концентрациях кислорода и расходах дутья. Анализ опытов был сделан с учётом скорости химической реакции.
В опытах В. И. Блинова было исследовано горение сферических частиц диаметром 5 мм при различном содержании кислорода (от 21% и выше) и разнььх скоростях потока (от 1,9 до 27,4 см/сек), при температурах 700-800°. Скорости горения частиц измеряли с помощью чувствительных весов оптическим отсчетом. Температуру поверхности частицы измеряли посредством оптического пирометра. В момент воспламенения наблюдалось возникновение голубого пламени СО, которое в дальнейшем принимало характер ореола вокруг частицы, что указывало на содержание СО в продуктах сгорания.
Анализ опытов В. И. Блиновым также был сделан с учетом скорости химической реакции. В дальнейшей работе В. И. Блинов и С. Э. Хайкина исследовали горение угольной частицы при изменении давления воздуха в пределах от 1 до 7 ата, причем было выявлено, что скорость горения зависит только от весовой скорости потока воздуха, т. е. от произведения %. В исследовании В.И.Блинова, Е. С. Головиной и С. Э. Хайкиной изучался процесс горения угольной частицы при низких температурах.

На рис. 1.4 показан график, иллюстрирующий результаты опытов. Из него видно, что удельная скорость горения сначала с увеличением диаметра частицы возрастает, а затем уменьшается. Максимум кривой объясняется переходом реакции ( по мере увеличения размера частицы) из внутреннего кинетического во внешний кинетический режим и наконец в диффузионный режим.
Теоретический анализ влияния летучих на скорость вьгорания частицы в связи с изменением давления, сделанный Б. В. Канторовичем, В. В. Есиным и Н. Н. Шигаевьш, показывает, что в связи с совместным горением летучих и коксовой частицы торможение скорости ее горения проявляется только на известном участке, величина которого зависит от ряда факторов: выхода летучих, температуры, скорости потока и др.
В. В. Есиным и Н. Н. Шигаевьш при участии автора сделан эксперимент, из которого выяснено влияние летучих на скорость выгорания измельченных топлив. Опыпы проводились с торфяной пылью с различным выходом летучих (от 13 до 64%). Пыль сжигали в бомбе при изменении давления от 2,68 до 15 ата. Время выгорания определяли .по индикаторной диаграмме с помощью пьезокварцевого датчика и осциллографа. Экспериментальные кривые зависимости времени τ горения частиц от давления p, соответствуют теоретической зависимости.
Представляют интерес экспериментальные исследования процесса горения отдельной угольной частицы, движущейся в потоке газа. Такого рода опыты проводили Н. И. Сыромятников и 3.И.Леонтьева. После воспламенения частицы наблюдалось замедление скорости ее движения. Это явление объясняется неравномерным выгоранием частицы, причем наибольшее выгорание получается со стороны, обращенной к потоку воздуха. При этом образующиеся продукты сгорания движутся навстречу кислороду, диффундирующему к поверхности частицы, и создают обратный (так называемый стефановский) поток, в результате чего получается сила реакции, величина которой определяется из известной теоремы: импульс силы равен изменению количества движения. Эта сила может быть равна нулю только при двух обстоятельствах: симметричном выгорании частицы и образовании .только одного окисла ОС2.
В последнем случае скорость результирующего потока равна нулю, поскольку изменение числа молекул при образовании двуокиси углерода равно нулю.
При симметричном выгорании частицы, что можно предполагать например в случае движения мелких пылинок в потоке воздуха, реактивная сила также отсутствует, поскольку в этом случае результирующая скорость газифицируемых молекул равна нулю или пренебрежимо мала по сравнению со скоростью самой частицы.
3. И. Леонтьевой были сфотографированы падающие горящие угольные частицы во встречном потоке воздуха. Движение горящей угольной частицы в силу изменения ее массы и выделения газообразных продуктов реакции уже не определяется обычным уравнением движения. В этом случае следует применять уравнение движущегося тела переменной массы, выведенное русским ученым И.В. Мещерским. В. М. Третьяковым проводились исследования процесса воспламенения угольной пыли из подмосковного, тощего угля и антрацита, а также из кокса подмосковного и тощего угля из частиц размером от 75 до 105 μ. Скорость воздуха в камере при нормальных условиях составляла 86 см/сек, температура стенок камеры— от 500 до 1100°. Время пребывания частиц определялось по скорости газа в камере при данной отрегулированной температуре стенок.
2. Теоретические исследования кинетики химических реакций и массообмена пористых углеродных частиц с газами с учетом эндотермической реакции и стефановского течения.
2.1. Кинетика параллельных и последовательных реакций углеродной частицы с газами.
Тепломассообмен (ТМО) твердого или жидкого тела с газами протекает взаимосвязанно с химическими реакциями и фазовыми превращениями (испарение, конденсация), которые являются источниками (стоками) энергии и новых масс газов (продуктов реакции). Появление или исчезновение газовых масс на поверхности твердого тела является причиной появления стефановского течения, направленного в первом случае от поверхности тела, а во втором к поверхности, дополнительно учавствующего в переносе тепла и газообразных компонент [1 - 4]. В целом ряде случаев необходимо учитывать пористую структуру твердого тела и, следовательно, внутреннюю диффузию и кинетику химических реакций на поверхностях пор. Так же необходимо учитывать, что при определенных условиях возможно протекание гомогенных химических реакций в пространстве около частицы. Наилучшим примером является реагирование углерода (графит, электродный уголь, коксы различных топлив) с газами. Известно [1, 5], что на поверхности углерода протекают параллельно экзотермические химические реакции
С+О2 =СО2+![]() (І), 2С+О2=2СО+
(І), 2С+О2=2СО+![]() (ІІ),
(ІІ),
а так же последовательная эндотермическая химическая реакция
С+СО2=2СО-![]() (ІІІ),
(ІІІ),
где ![]() ,
, ![]() ,
, ![]() - тепловые эффекты химических реакций (І), (ІІ), (ІІІ), Дж/моль.
- тепловые эффекты химических реакций (І), (ІІ), (ІІІ), Дж/моль.
В газовой фазе возможно протекание экзотермической гомогенной химической реакции
2СО+О2=2СО+![]() (ІV),
(ІV),
где ![]() - тепловой эффект химической реакции (ІV), Дж/моль.
- тепловой эффект химической реакции (ІV), Дж/моль.
Если скорость гомогенной реакции (ІV) меньше скорости массопереноса (критерий Дамкелера (Damkohier) или критерий Семенова) ![]() < 0.4, то ее влиянием на тепломассообмен твердого тела можно пренебречь [1]
< 0.4, то ее влиянием на тепломассообмен твердого тела можно пренебречь [1]
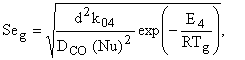
где d – диаметр углеродной частицы, м; ![]() - предэкспоненциальный множитель, 1/с;
- предэкспоненциальный множитель, 1/с; ![]() - энергия активации реакции (ІV), Дж/моль;
- энергия активации реакции (ІV), Дж/моль; ![]() - температура газовой смеси, К;
- температура газовой смеси, К; ![]() - коэффициент диффузии окиси углерода, м2/с; Nu – критерий Нуссельта. Малое значение критерия Семенова определяется экспериментальными условиями, когда частица дополнительно разогревается током высокой частоты или в результате поглощения лазерного излучения и обдувается холодным газом [5-7]. Так в [5] частица электродного угля d=1.2 – 1.5 см, нагреваемая током высокой частоты, обдувалась воздухом комнатной температуры (Тg=293 К) со скоростью V=0.6 м/с. В [6-7] приведены экспериментальные и теоретические результаты временных зависимостей температуры и диаметра углеродной частицы, горение которой в воздухе комнатной температуры поддерживается лазерным излучением.
- коэффициент диффузии окиси углерода, м2/с; Nu – критерий Нуссельта. Малое значение критерия Семенова определяется экспериментальными условиями, когда частица дополнительно разогревается током высокой частоты или в результате поглощения лазерного излучения и обдувается холодным газом [5-7]. Так в [5] частица электродного угля d=1.2 – 1.5 см, нагреваемая током высокой частоты, обдувалась воздухом комнатной температуры (Тg=293 К) со скоростью V=0.6 м/с. В [6-7] приведены экспериментальные и теоретические результаты временных зависимостей температуры и диаметра углеродной частицы, горение которой в воздухе комнатной температуры поддерживается лазерным излучением.
Проведенный анализ тепломассообмена и кинетики химических реакций (І), (ІІ), (ІІІ) углеродной частицы с газами показал на необходимость учета стефановского течения и позволил получить аналитические выражения качественно верно описывающие влияние условий и свойств на газовый состав продуктов реакции, скорость химического превращения углерода, плотности тепловых и массовых потоков на поверхности частицы [3]. Однако, пренебрежение внутренним реагированием привело к несовпадению экспериментальных и расчетных результатов по скорости химического превращения углеродной частицы при различных ее температурах и диаметрах.
Задачей настоящей работы является выявление роли внутреннего реагирования и стефановского течения в процессах ТМО и химических реакций пористой углеродной частицы с газами с учетом вынужденной и естественной конвекции в зависимости от температуры и диаметра частицы.
Скорость химического превращения углерода в газообразные компоненты определяется скоростью химической реакции на внешней поверхности частицы и внутри частицы на поверхностях пор
![]() ,
,
где ![]() - соответственно, суммарная скорость химического превращения, скорость химического превращения
на поверхности углеродной частицы и внутри, на поверхностях пор, кг/(м2 с).
- соответственно, суммарная скорость химического превращения, скорость химического превращения
на поверхности углеродной частицы и внутри, на поверхностях пор, кг/(м2 с).
Скорость химического превращения углерода на поверхности частицы определяется кинетикой реакций (I), (II) и (III)
 , (2.1)
, (2.1)
![]()
![]() ,
,
![]() ,
,
где ![]() – молярные массы углерода, кислорода, углекислого газа, кг/моль;
– молярные массы углерода, кислорода, углекислого газа, кг/моль; ![]() – относительные массовые концентрации O2 и CO2 на поверхности частицы;
– относительные массовые концентрации O2 и CO2 на поверхности частицы; ![]() ,
, ![]() ,
, ![]() – константы скоростей химических реакций (I), (II), (III), м/с;
– константы скоростей химических реакций (I), (II), (III), м/с; ![]() ,
, ![]() ,
, ![]() - предэкспоненциальные множители, м/с; E1, E2, Е3 – энергии активации (I), (II) и (III) реакций, Дж/моль; R – универсальная газовая постоянная, Дж/(моль×К); Т – температура частицы, К;
- предэкспоненциальные множители, м/с; E1, E2, Е3 – энергии активации (I), (II) и (III) реакций, Дж/моль; R – универсальная газовая постоянная, Дж/(моль×К); Т – температура частицы, К; ![]() ,
, ![]() - плотность газа при температуре частицы и при Т0=273.15 К, кг/м3.
- плотность газа при температуре частицы и при Т0=273.15 К, кг/м3.
Энергии активации и предэкспоненциальные множители реакций (I), (II) и (III) связаны между собой [1]:
![]() ;
; ![]() ,
,
где ![]() =1 для реакции (I), 2- для реакции (II) и 3- для реакции (III).
=1 для реакции (I), 2- для реакции (II) и 3- для реакции (III).
Выражение для скорости химического превращения углерода в результате химических реакций на поверхностях пор внутри объёма частицы получается из решения задачи внутренней диффузии и может быть представлено в виде
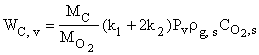 ,
, ![]() ,
(2)
,
(2)
![]() , (3)
, (3)
 ,
,  , (4)
, (4)
где ![]() -эффективная константа внутреннего реагирования, м/с; Sev - критерий Семенова, определяющий соотношение констант скоростей химических превращений на поверхностях пор и диффузии [8, 9] или отношение радиуса частицы к глубине реакционной зоны, Dv – коэффициент внутренней диффузии кислорода в порах, м2/с;
-эффективная константа внутреннего реагирования, м/с; Sev - критерий Семенова, определяющий соотношение констант скоростей химических превращений на поверхностях пор и диффузии [8, 9] или отношение радиуса частицы к глубине реакционной зоны, Dv – коэффициент внутренней диффузии кислорода в порах, м2/с; ![]() - глубина реакционной зоны внутреннего реагирования, м,
- глубина реакционной зоны внутреннего реагирования, м, ![]() – удельная поверхность пор, м-1.
– удельная поверхность пор, м-1.
Коэффициент внутренней диффузии выражается через порозность частицы [1, 5]
 , (5)
, (5)
где ![]() - коэффициент диффузии кислорода в воздухе при температуре
- коэффициент диффузии кислорода в воздухе при температуре ![]() , м2/с;
, м2/с;
![]() - порозность частицы.
- порозность частицы.
Суммарная скорость химического превращения углеродной частицы и плотность химического тепловыделения
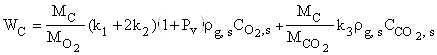 , (6)
, (6)
![]()
![]() , (7)
, (7)
где Q1, Q2 – тепловые эффекты химических реакций (I) и (II), рассчитанные на единицу массы кислорода, Дж/кг; Q3 – тепловой эффект реакции (III), рассчитанный на единицу массы углекислого газа, Дж/кг; ![]() - суммарная плотность химического тепловыделения, на поверхности и внутри частицы, соответственно, Вт/м2.
- суммарная плотность химического тепловыделения, на поверхности и внутри частицы, соответственно, Вт/м2.
Похожие работы
... ,Sб=pdL, из (2.14) определим временную зависимость толщины оксидной пленки на поверхности проводника: , . (2.15) Дифференциальные уравнения (2.13), (2.14) с учетом уравнений (2.9), (2.5)–(2.12) описывают нестационарный высокотемпературный тепломассообмен и кинетику окисления вольфрамового проводника, нагреваемого электрическим током в газообразной среде, ...
... или технологических процессов; – при выборе технического решения обеспечить малоотходность производства и максимальную эффективность использования энергоресурсов. Задачи специалиста в области безопасности жизнедеятельности сводятся к следующему; – контроль и поддержание допустимых условий (параметры микроклимата, освещение и др.) жизнедеятельности человека в техносфере; – идентификация ...
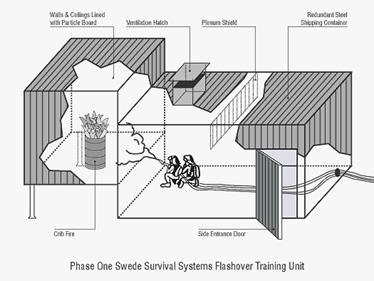
... тренировок, Шведы являются признанными мировыми экспертами в пожаротушении. Многие противопожарные службы мира сегодня используют Шведский метод подготовки. В последние 10 лет в Швеции появились огневые тренажеры для подготовки ствольщиков, работающие на газовом топливе (см. рисунок 4). Их недостатком является условный характер тренировки: оператор тренажера управляет интенсивностью подачи и ...
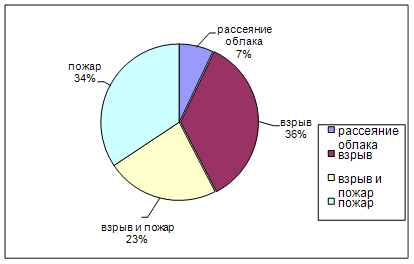
... готовность начинается с оповещения и сбора руководящего состава. 5.1 Оповещение и сбор руководящего состава при возникновении чрезвычайной ситуации на Туймазинском газоперерабатывающем заводе Место сбора и работы комиссии по предупреждению и ликвидации чрезвычайных ситуаций и обеспечению пожарной безопасности Туймазинского газоперерабатывающего завода (КЧС ПБ) - здание бытового помещения, ...


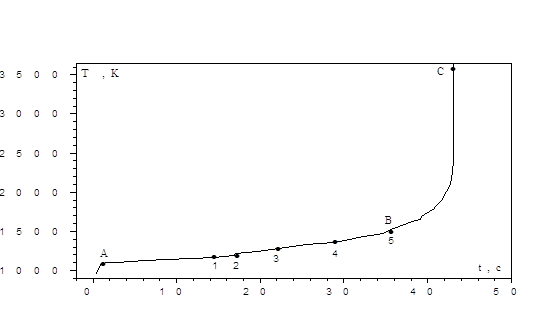
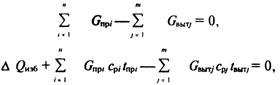




0 комментариев