Навигация
МИЕЛИН В ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЕ
7. МИЕЛИН В ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЕ
Мозг человека содержит 120 г миелина, что составляет одну треть его сухой массы. Миелин – уникальное образование, организация которого позволяет проводить импульс в аксоне с минимальной затратой энергии. Миелиновая оболочка – высокоорганизованная многослойная структура, состоящая из сильно растянутой и модифицированной плазматической мембраны олигодендроглиальной клетки.
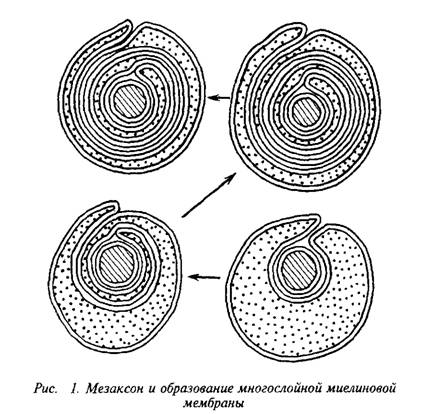
Плазматическая мембрана олигодендроцита образует вокруг аксона сложную мембранную структуру – мезаксон, который является элементарной единицей миелина, имеет пятислойную структуру: белок-липид-белок-липид-белок. Эта пя-тислойная структура, многократно закручиваясь вокруг аксона,
конденсируется в компактную миелиновую оболочку. На электронных микрофотографиях миелин представляет собой серию чередующихся липидных и белковых слоев, число таких слоев у крупных аксонов может достигать 250. Сплав цитоплазматиче-ских поверхностей мембраны олигодендроцита образует главный период, а сплав экстраклеточных поверхностей – половинный или промежуточный период, который часто виден в виде двойной линии. Это указывает на то, что взаимопроникновение белков экстраклеточных поверхностей мембран не было полным.
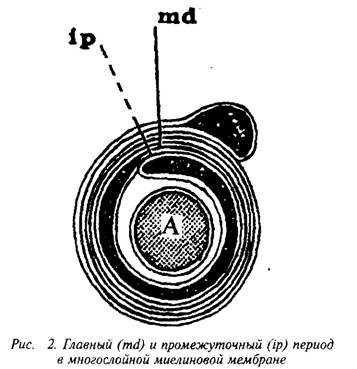
Повторяющийся период миелина определяется толщиной составляющего его липидного бислоя, «зажатого» двумя белковыми слоями, и равен 15–16 нм. Белки, частично пронизывающие бислой, занимают 5–10% площади; распределение его по поверхности бислоя неравномерно – есть области, не занятые белком. Полярные группы липидов образуют слой толщиной в 1 нм, а гидрофобная область занимает 3,3–3,8 нм.
Из всех существующих мембран миелин имеет самое низкое содержание воды и самое высокое отношение липидов к белку. В миелине белка – 15–30, липидов – 70–85 на сухую массу, из них холестерин составляет 25–28, общие галактолипи-ды – 27–30, а фосфолипиды – 41–45.

Состав миелина центральной нервной системы человека
| Компоненты | Миелин | Белое вещество | Серое вещество |
| Белок | 30 | 39 | 55,3 |
| Липиды | 70 | 54,9 | 32,7 |
| Холестерин | 27,7 | 27,5 | 22 |
| Цереброзиды | 22,7 | 19,8 | 5,4 |
| Сульфат иды | 3,8 | 5,4 | 1,7 |
| Общие галактолипиды | 27,5 | 26,4 | 7,3 |
| Общие фосфолипиды | 43,1 | 45,9 | 69,5 |
| Фосфатидилэтаноламин | 15,6 | 14,9 | 22,7 |
| Фосфатидилхолкн | 11,2 | 12,8 | 26,7 |
| Сфингомиелин | 7,9 | 7,7 | 6,9 |
| Фосфатидил серии | 4,8 | 7,9 | 8,7 |
| Фосфатидилинозитол | 0,6 | 0,9 | 2,7 |
| Плазмалогены | 12,3 | П, 2 | 8,8 |
Доказано, что полифосфоинозитиды локализованы преимущественно в миелине, предположительно в зоне главного периода, поэтому их можно считать маркерами миелина. На долю три- и дифосфоинозитидов приходится, соответственно, 3–6 и 1–1,5% общего липидного фосфора миелина. Они характеризуются высокой скоростью обмена фосфатных групп, что отражает их функции в миелине. В составе миелина содержатся алка-ны с 21–35 углеродными атомами и равным количеством четных и нечетных гомологов. Считают, что эти абсолютно гидрофобные вещества оказывают значительное влияние на свойства миелина как электроизолятора. Кроме обычных галактолипи-дов, цереброзидов и сульфатидов в миелине обнаружены моно-и диталактозилдиглицериды. Роль их и топографическое распределение в мембране миелина не ясны, но их синтез тесно связан с процессом миелинизации.
Для миелина характерен очень низкий уровень ганглиозидов – 0,15% от общих лигшдов миелина. Моносиалоганглиозид GM1 преобладает и, кроме того, в миелине человека обнаружен необычный сиалилгалактозилцерамид G7, содержащий в основном длинноцепочечные жирные кислоты. Метаболические характеристики миелиновых ганглиозвдов сходны с липидами миелина, а не с ганглиозидами коры. Ганглиозиды локализованы в зоне промежуточного периода и роль их в структуре и функции миелина пока не ясна.
Углеводородные цепочки жирных кислот миелина упакованы плотнее, чем в других мембранах, но ближе к середине бислоя они обладают большей свободой движения. Поскольку более чем у 25% жирных кислот миелина углеродный скелет на 4–5 атомов длиннее, чем в других мембранах, то в центре бислоя может происходить переплетение ацильных радикалов. Это особенно характерно для сфинголипидов. Церебрознды, сульфамиды и полифосфоинозитнды локализованы преимущественно в наружном монослое, в котором в два раза больше холестерина. Холестерин имеет предпочтительное сродство к длинноцепо-чечным радикалам сфинголипидов и к моноеновым оксикис-лотам галактолипидов. Он интеркалирован между гидрофобными цепочками и модулирует латеральную подвижность липидов и движение ацилов внутри бислоя. В зависимости от концентрации холестерин проявляет уплотняющий, сегрегирующий эффект или увеличивает жидкостность.
Фазовые переходы и внутримолекулярные движения компонентов миелина пока мало изучены.
Белковый состав миелина ЦНС относительно прост, два главных белка – сильноосновный, гистоноподобный белок и гидрофобный протеолипидный белок – составляют 60–80% от общих белков миелина. Оставшаяся часть падает на гетерогенную группу, включающую некоторые ферменты, гликопротеины, белок Вольфграма и неопределенное число минорных компонентов.
Гликопротеины миелина ЦНС являются минорными поверхностными компонентами промежуточного периода и играют определенную роль в нейронально-глиальном узнавании в процессе миелинизации.
Для миелина характерен ограниченный набор ферментов. Маркерным ферментом миелина является 2,3 – циклическая нуклео-твд-З-фосфогвдролаза, 60% от активности этого фермента в мозге приходится на миелин. Относительно специфическим ферментом миелина является также гидролаза эфиров холестерина, 70–80% его активности обнаружено в миелине. В поддержании низкого содержания воды в миелине принимает участие карбо-ангидраза Кроме того, в миелине присутствуют в относительно небольшом количестве зависимые и независимые от цАМФ протеинкиназы и фосфатаза.
Белок Вольфграма олигодендроглиального происхождения составляет менее 20% белков миелина и состоит из двух фракций с молекулярной массой 62000 и 54000. Это – кислый про-теолипид, обогащенный дикарбоновыми аминокислотами и содержащий 53% полярных и 47% неполярных аминокислот.
Протеолшшдная фракция Фолча-Ли гетерогенна и включает несколько белков. Наибольшей является доля липо-филина – белка с молекулярной массой 28000, составляющего 50% от общего протеолипидного белка. Его гидрофобность очень значительна. Он содержит 66% гидрофобных и только 18% заряженных аминокислот. В состав липофилина входит 2–3% ко-валентносвязанных жирных кислот, что еще более увеличивает его гидрофобность. Интересной особенностью этого белка является его конформационная гибкость. В водной среде степень его а-спирализации составляет 16–40%, в хлороформе-метаноле она выше, в совершенно гидрофобной среде липофилин имеет 100%-ную а-спиральную конфигурацию. Степень спирализа-ции липофилина в мембране составляет 75%. Кроме того, липофилин склонен к агрегации. Из-за своей гидрофобное™ он может быть погружен в углеводородную область бислоя и образовывать внутримембранные частицы. Белок прочно связывается с кислыми и нейтральными липидами и вызывает фазовое разделение кислых и нейтральных липидов. Около 15 молекул липидов окружают каждую молекулу липофилина. Благодаря некоторой избирательности гидрофобных взаимодействий липофилин вытесняет из своего окружения холестерин. В общем, липофилин, как и другие протеолипидные белки, поддерживает стабильность миелиновых мембран, создавая межла-меллярные взаимодействия между белковыми молекулами соседних слоев, в результате которых эти слои удерживаются вместе.
Катионный основной белок миелина с Мг ~1б~18кД является исключительно белком миелина и локализован в зоне главного периода. Он содержит 170 а.о., из них 30% заряженных и 52% гидрофобных. КБМ характеризуется несколькими необычными особенностями.
КБМ – антиген, индуцирующий при введении со стимуляторами иммунитета экспериментальный аллергический энцефаломиелит, заболевание, сходное с рассеянным склерозом и сопровождающееся демиелинизацией. Установлено, что трип-тофансодержащий декапептид КБМ–Phe-Ala-Ser-Trp-Gly-Ala-Glu-Gly-Glu-Arg близок по энцефалитогенной активности целому КБМ человека. Описаны и некоторые другие олигопептидные участки КБМ, обладающие несколько меньшим, но четким энцефалитогенным действием. По-видимому, внемозговые системы иммуногенеза воспринимают КБМ или его фрагменты как чужеродный белок. В норме КБМ с ними не взаимодействует в силу иммуноавтономности ЦНС. Какие-то, пока неясные повреждения, нарушая эту автономию, открывают путь этим взаимодействиям и обусловливают «агрессию» иммунной системы организма в отношении собственного миелина.
КБМ может гликолизироваться по треонину-981Ч-ацетил-галактозаминилтрансферазой и в отличие от других белков миелина может фосфорилироваться по некоторым остаткам серина, треонина, аргинина и гистидина. Фосфорилирование основного белка рассматривается как инициация миелиниза-ции.
Основной белок, связывая кластеры кислых липидов через полярные группы, изменяет упаковку ацилов в области полярных группировок и не оказывает существенного эффекта на центр бислоя. Этот белок изменяет энтальпию Т-фазового перехода кислых липидов и проницаемость бислоя, Липидный состав мембраны определяет, какие участки основного белка будут экранированы липидной фазой, а какие – экспонированы в водную фазу. Таким образом, от липидного состава мембраны зависит, будет ли антигенная или энцефалитегенная сторона подвержена атаке антителами и макрофагами. Этим, видимо, объясняется варьирование энцефалитогенных участков основного белка от вида к виду.
Электростатическое и гидрофобное взаимодействие основного белка с липидами близлежащих слоев, так же как и в случае липофилина, создает межламеллярные взаимодействия и поддерживает адгезию миелиновых слоев, стабилизируя многослойную структуру миелина.
Для понимания молекулярной организации мембраны миелина критическим является изучение коротко- и длинноради-усных взаимодействий между белками и липидами. Несомненно, что изменение структуры белков или липидов ведет к изменению такого рода взаимодействий и приводит к нестабильности миелина, в том числе к демиелинизации.
Пока мало известно о факторах, начинающих и заканчивающих образование миелиновых мембран. Возможно, что миели-низация запускается критическим диаметром аксона или каким-то нейротропным фактором. В этом строго контролируемом и синхронизированном процессе большую роль играют контакты между мембранами аксона и олигодендроглии.
Ранний, рыхлый, некомпактный миелин морфологически отличается от зрелого миелина наличием остатков цитоплазмы между слоями. Пластинчатые структуры рыхлого миелина химически сходны с плазматической мембраной олигодендроцита и не имеют физических свойств компактного миелина. Для превращения рыхлого миелина в компактный мозг 20-дневной крысы ежедневно синтезирует 3,5 мг миелина, т.е. каждый олигодендроцит производит миелина в 3 раза больше своей массы.
Компактность миелина увеличивается по мере включения основного и протеолипидного белков, холестерина, длинноцепочечных галактолипидов, плазмалогенов и, соответственно, по мере уменьшения доли высокомолекулярных белков, десмостерола, исчезновения полисиалоганглиозидов.
Мало известно о месте синтеза белков миелина, их транспорте и модификации перед сборкой, их деградации. Скорее всего, протеолипидный белок синтезируется на мембранносвязанных, а основной – на свободных рибосомах. Белки вступают в зреющую мембрану раньше липидов. В период активной мие-линизации катионный и протеолипидный белки активнее вступают в миелин, чем высокомолекулярные белки.
Зрелый миелин – не инертная структура, он биохимически активен, включает экзогенный материал, обменивает свои компоненты с другими мембранами. Миелин не обменивается как единое целое, поскольку различные белки и липиды покидают миелин и появляются в нем с различной скоростью. Наблюдаемая метаболическая стабильность компонентов миелина частично объясняется топографическими особенностями миелиновой оболочки. Одна глиальная клетка одновременно «одевает» миелином 30–50 сегментов аксонов и создает мембрану, которая в 620 раз больше ее собственной. Метаболизм этой обширнейшей мембраны поддерживается цитоплазмой всего одной клетки.
Для нормального функционирования необходимы определенные соотношения и взаимодействия аксона, миелиновой оболочки и глии. Любое повреждение одного из этих элементов нарушает всю систему. Так, например, метахроматическая лейкодистро-фия характеризуется почти полным отсутствием фермента суль-фатазы, что приводит к резкому накоплению сульфатидов и сопровождается недостатком миелина.
Глобоидно-клеточная лейкодистрофия сопровождается дефектом фермента fi-галактозидазы. Избыток цереброзидов накапливается в многоядерных глобоидных клетках, обычное отношение цереброзидов к сульфатидам 4:1 трансформируется в 10:1. Наблюдается резкое изменение белого вещества, недостаточность миелина и олигодендроглии.
Болезнь Рефсума характеризуется недостаточностью а-гидро-ксилазы фитановой кислоты. Накапливающаяся фитановая кислота эстерифицирует лецитин миелина и составляет 5–8% от всех жирных кислот миелина.
Общей чертой вышеприведенных заболеваний является искажение структуры миелина, уменьшение отношения липидов к белку, снижение количества холестерина, плазмалогенов, га-лактолипидов, увеличение количества воды и постепенная замена миелина астроцитами, макрофагами и межклеточной жидкостью.
Важным путем в изучении процесса демиелинизации является исследование мутантов с нарушенным или ограниченным образованием миелина.
Jumpy-мутанты – это аугосомальное рецессивное заболевание мышей, характеризующееся почти полным отсутствием миелина.
Quaking-мугаюы – рецессивное заболевание мышей, сцепленное с полом, характеризующееся некомпактностью миелина и нарушением дифференциация олигодендроглии. У этого вида мышей резко уменьшен уровень основных липидов миелина, особенно трифосфоинозитидов, изменен жирнокислотный состав.
Похожие работы
... в синапсах вызывают деполяризацию или гиперполяризацию постсинаптической клетки. Потенциалы действия, представляющие собой короткие деполяризационные сигналы большой амплитуды, проводят по отросткам нейрона информацию из одного отдела нервной системы в другой. Все эти изменения мембранного потенциала вызваны движением ионов через клеточную мембрану. Например, направленное внутрь клетки движение ...
... , лептоспироз и др.) и вторичными (вертеброгенные, после детских экзантемных инфекций, инфекционного мононуклеоза, при узелковом периартериите, ревматизме и др.). По патогенезу и патоморфологии заболевания периферической нервной системы подразделяются на невриты (радикулиты), невропатии (радикулопатии) и невралгии. Невриты (радикулиты) – воспаление периферических нервов и корешков. По характеру ...
... , обволакивающие, адсорбирующие и др.). В этих же направлениях влияют местноанестезирующие вещества, выключающие отдельные звенья чувствительных нервов. Подавить боль можно, применяя вещества, угнетающие центральную нервную систему. Все эти средства используют при соответствующих показаниях. Но при болевых синдромах, являющихся следствием воспалительных процессов в организме, исключительно ...
... составляют тела клеток, дендриты и немиелинизированные аксоны, организованные в комплексы, которые включают бесчисленное множество синапсов и служат центрами обработки информации, обеспечивая многие функции нервной системы. Белое вещество состоит из миелинизированных и немиелинизированных аксонов, выполняющих роль проводников, передающих импульсы из одного центра в другой. В состав серого и белого ...
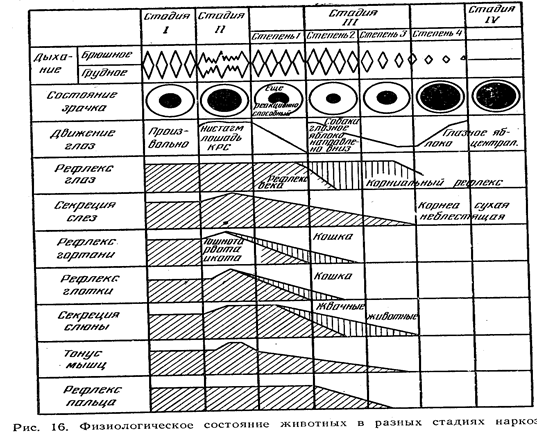

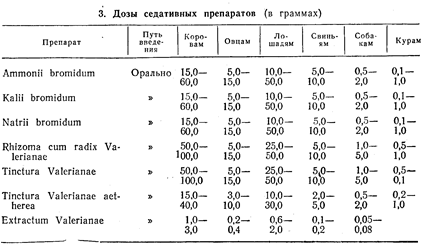


0 комментариев