Навигация
Строение антител и их многообразие
1.2 Строение антител и их многообразие
Основную структурную единицу молекулы антитела образуют четыре полипептидные цепи – две идентичные легкие (L-цепи, каждая примерно из 220 аминокислот) и две идентичные тяжелые (Н-цепи, каждая примерно из 440 аминокислот). Все четыре цепи соединены между собой с помощью нековалентных взаимодействий и ковалентных связей (дисульфидных мостиков). Молекула состоит из двух одинаковых половинок, в которых L- и Н-цепи вносят почти равный вклад в построение двух идентичных антиген-связывающих участков (рис. 3).
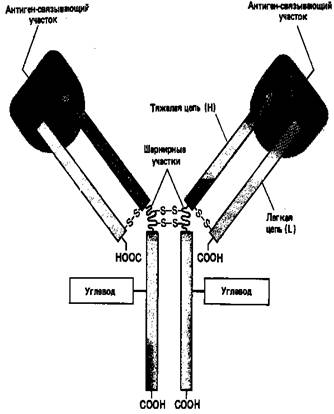
Рисунок 3. Схематическое изображение типичной молекулы антителу состоящей из двух идентичных тяжелых (Н) и двух идентичных лёгких (L) цепей. Антиген-связывающие участки формируются за счет комплекса N-концевых областей L- и Н-цепей, а область «хвоста» образуют только Н-цепи. Каждая цепь содержит одну или несколько олигосахаридных цепочек, функция которых не известна.
Протеолитические ферменты папаин и пепсин расщепляют молекулы антител на различные характерные фрагменты: папаин дает два отдельных идентичных Fab-фрагмента, каждый из которых обладает одним антиген- связывающим участком, и один Fc-фрагмент (Fab - сокращение слов fragment antigen binding; Fc означает «кристаллизующийся фрагмент» (от crystallizable).; пепсин дает один Р(аb')2-фрагмент, состоящий из двух ковалентно связанных Р(аb')-фрагмент (каждый из которых немного больше, чем Fab-фрагмент), и много более лёгких фрагментов (рис. 4). Поскольку Р(аb')2-фрагменты бивалентны в отличие от моновалентных Fab-фрагментов сохраняют способность связывать антигены и образовывать преципитаты. Ни один из этих фрагмент обладает другими биологическими свойствами нативных молекул антигенов поскольку они не содержат «хвостовой» (Fc) области, определяющей их свойства.
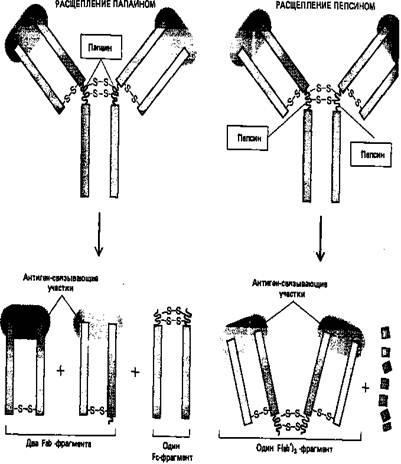
Рисунок 5. Различные фрагменты, образующиеся при расщеплении молекул антител двумя различными протеолитическими ферментами (папаином и пепсином), помогли исследователям в выяснении четырехцепочечной структуры антител.
Существует пять разных классов Н-цепей, каждый
со своими особыми биологическими свойствами
У высших позвоночных существуют пять разных классов антител – IgA IgE, IgG и IgM, каждый со своим классом Н-цепей – a, b, е, g, и m соответственно. Молекулы IgA содержат a-цепи, молекулы IgG-g-цепи. Кроме того, имеется ряд подклассов IgG и некоторых других иммуноглобулинов. Разные Н-цепи придают «хвостовым» областям антител различную конформацию и определяют характерные свойства каждого класса.
IgG-антитела составляют основной класс иммуноглобулинов, находящийся в крови. Они производятся в больших количествах при вторичном иммунном ответе. Fc-область молекул IgG связывается со специфическими рецепторами фагоцитирующих клеток, таких как макрофаги и полиморфноядерные лейкоциты, и в результате эти клетки могут более эффективно поглощать и разрушать внедрившиеся микроорганизмы, покрытые IgG-антителами (рис. 6).
Молекулы IgG-единственные антитела, которые могут переходить от матери к плоду. Клетки плаценты, соприкасающиеся с материнской кровью, имеют рецепторы, связывающие Fc-области молекул IgG и обеспечивающие тем самым их переход в плод. Антитела сначала поглощаются путем эндоци-тоза при участии рецепторов, а затем транспортируются через клетку и выводятся путем экзоцитоза в кровь плода. Антитела других классов не связываются с этими рецепторами и поэтому не могут проходить через плаценту.
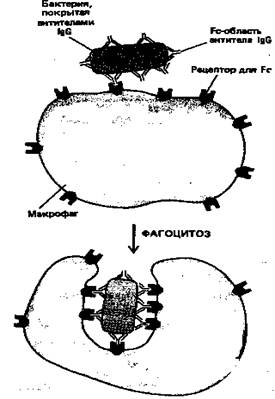
Рисунок 6. Эта схема показывает, как бактерия, покрытая антителами IgG, эффективно фагоцитируется макрофагами, имеющими на своей поверхности рецепторы, способные связывать Fc-область молекулы IgG. Связывание бактерии с этими рецепторами активирует процесс фагоцитоза.
Хотя IgG-явно преобладающий класс антител, образуемых при большинстве вторичных иммунных ответов, на ранних стадиях первичного иммунного ответа в кровь поступают главным образом антитела IgM. В секретируемой форме IgM представляет собой пентамер, состоящий из пяти четырехцепочечных единиц, так что в общей сложности IgM имеет 10 антиген-связывающих участков. Такие пентамеры даже более эффективно, чем IgG, активируют систему комплемента, когда они связываются с антигеном. Каждый пентамер содержит полипептидную цепь еще одного типа, называемую J-цепью (joining chain, ~ 20 000 дальтон). J-цепь синтезируется IgM-секретирующими клетками, ковалентно встраивается между двумя смежными Fc-областями и, по-видимому, инициирует процесс олигомеризации. IgM-это также первый класс антител, продуцируемых развивающимися В-клетками, хотя многие В-клетки со временем переключаются на выработку антител других классов. Непосредственные предшественники В-клеток, так называемые пре-В-клетки, вырабатывают μ-цепи (но не легкие цепи) и накапливают их. Позднее, когда в пре-В-клетках начинают синтезироваться и легкие цепи, они соединяются с j-цепями, образуя с ними четырехцепочечные молекулы IgM (каждая с двумя μ-цепями и двумя легкими цепями), которые встраиваются в плазматическую мембрану, где служат рецепторами для антигена. С этого момента клетки становятся В-лимфоцитами и способны реагировать на антиген. Хотя встраиваться в мембраны (в качестве антиген-специфических рецепторов) и секретироваться в водорастворимой форме могут антитела всех классов, на поверхности большинства покоящихся В-клеток находятся главным образом антитела IgM и IgD. Удивительно, что лишь очень немногие В-клетки активируются для секреции антител IgD, и у этого класса не известно никакой функции, кроме роли рецепторов для антигена.
IgA-основной класс антител в секретах (молоке, слюне, слезах, секретах дыхательных путей и кишечного тракта). Они существуют либо в виде четы-рехцепочечного мономера (подобно IgG), либо в виде димера. Молекулы IgA в составе секретов представляют собой димеры, содержащие одну J-цепь, а также дополнительную полипептидную цепь, называемую секреторным компонентом, которую димеры IgA приобретают на поверхности эпителиальных клеток, выстилающих кишечник, бронхи или протоки молочных, слюнных или слезных желез. Секреторный компонент синтезируется эпителиальными клетками и экспонируется вначале на их базальной поверхности, где служит рецептором для связывания IgA из крови. Образующиеся комплексы IgA с секреторным компонентом поглощаются путем эндоцитоза при участии рецепторов, проходят через цитоплазму эпителиальной клетки и выводятся в проток на противоположной стороне клетки. В дополнение к такой транспортной роли секреторный компонент, возможно, защищает молекулы IgA от переваривания протеолитическими ферментами секретов.
Fc-область молекул IgE связывается со специфическими рецепторными белками на поверхности тучных клеток в тканях и базофильных лейкоцитов в крови с очень высоким сродством (> 1010 литров/моль). В свою очередь связанные молекулы IgE служат рецепторами для антигена: присоединение к ним антигена приводит к секреции клетками биологически активных аминов (в частности, гистамина, а у некоторых видов – серотонина). Их защитная функция менее ясна, однако предполагается, что они делают область воспаления более доступной для лейкоцитов, антител и компонентов комплемента.
Похожие работы
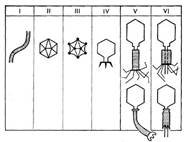
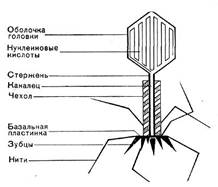
... оболочки отростка и от белка базальной пластинки и ее нитевидных образований, что говорит о сложности структуры фаговой частицы. По антигенным свойствам фаг резко отличается от чувствительных к нему микробов. Механизм воздействия бактериофагов на бактериальную клетку Размножение фагов Взаимоотношения между фагом и чувствительной к нему клеткой очень сложны и не всегда завершаются лизисом ...
... , вирус Эбола и другие, способны ассоциироваться с "плотами" клеточной мембраны. Также филовирусы Эбола и Марбурга проникают в клетки путем кавеолин-опосредованного эндоцитоза, при котором белок кавеолин связан с микродоменами плазмалеммы. Механизм проникновения вирусов путем эндоцитоза, независимого от клатрина и кавеолина и опосредованного липидными площадками плазмалеммы - "плотами", главным ...
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
... - ядре, митохондриях, мембранах и др; в разных типах клеток- нервных, секреторных, иммунных, печёночных и др. Темп возрастных изменений определяется соотношением процессов старения и витаукта. Механизмы могут быть разделены на 2 группы. 1. Генотипические- генетически запрограммированные механизмы: а) система антиоксидантов, связывающая свободные радикалы; б) система микросомального ...
0 комментариев