Навигация
Пути поиска и разработки новых лекарственных средств (препаратов)
1.1. Пути поиска и разработки новых лекарственных средств (препаратов)
Создание новых лекарственных субстанций и препаратов — процесс весьма трудоемкий и дорогостоящий, в котором участвуют представители многих профессий: химики, фармацевты, фармакологи, токсикологи, врачи-клиницисты, биологи и др. Эти совместные усилия специалистов не всегда завершаются успешно. Так, из 7 тысяч синтезированных соединений только одно становится лекарственным средством.
Для поиска новых синтетических лекарственных субстанций или субстанций из лекарственного растительного сырья еще не разработаны устойчивые теории.
Общепринятым каноном целенаправленного поиска синтезированных лекарственных средств является установление связей между фармакологическим действием и структурой с учетом их физико-химических свойств. В настоящее время поиск новых лекарственных средств (по А.Н.Кудрину) ведется по следующим направлениям.
Эмпирическое изучение БАВ основано на представлении, что многие вещества обладают определенной фармакологической активностью. В основе этого изучения лежит метод "проб и ошибок", с помощью которого фармаколог определяет принадлежность полученных веществ к той или иной фармакотерапевтиче-ской группе. Затем среди них отбираются наиболее активные вещества и устанавливается степень их специфической активности и токсичности по сравнению с существующими лекарственными средствами — аналогами по действию. Такой путь отбора фармакологически активных веществ получил название скрининга. Это весьма дорогой и трудоемкий метод, так как приходится иметь дело с большим количеством различных биологически активных веществ.
Объем первичных исследований изучаемого вещества зависит от его природы. Если оно является производным известного ряда соединений, то, как правило, ограничиваются лишь сравнительным изучением его специфического действия. Если вещество оригинальное, то планируется целенаправленное всестороннее его изучение. Рассматривается такое соединение как потенциальное лекарственное вещество. Уже на начальной стадии планирования в исследования включают изучение химических и физических свойств, разработку методов стандартизации и контроля за его качеством. Последующие экспериментальные исследования должны проводиться только с сериями вещества, полученного по технологии, обеспечивающей его стандартные качественные и количественные характеристики.
Модификация структур существующих лекарственных средств — весьма распространенное направление. Химики заменяют в существующем соединении один радикал другим, например, метальный этильным, пропильным и другими алкильными радикалами с более высокой молекулярной массой или, наоборот, вводят в состав исходной молекулы новые химические элементы, в частности галогены, нитрогруппы, или производят иные модификации основной структуры. Этот путь позволяет изменить структуру молекулы вещества, что приводит к изменению его активности, уменьшению отрицательных свойств и токсичности, придает совершенно новую направленность терапевтическому действию.
По мере развития науки стало совершенно очевидным, что оптимальный поиск новых лекарственных средств должен базироваться на выявлении БАВ, участвующих в процессах жизнедеятельности, на раскрытии патофизиологических и патохимиче-ских процессов, лежащих в основе патогенеза различных заболеваний, а также на углубленном изучении механизмов фармакологического эффекта. В подходах к скрининговым исследованиям должен лежать не метод случайных наблюдений, а направленный синтез веществ с улучшенными свойствами и предполагаемой активностью.
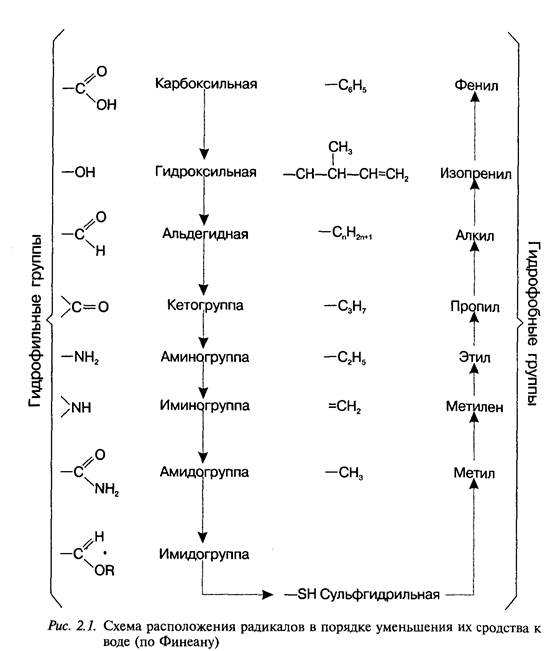
Целенаправленный синтез лекарственных веществ означает поиск веществ с заранее заданными фармакологическими свойствами. Синтез новых структур с предполагаемой активностью чаще всего проводится в том классе химических соединений, где уже найдены вещества, обладающие определенной направленностью действия в нужном для исследователя аспекте. Целенаправленный синтез веществ труднее осуществлять в новых химических классах соединений ввиду отсутствия необходимых первоначальных сведений о связи фармакологической активности со структурой вещества. Далее в избранное основное вещество вводят различные радикалы. Очень важно получить вещество, растворимое в воде и жирах, чтобы оно могло всосаться в кровь, перейти из нее через гематотканевые барьеры в органы и затем вступить в связь с клеточными мембранами или проникнуть через них внутрь клетки и соединиться с биомолекулами. представлены наиболее часто встречающиеся в лекарственных веществах радикалы и их сродство к воде и липидам. С помощью указанных и аналогичных им радикалов можно повысить лечебную активность липотропных веществ. Например, введение фтора в молекулу психотропных средств фенотиазинового ряда и в молекулу глюкокортикоидных гормонов существенно повышает их активность. Поиск новых биологически активных веществ дает удовлетворительные результаты при синтезе антагонистов тех веществ, которые участвуют в жизнедеятельности организма (медиаторы, витамины, гормоны) или являются незаменимыми участниками биохимических процессов (субстраты ферментов, коферменты и др.).
При синтезе новых лекарственных веществ их фармакологическая активность определяется не только размерами и формой молекулы, но и в значительной степени стерическими факторами, кото которые влияют на положение молекул в пространстве. Например, транс-амин (транилципромин) оказывает антидепрессивное действие

с возбуждающим эффектом. Его геометрический изомер — цис-амин сохраняет антидепрессивное действие, но при этом у него исчезает возбуждающий эффект и появляется противоположный ему транквилизирующий компонент действия, являющийся весьма ценным в практическом отношении.
У изомеров может изменяться не только фармакологическая активность, но и токсичность. Токсичность цис-амина по показателю LDso (на мышах) в 6 раз меньше, чем у транс-амина, поэтому при целенаправленном синтезе нового лекарственного вещества возникает необходимость изучения его изомеров.
Рондомизированный скрининг позволяет получить принципиально новые синтетические или природного происхождения вещества на основании скринингового исследования на животных с помощью набора тестов по изучению эффективности и безопасности новых соединений. В последнее время с помощью этого сложного скринингового исследования в медицинскую практику были внедрены психотропное средство антидепрессант — пиразидол, противовирусный препарат — арбидол и др.
Велика значимость в медицинской практике лекарственных субстанций, полученных из растительного сырья, которые имеют ряд преимуществ по сравнению с синтетическими веществами (более мягкое, часто пролонгированное действие); они, как правило, не вызывают аллергических осложнений .
Ход и содержание эксперимента (поиск, изучение и постановка на производство) с новым лекарственным средством, выделенным из растительного сырья, могут быть определены стандартом предприятия .
Следует отметить, что поиск оригинальных лекарственных субстанций не всегда экономически выгоден, особенно для слаборазвитых стран, поскольку требует больших затрат на доведение их до производства, а высокая стоимость лекарств, изготовленных на основе этих субстанций, делает их недоступными для потребителя. Поэтому многие фармацевтические фирмы для создания лекарственных препаратов используют импортные субстанции, хорошо себя
зарекомендовавшие в медицинской практике и время патентной защиты которых истекло. Эти препараты называют генериками (ge-nerics). Примером такого подхода может быть производство септри-ма (английской фирмы "Welcome") и бисептола (польской фирмы "Polfa") на базе сульфаметоксазола (0,4 г) и триметоприма (0,08 г). Такой путь создания лекарств позволяет быстрее насытить ими рынок, значительно снизить экономические затраты на их создание, улучшив качество за счет более оптимального подбора вспомогательных веществ и технологических приемов.
Необходимо отметить, что стоимость препаратов-генериков иногда составляет 20-60% от стоимости аналогичных импортных лекарств.
Выявление новых свойств у лекарственных препаратов, уже применяющихся в клинике, путем тщательного наблюдения за их действием на различные системы организма. Таким образом было установлено гипотензивное свойство р-адреноблокаторов, проти-вотромбическая активность ацетилсалициловой кислоты.
Составление композиций комбинированных препаратов — один из путей поиска новых лекарств. Принципы, на основе которых создаются эти лекарства, могут быть различными.
Чаще всего в комбинированные препараты включают лекарственные вещества, оказывающие адекватное действие на причину заболевания и основные звенья патогенеза болезни. В комбинированный препарат обычно включают лекарственные вещества в малых или средних дозах, когда между ними существуют явления синергизма — взаимного усиления действия в виде потенцирования или суммирования. Комбинированные препараты интересны тем, что принципы синергизма, на основе которых они созданы, позволяют добиться лечебного эффекта при отсутствии или минимуме отрицательных явлений. Кроме того, введение малых доз лекарственных веществ не нарушает естественных защитных или компенсаторных механизмов, развивающихся в организме в ответ на болезнь. К средствам, подавляющим отдельные звенья патологии, желательно добавлять лекарственные вещества, стимулирующие защитные силы организма.
В комбинированные препараты, регулирующие деятельность центральной нервной системы, необходимо включать вещества, соответственно влияющие на деятельность исполнительных органов — сердце, сосуды, почки и др.
Комбинированные препараты противомикробного действия составляются из таких ингредиентов, каждый из которых повреждает разные системы размножения и жизнеобеспечения микробов.
В комбинированные препараты очень часто включаются дополнительные ингредиенты, которые усиливают (расширяют) эффективность основного вещества или устраняют его отрицательное действие. Так, комбинированный препарат "Солпадеин R", содержащий парацетамол и кодеин, обеспечивает более выраженный анальгизирующий эффект по сравнению с используемыми субстанциями, взятыми отдельно, поскольку болевые импульсы "перекрываются" на всем протяжении от периферии до центра и наоборот (кодеин оказывает центральное действие, а парацетамол наряду с этим — периферическое). Кроме того, такое сочетание двух субстанций позволяет уменьшить их дозу, сохранив продолжительность и эффективность действия.
Для профилактики и лечения многих заболеваний, а также для повышения сопротивляемости организма к инфекциям и во многих других случаях используются поливитаминные препараты, часто содержащие микроэлементы. Их составы формируются с учетом назначения: поливитамины общего назначения ("Альвитил", "Вит-рум", "Дуовит", "Мегавит", "Мульти-табс", "Олиговит", "Супра-дин", "Юникап Ю" и др.); для профилактики заболеваний нервной и сердечно-сосудистой системы ("Биовиталь", "Мультивитамины плюс", "Желе Роял"); для профилактики кариеса ("Ви-Дайлин Ф", "Ви-Дайлин Ф-АДС с железом", "Витафтор"); для профилактики онкозаболеваний ("Детский антиоксидант", "Супрантиоксидант", "Триовит"); для применения в период беременности ("Гравинова", "Матерна", "Поливит нова вита", "Прегнавит"). Они имеют различные лекарственные формы (таблетки, таблетки шипучие, драже, сиропы, капли, капсулы, растворы и т.д.), различный режим дозирования и условия применения.
Широкий ассортимент комбинированных витаминных составов позволяет осуществить индивидуальный подбор лекарств для каждого конкретного случая.
1.2.Экспериментальное изучение и клинические испытания лекарств.
Реализация жесткого требования современной фармакотерапии — минимальной дозой лекарства обеспечить оптимальный терапевтический эффект без побочных явлений — возможна лишь при тщательном изучении новых лекарственных препаратов на доклиническом и клиническом этапах.
Доклиническое (экспериментальное) изучение биологически активных веществ принято условно подразделять на фармакологическое и токсикологическое. Эти исследования взаимозависимы и строятся на одних и тех же научных принципах. Результаты изучения острой токсичности потенциального фармакологического вещества дают информацию для проведения последующих фармакологических исследований, которые в свою очередь определяют степень и продолжительность изучения хронической токсичности вещества.
Целью фармакологических исследований является определение терапевтической эффективности исследуемого продукта — будущего лекарственного вещества, его влияния на основные системы организма, а также установление возможных побочных эффектов, связанных с фармакологической активностью.
Очень важно установить механизм действия фармакологического средства, а при наличии — и не основных видов действия, а также возможное взаимодействие с другими лекарственными средствами.
Фармакологические исследования проводятся на моделях соответствующих заболеваний или патологических состояний с применением однократно вводимых, постоянно возрастающих доз веществ с целью поиска необходимого эффекта. Данные начальных фармакологических исследований уже могут дать некоторые представления о токсичности вещества, которые должны быть углублены и расширены при специальных исследованиях.
При токсикологических исследованиях фармакологического средства устанавливается характер и выраженность возможного повреждающего воздействия на организм экспериментальных животных. Выделяются четыре этапа исследований.
1. Изучение основного вида фармакологической активности на нескольких экспериментальных моделях у животных, а также установление фармакодинамики лекарственного средства.
2.Изучение острой токсичности средства при однократном при
менении (введении) проводят с целью определения наличия побоч
ных реакций при однократном приеме увеличенной дозы и установ
лении причин летальности; широты терапевтического действия или
терапевтического индекса Эрлиха (отношение максимально перено
симой дозы к максимальной терапевтической), что невозможно
установить в клинических условиях. При изучении острой токсич
ности определяют показатель DLso для различных видов животных
и рассчитывают коэффициент видовой чувствительности по отно
шению DL50max/DE50min. Если этот коэффициент равен 1 или
близок к ней, то это свидетельствует об отсутствии видовой чувст
вительности. Если же коэффициент значительно отличается от
единицы, это указывает на различную выраженность токсического
действия фармакологического средства на разные виды млекопита
ющих, что необходимо учитывать при пересчете экспериментальной
эффективной дозы для человека.
3.Определение хронической токсичности соединения, которое
включает в себя повторные введения фармакологического средства
на протяжении определенного времени в зависимости от предпола
гаемого курса его применения в клинике. Исследуемое средство
обычно вводят ежедневно в трех дозах: близкой к терапевтической,
предполагаемой терапевтической и максимальной с целью выявле
ния токсичности. Во время эксперимента определяется объем по
требления животными корма и воды, динамика их массы, изменение
общего состояния и поведения (реакций); проводятся гематологи
ческие и биохимические исследования. По окончании эксперимента
животных забивают и проводят патоморфологические исследования
внутренних органов, мозга, костей, глаз.
4.Установление специфической токсичности фармакологи
ческого средства (канцерогенное™, мутагенности, эмбриотоксич-
ности, гонадотоксичности, аллергизирующих свойств, а также спо
собности вызывать лекарственную зависимость, иммунотоксичес-
кого действия).
Выявление повреждающего действия испытуемого средства на организм экспериментальных животных дает исследователям информацию о том, какие органы и ткани наиболее чувствительны к потенциальному лекарственному средству и на что следует обратить особое внимание при проведении клинических испытаний.
Исследование новых фармакологических средств на животных основывается на данных о существовании определенной корреляции между влиянием этих соединений на животных и человека, физиологические и биохимические процессы которых во многом сходны. В связи с тем, что между животными имеются существенные видовые различия в интенсивности обмена веществ, активности ферментных систем, чувствительных рецепторов и т.д., исследования проводят на нескольких видах животных, включая кошек, собак, обезьян, которые в филогенетическом отношении стоят ближе к человеку.
Следует отметить, что аналогичная схема проведения лабораторных (экспериментальных) исследований приемлема как для простого, так и для сложного лекарственного препарата, в эксперименте с которым планируются обязательные дополнительные биофармацевтические исследования, подтверждающие оптимальный выбор вида лекарственной формы и ее состава .
Экспериментальное доклиническое изучение нового средства (его фармацевтических, фармакологических и токсикологических свойств) проводится по стандартным унифицированным методикам, которые обычно описываются в методических рекомендациях Фармакологического комитета, и должно отвечать требованиям Good Laboratory Practice (GLP) — Надлежащей лабораторной практики (НЛП).
Доклинические исследования фармакологических веществ позволяют разработать схему рациональных испытаний лекарственных препаратов в условиях клиники, повысить их безопасность. Несмотря на большую значимость доклинических исследований новых веществ (препаратов), окончательное суждение об их эффективности и переносимости складывается только после проведения клинических испытаний, а нередко, и после определенного периода их широкого применения в медицинской практике.
Клинические испытания новых лекарственных средств и препаратов должны проводиться с максимальным соблюдением требований международного стандарта "Надлежащая клиническая практика" (Good Clinical Practice (GCP)), который регламентирует планирование, проведение (дизайн), мониторинг, длительность, аудит, анализ, отчетность и ведение документации исследования.
При проведении клинических испытаний лекарственных препаратов используются специальные термины, в содержание которых вкладывается определенный смысл. Рассмотрим основные термины, принятые GCP.
Клинические испытания — систематическое изучение исследуемого препарата на людях в целях проверки его лечебного действия или выявления нежелательной реакции, а также изучение всасывания, распределения, метаболизма и выведения из организма для определения его эффективности и безопасности.
Исследуемый продукт — фармацевтическая форма активного вещества или плацебо, изучаемого или используемого для сравнения в клиническом испытании.
Спонсор (заказчик) — физическое или юридическое лицо, которое принимает на себя ответственность за инициативу, управление и/или финансирование клинических испытаний.
Исследователь — лицо, ответственное за проведение клинического испытания.
Субъект испытания — лицо, участвующее в клинических испытаниях исследуемого продукта.
Гарантия качества клинических испытаний — комплекс мер, обеспечивающих соответствие проводимых испытаний требованиям GCP, основанных на нормах общей и профессиональной этики, стандартных операционных процедурах и отчетности.
Для проведения клинических испытаний заводом-изготовителем нарабатывается определенное количество препарата, контролируется его качество в соответствии с требованиями, заложенными в проекте ВФС, затем он фасуется, маркируется (указывается "Для клинических испытаний") и направляется в медицинские учреждения. Одновременно с лекарственным препаратом в адрес клинических баз направляется следующая документация: представление, решение ГНЭЦЛС, программа клинических испытаний и др.
Решение о проведении клинических испытаний с правовой точки зрения и их оправданность в этическом отношении основывается на оценке экспериментальных данных, полученных в опытах на животных. Результаты экспериментальных, фармакологических и токсикологических исследований должны убедительно свидетельствовать о целесообразности проведения испытаний нового лекарственного препарата на людях.
В соответствии с существующим законодательством клинические испытания нового лекарственного препарата проводятся на больных, страдающих теми заболеваниями, для лечения которых предназначено данное лекарство.
Министерством здравоохранения утверждены методические рекомендации по клиническому изучению новых лекарств, относящихся к различным фармакологическим категориям. Они разрабатываются ведущими учеными медицинских учреждений, обсуждаются и утверждаются Президиумом ГНЭЦЛС. Применение этих рекомендаций гарантирует безопасность больных и способствует повышению уровня клинических испытаний.
Любое исследование на человеке должно быть хорошо организовано и проводиться под контролем специалистов. Неправильно проведенные испытания признаются неэтичными. В связи с этим большое внимание уделяется планированию клинических испытаний.
Для того чтобы в работе врачей не проявлялись узкопрофессиональные интересы, которые не всегда отвечают интересам больного и общества, а также с целью обеспечения прав человека, во многих странах мира (США, Великобритания, Германия и др.) созданы специальные этические комитеты, призванные контролировать научные исследования лекарств на людях. Этический комитет создан и в Украине.
Приняты международные акты об этических аспектах проведения медицинских исследований на людях, например, Нюрнбергский кодекс (1947), в котором отражены вопросы защиты интересов человека, в частности, неприкосновенности его здоровья, а также Хельсинская декларация (1964), содержащая рекомендации для врачей по биомедицинским исследованиям на людях. Изложенные в них положения носят рекомендательный характер и в то же время не освобождают от уголовной, гражданской и моральной ответственности, предусмотренной законодательствами этих стран.
Медико-правовые основы этой системы гарантируют как безопасность и своевременное адекватное лечение больных, так и обеспечение общества наиболее эффективными и безопасными лекарствами. Только на основе официальных испытаний, методически верно спланированных, объективно оценивающих состояние больных, а также научно проанализированных экспериментальных данных можно сделать правильные выводы о свойствах новых лекарств.
Программы клинических испытаний для различных фармакоте-рапевтических групп лекарственных препаратов могут значительно отличаться. Однако имеется ряд основных положений, которые всегда отражаются в программе: четкая формулировка целей и задач испытания; определение критериев выбора для испытаний; указание методов распределения больных в испытуемую и контрольную группы; число больных в каждой группе; метод установления эффективных доз лекарственного препарата; длительность и метод проведения испытания контролируемого препарата; указание препарата сравнения и/или плацебо; методы количественной оценки действия используемого препарата (подлежащие регистрации показатели); методы статистической обработки полученных результатов (рис. 2.3).
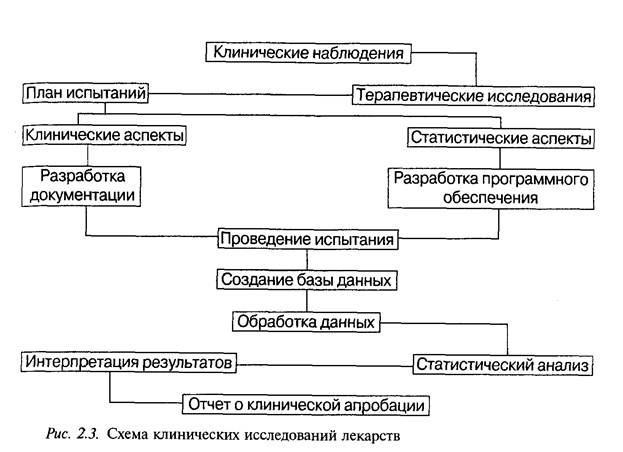
Программа клинических испытаний проходит обязательную экспертизу в комиссии по вопросам этики.
Участвующие в испытании нового препарата пациенты (добровольцы) должны получить информацию о сути и возможных последствиях испытаний, ожидаемой эффективности лекарства, степени риска, заключить договор о страховании жизни и здоровья в порядке, предусмотренном законодательством, а во время испытаний находиться под постоянным наблюдением квалифицированного персонала. В случае возникновения угрозы здоровью или жизни пациента, а также по желанию пациента или его законного представителя, руководитель клинических испытаний обязан приостановить испытания. Кроме того, клинические испытания приостанавливаются в случае отсутствия или недостаточной эффективности лекарства, а также нарушения этических норм.
Клиническая апробация генерических препаратов в Украине проводится по программе "Ограниченные клинические испытания" по установлению их биоэквивалентности.
В процессе клинических испытаний лекарства выделяют четыре взаимосвязанные фазы: 1 и 2 — дорегистрационные; 3 и 4 — пострегистрационные.
Первая фаза исследования проводятся на ограниченном числе больных (20-50 человек). Цель — установление переносимости лекарственного препарата.
Вторая фаза — на 60-300 больных при наличии основной и контрольной групп и использовании одного или нескольких препаратов сравнения (эталонов), желательно с одинаковым механизмом действия. Цель — проведение контролируемого терапевтического (пилотного) исследования препарата (определение диапазонов: доза — режим применения и, если возможно, доза — эффект) для оптимального обеспечения дальнейших испытаний. Критериями оценки обычно служат клинические, лабораторные и инструментальные показатели.
Третья фаза — на 250-1000 человек и более. Цель — установить краткосрочный и долгосрочный баланс безопасность — эффективность лекарственного препарата, определить его общую и относительную терапевтическую ценность; изучить характер встречающихся побочных реакций, факторы, изменяющие его действие (взаимодействие с другими лекарственными препаратами и др.). Испытания должны быть максимально приближенными к предполагаемым условиям использования данного лекарственного препарата.
Результаты клинического испытания заносятся в индивидуальную стандартную карту каждого больного. В конце испытания полученные результаты суммируются, обрабатываются статистически и оформляются в виде отчета (в соответствии с требованиями ГНЭЦЛС), который заканчивается аргументированными выводами.
Отчет о клинических испытаниях лекарственного препарата направляется в ГНЭЦЛС, где подвергается тщательной экспертизе. Конечным результатом экспертизы всех поступивших в ГНЭЦЛС материалов является инструкция по применению лекарственного препарата, регламентирующая его применение в клинических условиях.
Лекарственный препарат может быть рекомендован к клиническому применению в том случае, если он эффективнее известных лекарств аналогичного типа действия; обладает лучшей переносимостью по сравнению с известными препаратами (при одинаковой эффективности); эффективен при состояниях, когда применение имеющихся лекарств безуспешно; экономически более выгоден, имеет более простую методику применения или более удобную лекарственную форму; при комбинированной терапии повышает эффективность уже существующих лекарств, не увеличивая их токсичности.
Четвертая фаза (постмаркетинговая) исследований проводится на 2000 и более человек после разрешения лекарственного препарата к медицинскому применению и промышленному производству (после поступления лекарства в аптеку). Основная цель — сбор и анализ информации о побочных эффектах, оценка терапевтической ценности и стратегии назначения нового лекарственного препарата. Исследования в четвертой фазе осуществляются на основе информации в инструкции по применению препарата.
При проведении клинических испытаний новых лекарственных препаратов важнейшей задачей является обеспечение их качества. Для достижения этой цели осуществляется мониторинг, аудит и инспекция клинических испытаний.
Мониторинг — деятельность по контролю, наблюдению и проверке клинического испытания, осуществляемая монитором. Монитор является доверенным лицом организатора клинических испытаний (спонсора), на которого возлагается обязанность непосредственно контролировать ход исследования (соответствие полученных данных данным протокола, соблюдение этических норм и др.), оказывать помощь исследователю в проведении испытания, обеспечивать его связь со спонсором.
Аудит — независимая проверка клинического испытания, которая проводится службами или лицами, не участвующими в нем.
Аудит может проводиться также представителями государственных органов, отвечающих за регистрацию лекарственных препаратов в стране. В этих случаях аудит называется инспекцией.
Работая параллельно для достижения единой цели, монитор, аудиторы и официальные инспекции обеспечивают необходимое качество клинических испытаний.
При проведении клинических испытаний с участием большого количества пациентов возникает необходимость в оперативной обработке результатов исследования. С этой целью корпорацией "Pfizer" разработаны новые методы информатики (компьютерная программа "Q-NET" для обработки базы данных, полученных при исследовании препарата "Viagra"), позволяющие ознакомиться в течение суток с результатами клинических испытаний с участием 1450 пациентов, которые проводятся в 155 клинических центрах, находящихся в различных странах. Создание таких программ позволяет сократить до минимума время продвижения новых препаратов на этапе клинических испытаний.
Таким образом, эффективность и безопасность лекарств гарантируется:
· испытаниями в условиях клиники;
· постмаркетинговыми клиническими исследованиями при широком медицинском применении лекарств;
· тщательной экспертизой результатов на всех указанных выше этапах.
Наличие комплексной оценки эффективности и безопасности лекарств и экстраполяции результатов на трех этапах позволяет выявить механизмы возможного побочного действия, уровня ток сичности лекарства, а также разработать наиболее оптимальные схемы его применения.
Вырисовывается перспектива комплексного подхода, основанного на оптимальном сочетании принципов биофармации, новейших достижений химических и фармацевтических технологий, с широким привлечением клинического опыта к созданию и производству новых лекарственных препаратов. Такой подход к этой проблеме является качественно новым в фармацевтической практике и, очевидно, позволит раскрыть новые возможности в сложном процессе создания и использования лекарственных препаратов.
Похожие работы
... к категории крупносерийных производств. Для них характерны применение поточного метода, максимальные механические производственные процессы и в ряде случаев полная автоматизация производства. 2. Соответствие технологий, которые использует аптека, аккредитационным требованиям За последние годы в области фармации произошли существенные изменения: введена в действие Закон Украины "О л. с " ...
... с помощью биотехнологических процессов, комбинаторной химии, и новые мишени, которые идентифицируются в процессе изучения геномов. Это дает возможность отбирать молекулы, обладающие новыми биологическими и физиологическими свойствами, которые и будут выполнять роль лекарств. Прежде всего, обратимся к медицинской ветви биотехнологии. Рассматривая различные классы соединений, используемые в ...
... . Генно-инженерные технологии позволяют легко увеличивать промышленное производство ферментов. Ферменты находят все более широкое применение как биокатализаторы в фармацевтическом производстве. Биокаталитические технологии. Направленная модификация с помощью методов генной инженерии открывает возможности трансформации структуры ферментов таким образом, что они приобретают качественно новые ...
... 2,0 Смешай. Выдай. Обозначь: По 1 столовой ложке 3 раза в день. Технология лекарственной формы: выписана жидкая лекарственная форма для внутреннего применения, представляющая собой комбинированную систему, состоящую из масляной эмульсии с жирорастворимым лекарственным веществом и суспензии гидрофобного вещества – фенилсалицилата. При отсутствии указания в ...
0 комментариев