Навигация
Полученные данные могут быть теоретически использованы для практических рекомендаций при лечении туберкулеза легких
2. Полученные данные могут быть теоретически использованы для практических рекомендаций при лечении туберкулеза легких.
3. Результаты исследования ассоциации генов HLA II класса с развитием туберкулеза могут быть использованы в качестве дополнительного диагностического критерия при выявлении группы риска по данному заболеванию.
Композиция работы определяется ее целью и задачами и отражает основные этапы исследования.
I. Обзор литературы 1.1 Физиологическая роль главного комплекса гистосовместимости человека
Регуляция иммунного ответа является одной из основных физиологических функций организма. Эта функция принадлежит генам главного комплекса гистосовместимости человека. При этом следует принять во внимание, что само это название отражает скорее историю открытия данной генетической системы, чем ее основную функцию. Дело в том, что история открытия первых продуктов генов главного комплекса гистосовместимости человека, называемых антигенами HLA (от Human leucocyte antigens), связана именно с появлением и развитием трансплантационной иммунологии, когда возникла необходимость подбора тканесовместимых пар донор и реципиент. Сегодня же известно, что роль системы HLA в отторжении трансплантата является лишь одной из частных физиологических функций этой системы, а основная же ее функция - это регуляция иммунного ответа. В 80-х годах даже дискутировался вопрос о переименовании системы HLA в главный комплекс генов иммунного ответа человека, но, учитывая, что старое историческое название давно укоренилось среди исследователей, решено было не менять его [35].
1.1.1 Строение системы HLAПо современным представлениям система HLA, обеспечивая регуляцию иммунного ответа, осуществляет такие важнейшие физиологические функции, как взаимодействие всех иммунокомпетентных клеток организма, распознавание своих и чужеродных, в том числе измененных собственных, клеток, запуск и реализацию иммунного ответа и, в целом, обеспечивает выживание человека как вида в условиях экзогенной и эндогенной агрессии [29].
Все многообразие указанных функций обеспечивается строением главного комплекса гистосовместимости [13].
Система HLA, открытая более 40 лет назад, по-прежнему остается одной из самых сложных, наиболее хорошо изученных и вместе с тем загадочных генетических структур в геноме человека. Так, если еще в 1987 г. расстояние между его условными границами оценивалось в 2000 кб, то на сегодняшний день оно расширено более чем в 2 раза, причем протяженность отдельных его элементов - генных кластеров - колеблется в широких пределах в зависимости от HLA-гаплотипа [23].
Комплекс генов HLA (главного комплекса гистосовместимости человека) компактно расположен на коротком плече 6-й аутосомной хромосомы, занимает 3500 kb (тысяч пар оснований) и содержит более 220 генов.
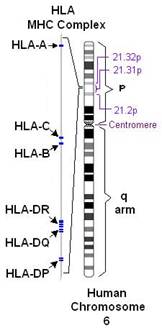
Рисунок 1. Расположение комплекса генов HLA на 6 хромосоме человека.
Гены главного комплекса гистосовместимости человека подразделяются на области A, B, С, D и обозначаются как HLA-А, HLA-В HLA-С и HLA-D, которые достаточно полиморфны и имеют варианты (аллели) и подварианты.
В последние годы в пределах I класса системы HLA открыты новые (неклассические) локусы - E, F, G, H (псевдоген, экспрессируется на уровне РНК), J (псевдоген), для большинства из которых пока не выявлено наличие аллельного полиморфизма и не определены биологические функции. Гены MIC A и MIC B расположены рядом с генами MHC I класса, но отличаются от них экзон-интронной организацией. Молекулы MIC A экспрессируются в основном на фибробластах и эпителиальных клетках. Тем не менее, предполагают, что цепь молекулы MIC A сходна с цепями молекул MHC I класса и способна связывать пептиды и другие короткие лиганды.
Между генами HLA I и II классов расположены гены, кодирующие молекулы III класса. Среди них выделяют суперсемейства C (факторы комплемента, которые вовлечены в процессы элиминации чужеродных антигенов) и G (функции окончательно не выяснены, но предполагается, что продукты экспрессии отдельных генов данного семейства участвуют в процессе созревания лейкоцитов).
На основании исследования главных комплексов гистосовместимости различных видов организмов был сделан вывод о том, что этот генный комплекс расширялся за счет дупликации, что в свою очередь давало определенные преимущества организмам с более полиморфной системой HLA в процессе эволюции. Однако вопрос о том, какие причины привели к подавлению экспрессии ранее функционировавших генов в составе МНС, остается открытым [35].
1.1.2 Характеристика генов и антигенов HLA II класса
Молекулы HLA II класса кодируются генными локусами DR, DP и DQ и имеют распространение преимущественно на макрофагах, В-лимфоцитах, активированных Т-клетках (CD4) и участвуют в гуморальном ответе. HLA-DR кодируется генами на хромосоме 6 в области 6p21.31. HLA-DR часто вовлечен в ассоциации с аутоиммунными болезнями, является протективным или ассоциированным с рядом заболеваний вместе с DQ. В случае инфекции пептид (типа энтеротоксина стафилококка) связывается с молекулой DR и DQ и представляется нескольким из очень многих TCR T-хелпера. Эти лимфоциты тогда связываются с антигенами на поверхности B-клеток, стимулируя быстрое увеличение B-клеток.
Молекулы HLA II класса - это мембранные гликопротеины, состоящие из двух цепей (α и β), каждая из которых содержит по два домена. Цепи молекул II класса очень сходны между собой. На аминокислотном уровне наиболее полиморфными являются внешние альфа-1 и бета-1 домены, которые образуют пептид-связывающую бороздку и отвечают за презентацию антигенов.
Трехмерная структура молекулы II класса была установлена в 1993 году Брауном на основе рентгеноструктурного анализа. Антигенсвязывающую бороздку молекул II класса образуют наиболее экспонированные внешние домены, α-1 и β-1. Дно бороздки сформировано b-складчатой структурой, состоящей из восьми антипараллельных участков, а стенки образованы a-спиралями (рисунок 2). Отличие антигенсвязывающей бороздки молекул II класса от таковой молекул I класса заключается в том, что в молекулах II класса она образована двумя разными цепями. Домены, образующие бороздку, и в особенности первый домен b-цепи, чрезвычайно полиморфны. Области полиморфизма собраны в несколько дискретных гипервариабельных участков (например, в b-цепи HLA-DQ они соответствуют аминокислотным остаткам в положениях 52-58, 70-77, 84-90).
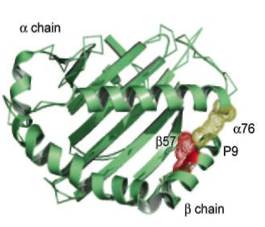
Рисунок 2. Трехмерное строение молекулы HLA II класса
Предполагают, что одни из этих участков расположены в пределах бороздки в положении, оптимальном для связывания антигена, а другие образуют детерминанты, вовлекаемые во взаимодействие с Т-клеточными рецепторами. В частности, было показано, что некоторые аминокислотные замены в полиморфных участках молекул HLA могут влиять на структурные изменения, значимые для образования "карманов", в которых связываются определенные презентируемые пептиды. Эти изменения могут даже полностью нарушать правильное связывание конкретного пептида, препятствуя его успешной презентации, а также влиять на корректное физиологическое распознавание комплекса "пептид-молекула HLA" Т-клетками. На основании полученных данных предположено, что стабильное взаимодействие молекул MHC II класса с пептидами зависит также и от плотности сети водородных связей между аминокислотными остатками альфа-спиралей молекулы MHC и связываемым пептидом. С другой стороны, установлено, что с CD4-рецепторами могут взаимодействовать и неполиморфные участки вторых доменов молекулы HLA (в данном случае HLA-DR). Таким образом, структура генов и молекул HLA обусловлена их биологическим предназначением [36].
Первичная функция HLA-II класса - представление чужеродного антигена иммунной системе для образования или подавления ответа Th, что, в конечном счете, ведет к производству антител против того же самого антигенного пептида. HLA DR найден на АПК (макрофаги, B-клетки и дендритные клетки). На поверхности клеток во время возбуждения увеличивается число антигенов DR, поэтому он является также маркером для иммунного возбуждения.
Существует чрезвычайно высокий уровень аллельного разнообразия в HLA DRB1, он стоит на втором месте после HLA-B. Эти 2 полиморфные области определяют все разнообразие последовательностей HLA в пределах человеческого генома. Это означает, что HLA-DRB1 развивается намного быстрее, чем все другие геномные локусы. Большая часть разновидностей в HLA DRB1 происходит в положениях контакта пептида в кармане, в результате многие из аллелей изменяют способ, которым DR связывает лиганды пептида и изменяет репертуар, который каждый рецептор может связать. Это свидетельствует о большом количестве изменений функционирующих в природе, и поэтому находится под действием отбора. В HLA области гены находятся в гетерозиготном состоянии или под давлением отбора, хотя некоторые аллели, возможно, находятся под положительным или отрицательным отбором.
HLA-DR и DQ локусы, вероятно, связаны с самым большим числом различных болезней относительно любых других локусов. Это происходит из-за сложной природы резистентности и высокого полиморфизма в этих локусах. Большинство этих болезней имеет низкую частоту, некоторые, подобно диабету 1 типа и целиакии являются редкими, но не исключениями.
Поскольку аллели DR находятся в неравновесном сцеплении с HLA-DQ локусами, отдельные изучения часто не могут определить точную ассоциацию с болезнью. В таких случаях используют трехлокусный гаплотип DR-DQA-DQB.
1.1.3 Многообразие функций системы HLAПомимо того, что система HLA осуществляет регуляцию иммунного ответа на его начальных и продуктивных этапах, она также обеспечивает и такой "терминальный" этап регуляции, как апоптоз различных типов антиген-презентирующих клеток. При этом следует отметить, что этот эффект касается как профессиональных антиген-презентирующих клеток (макрофаги и CD34+-клетки, дифференцировавшиеся из моноцитов в культуре клеток, и дендритные клетки), так и В-лимфоцитов.
Так, коллективом исследователей, работающих под руководством проф. D. Сharron, в самые последние годы было установлено, что блокирующее воздействие моноклонального антитела L243 на молекулы HLA-DR, экспрессированные на различных типах антиген-презентирующих клеток, блокирует их апоптоз, определяемый с помощью FITC-меченного аннексина V. Во всех указанных клетках после блокировки молекул DR отмечалось значительное снижение апоптоза. Авторы считают, что регуляция апоптоза дифференцирующихся антиген-представляющих клеток осуществляется через молекулы HLA-DR, и это может явиться решающим механизмом для ограничения их жизни.
Данные в целом свидетельствуют в пользу ключевой физиологической роли молекул HLA-DR в регуляции апоптоза всех типов антиген-презентующих клеток. Последнее, по сути, является регуляцией одного из важнейших этапов развития иммунного ответа и ещё раз свидетельствует в пользу того, что при современном уровне знаний о физиологической роли генов HLA-DR, можно считать, что именно в действительности являются генами иммунного ответа человека.
Генам главного комплекса гистосовместимости принадлежит ещё ряд важнейших физиологических функций. Описанию одной из них (генетическому контролю качества иммунного ответа) была посвящена работа, опубликованная в Российском физиологическом журнале им. И.М. Сеченова. Речь идет об ассоциированном с системой HLA контроле активности различных субпопуляций иммунокомпетентных клеток, что в свою очередь существенным образом сказывается на конечном уровне, т.е. на качестве иммунного ответа человека. При этом, естественно, следует помнить, что эта функция является "вторичной" и реализуется только в случае, если организм человека генетически способен отвечать на данный агент. Предпосылкой развития данного направления можно считать предположение, выдвинутое W. Bodmer и J. Bodmer еще в 1978 г., о том, что на формирование HLA-профиля европеоидной популяции в значительной степени оказали влияние имевшие место в средние века эпидемии таких заболеваний, как чума, оспа, холера и т.д. В результате этого среди выживших оказался значительный процент людей с определенными HLA-генотипами, в первую очередь с генотипом HLA-A1, - В8, - DR3. Этот генотип, как предположил W. Bodmer, обеспечивает более высокую резистентность к инфекционным заболеваниям и является на сегодняшний день генетическим маркером европеоидной популяции. Следует отметить, что это предположение было подтверждено на примере недавних вспышек брюшного тифа в Суринаме, когда среди выживших европеоидов значительный процент составили лица с гаплотипом HLA-A1, - В8, - DR3. Одновременно с этим W. Bodmer высказал справедливое предположение, что реализация этого эффекта могла быть связана только с ассоциациями между конкретными HLA-специфичностями и HLA-гаплотипами и иммунным ответом. Учитывая тот факт, что с одними и теми же гаплотипами HLA оказалась связана устойчивость к самым различным инфекционным агентам, логично было предположить, что подобного рода ассоциация с HLA может быть связана не только с самой генетически обусловленной отвечаемостью к конкретному инфекционному агенту, но и с теми звеньями иммунного ответа, которые принимают участие в его реализации, т.е. в конечном эффекте. Именно это в настоящее время и подразумевается под качеством иммунного ответа. И именно под таким названием в программу последнего рабочего совещания и конференции по HLA вошло новое отдельное направление изучения физиологической функции HLA. Следует отметить, что в данном направлении исследований отечественные иммунологи имеют несомненный приоритет, хотя само это направление ранее именовалось как исследование ассоциации между HLA и иммунным статусом человека [2].
К настоящему времени достаточно хорошо известно, что между отдельными HLA-специфичностями и HLA-гаплотипами существуют положительные и отрицательные ассоциации с теми или иными показателями иммунного статуса, такими как количество и функциональная активность клеток СD4+, CD8+, EKK, фагоцитирующей функцией нейтрофилов и т.д.
Отдельно следует отметить, что, как стало известно в самое последнее время, главному комплексу гистосовместимости принадлежит существенная роль в регуляции активности популяции клеток, стоящих "на грани" между факторами, определяющими специфический и неспецифический иммунитет. Это так называемые естественные клетки-киллеры (ЕКК).
Данной популяции клеток, как известно, принадлежит весьма существенная роль в обеспечении противоинфекционной, в первую очередь противовирусной защиты организма. Они также несут ответственность и за обеспечение элиминации из организма мутирующих, в том числе раковых клеток, которые распознаются ЕКК по отсутствию или даже снижению на их поверхности МНС-антигенов. При этом следует отметить, что роль в запуске активности ЕКК играет не только уровень экспрессии, но и их специфичность. Существуют данные о том, что в организме имеет место своего рода "приспособление" популяции ЕКК к HLA-генотипу. Это приспособление происходит в процессе дифференцировки ЕКК, когда из их популяции элиминируются клетки, рецепторы которых не связываются с антигенами HLA, входящими в генотип организма. Таким образом, исключается возможность повреждения собственных "нормальных" клеток, и активность ЕКК реализуется по отношению к клеткам с потерянной или ослабленной способностью экспрессии антигенов HLA.
Одной из важнейших физиологических функций системы HLA, которая, впрочем, довольно тесно связана и с ее основной (или, возможно, более известной) функцией - контролем иммунного ответа, является ее участие в репродукции человека. Одним из наиболее демонстративных проявлений является роль HLA-совместимости супругов в репродукции.
У человека система HLA создает условия, препятствующие появлению HLA-гомозиготного потомства, и, хотя медицинские мероприятия в ряде случае могут "преодолеть противодействие", в ряде случаев HLA-гомозиготные индивидуумы имеют повышенный риск развития целого ряда патологий.
Также гены главного комплекса гистосовместимости человека играют очень важную роль при пересадке тканей. Шансы на совместимость органа, пересаживаемого от родителя к ребёнку, составляет пятьдесят процентов. Когда органы пересаживаются между братьями и сестрами, вероятность, что антигены окажутся в основной массе одинаковыми, составляет двадцать пять процентов. Трансплантации между HLA-совместимыми братьями и сестрами или родителями и детьми даёт результаты столь же хорошие, как и при пересадке между однояйцевыми близнецами, то есть сто процентов [22].
Полученные данные совпадают с концепцией о том, что система HLA человека как наиболее полиморфная из генетических систем человека играет ведущую роль в обеспечении высокого уровня полиморфизма генома человека в целом.
Разумеется, при этом остается открытым вопрос, может ли система HLA в какой-то степени принимать участие в "предварительном", т.е. до супружества, выборе HLA-идентичных партнеров?
Использование молекулярных методов HLA-генотипирования, позволяющих исследовать HLA-полиморфизм на недоступном ранее уровне и выявлять HLA-гомозиготы без осуществления семейного типирования, возможно, даст ответ на этот вопрос, так как ранее выполненные работы, основанные на серологическом типировании HLA-DR, не смогли дать в этом отношении убедительных результатов.
1.1.4 Роль HLA в реализации иммунного ответа
Представления о строении системы HLA развивались и развиваются в течение всего периода ее изучения, однако, за последние годы произошел качественный скачок в развитии этой проблемы. Раньше, когда основным объектом исследования могли служить только белки-антигены HLA, представления о комплексе генов HLA могли формироваться в основном на анализе косвенных данных. Эти данные включали изучение антигенов HLA в популяциях, в семейном анализе, реакциях, субстратом которых были антигены HLA, и т.д. Теперь благодаря развитию молекулярной генетики и иммунохимии появилась возможность не только проводить тонкий анализ антигенов HLA, но и изучить сами гены HLA. Особенный прогресс в этом направлении произошел после открытия и внедрения в исследования в области изучения системы HLA метода полимеразной цепной реакции (ПЦР), позволяющего анализировать необходимые для исследований участки ДНК, что в свою очередь открывало широкие возможности для быстрого и точного анализа молекулярного полиморфизма HLA [31].
Внедрение в исследования системы HLA молекулярно-генетических методов не только позволило конкретизировать представления о системе HLA, но и значительно расширило представления о ее полиморфизме, что дало возможность более тщательного изучения ее функции. При этом были открыты многие новые аллели классов I, II и III, и общее количество только известных специфичностей HLA классов I и II увеличилось более чем в 6 раз.
В последнее время обнаружено, что антигены MIC-A, расположенные в непосредственной близости от HLA-B, участвуют в активации взаимодействия TcR-молекулы МНС в развитии Т-клеточно-опосредованной цитотоксичности и активности НК-клеток, тем самым, в частности, играя роль в обеспечении противоракового иммунитета.
В классе II основными локусами HLA являются DR, DQ и DP, а также открытые в более позднее время DM, LMP и ТАР. Три последних локуса обеспечивают такие важнейшие функции, как процессинг и экспрессия антигенов HLA на поверхности клеток. Класс III включает в себя гены, кодирующие факторы комплемента, фактор некроза опухолей и некоторые другие.
Физиологическая функция аллелей и кодируемых ими антигенов HLA, относящихся к различным классам HLA, в значительной степени различается. Так, антигены HLA классов I и II принимают участие во взаимодействии между иммунокомпетентными клетками в процессе иммунного ответа. Но антигенам класса I принадлежит также и физиологическая функция обеспечения взаимодействия между всеми другими ядросодержащими клетками организма, вплоть до взаимодействия нейрон-синапс. Тем самым с помощью системы HLA обеспечивается целостное функционирование не только иммунной системы человека, но и организма в целом [30].
Что касается обеспечения развития самого иммунного ответа, то роль антигенов системы HLA здесь первостепенна. Дело в том, что именно молекулы антигенов HLA обеспечивают презентацию, то есть представление иммунодоминантных пептидов, являющихся продуктом внутриклеточного протеолиза чужеродных антигенов, против которых и будет индуцирован, а затем и разовьётся иммунный ответ [19]. Этой функции антигенов системы HLA способствует само строение её молекул, которое, несмотря на выраженное различие в структуре строения молекулы антигенов HLA классов I и II, позволяет образовать на внешнем её конце так называемую пептид-связывающую бороздку, в которой и удерживается представляемый для распознавания пептид.
На рисунке 3 показана принципиальная схема представления пептидов антигенами HLA класса I (справа) и класса II (слева).
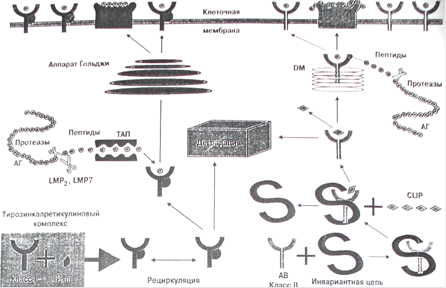
Рисунок 3. Схема представления пептидов молекулами HLA.
Общим для антигенов классов I и II является следующее. Антиген-представляющая клетка осуществляет свое специфическое взаимодействие, представляя пептид в контексте собственной HLA-молекулы, идентичной таковой на клетке, воспринимающей информацию. Именно за открытие этого феномена, названного феноменом двойного распознавания, Цинкернагель и Догерти получили Нобелевскую премию. Действительно, этот феномен явился ключевым моментом в понимании основ физиологической регуляции иммунного ответа. В то же время на рисунке 3 видны и существенные различия между взаимодействием, обеспечиваемым в процессе иммунного ответа антигенами HLA классов I и II. Во-первых, антигены HLA класса II обеспечивают взаимодействие антиген-презентирующей клетки с Т-хелпером, а антигены HLA класса I - с Т-эффектором/киллером. Во-вторых, помогают им в этом различные молекулы ко-рецепторы - CD4 для Т-хелперов и CD8 для Т-киллеров. Естественно, что различным явится и эффект этого взаимодействия. Так, распознавание пептидов в контексте молекулы HLA класса II ведет к формированию популяции Тh1 - и Тh2-клеток, одни из которых индуцируют развитие гуморального иммунного ответа, а другие явятся необходимым компонентом в индукции Т-киллеров. Что же касается антигенов гистосовместимости класса I, то Т-киллер, индуцированный против иммунодоминантного пептида, экспрессированного на поверхности клеток-мишеней в контексте антигенов HLA класса I, идентичного таковым, экспрессированным на Т-киллере, уничтожит их. Следует еще раз подчеркнуть, что оба эти важнейших звена "нормального", т.е. физиологического, иммунного ответа строго ограничены HLA-набором каждого конкретного человека.
Большое значение для формирования современных представлений о физиологической роли антигенов HLA имело установление роли "новых" генов HLA DM, LMP (large multifunctional protease) и ТАР. Это в свою очередь позволило конкретизировать представление о реализации функции антигенов HLA. Их функция хорошо видна на рисунке 4.
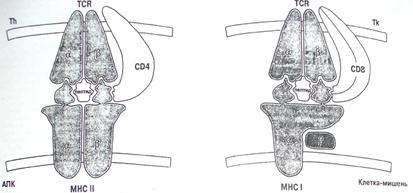
Рисунок 4. Распознавание комплекса антигенного пептида с молекулами МНС I и II класса рецептором и корецептором Т-лимфоцита.
Молекулы МНС класса I синтезируются в цитозоле клетки, где до появления соответствующего пептида находятся в связи с так называемым тирозин-калретикулиновым комплексом. После связывания с пептидом происходят высвобождение и транспорт молекул HLA на поверхность клеток с участием кодируемых МНС "пептидных насосов" ТАР (от транспортеров, ассоциированных с антигенным процессингом). Функция данных молекул состоит в целом в регуляции размера и специфичности пептидов путем приведения их в "соответствие" со связывающими сайтами молекул МНС класса I.
В отличие от молекулы класса I цепи молекулы МНС класса II синтезируются в эндоплазматическом ретикулуме, откуда после их временного соединения с третьей инвариантной цепью они транспортируются в эндоцитарный компартмент, где они или встречаются и затем связываются с пептидом, или же (если этого не произошло) деградируют в лизосомах. После связи с пептидом, заменяющим инвариантную цепь, молекулы МНС класса II переходят на клеточную мембрану. Вытеснение пептидом инвариантной цепи молекул HLA класса II обеспечивают белки, кодируемые также системой HLA и названные HLA-DM. Эти белки катализируют замену "временного" пептида инвариантной цепи на специфический пептид. Роль антигенов HLA-DM является решающей в презентации экзогенных пептидов молекулами класса II.
В целом следует отметить, что хотя данные о "новых" системах HLA LMP, ТАР и DM являются еще далеко окончательными, уже сейчас ясно, что они выполняют в иммунном ответе важнейшую роль, обеспечивая физиологическую презентацию процессированных пептидов для дальнейшего иммунного ответа.
По-видимому, с нарушениями их функций связаны некоторые формы иммунодефицитных состояний человека, в которых лежит потеря возможности экспрессии HLA на иммунокомпетентных клетках.
Потеря способности к экспрессии молекул HLA на мембранах клеток является также одним из основных патогенетических звеньев развития онкологических заболеваний.
В целом связь между молекулами HLA и пептидами имеет много общего для антигенов HLA классов I и II. Однако и здесь имеются серьезные отличия.
Так, пептид удерживается в связывающей складке молекулы HLA класса I как за счёт связи его N - и С-концов с определённым мотивом "аллель-специфического" участка МНС, так и за счет связи боковых цепей пептида боковыми карманами молекулы МНС. Длины пептидов, связывающихся с молекулой HLA класса I, - 8-10 аминокислот.
Пептиды, связывающиеся с молекулой HLA класса II, более гетерогенны - 9-25 аминокислот. Связывающая бороздка молекул HLA класса II в отличие от класса I "открыта" для связывания с двух сторон, что создает возможность большего полиморфизма в связях HLA + пептид. Более того, в молекуле класса II зоны связывания могут выходить даже за связывающую складку. Всё это даёт возможность "аккомодации" более широкого спектра пептидов к молекулам HLA класса II по сравнению с таковыми класса I.
Переход исследований HLA на молекулярно-генетический уровень позволил по-новому взглянуть на физиологическую функцию системы HLA. Так, молекулы МНС приобретают стабильную форму и соответствующую трехмерную конфигурацию только после того, как в связывающий сайт ее складки встраивается пептид. Только после этого молекула МНС способна мигрировать на поверхность клетки, где она готова выполнить свои функции. Удаление пептида из пептид-связывающей структуры МНС экспрессированной на клеточной мембране, нарушает ее трехмерную конфигурацию лишая возможности функционировать, и ведет к распаду. Комплекс МНС + пептид является чрезвычайно стабильным, очищается и кристаллизуется в единой структуре. Этот комплекс остается на поверхности клетки в течение нескольких недель, что позволяет многим "проходящим" Т-клеткам сканировать представляемый собственной молекулой МНС пептид. Наконец, каждый пептид связывается (и удерживается в складке) с инвариантным участком характерным для каждого из аллелей молекулы МНС и имеющим определенный мотив аминокислотных остатков, участвующий в таком связывании. Таким образом, в связь с конкретным пептидом вовлекаются конкретные же участки антигенов - аллельные варианты молекул МНС, что, по сути, и является основой генетического контроля иммунного ответа. Это положение хорошо иллюстрирует данные о том, что пептид вируса герпеса связывается с гаплотипом HLA DQA1 0501/DQB1 0201, но не HLA DQA1 0201/DQB1 0201. Различие между ними в цепи DQA1 составляет 15 аминокислотных остатков.
Установление этого факта и имеющаяся в настоящее время возможность анализировать аминокислотные последовательности всех аллельных вариантов антигенов HLA, включая участки, определяющие их специфичность, а также структуру пептидов, определяющих специфичность различных чужеродных агентов, включая болезнетворные, позволяет заранее предсказать соответствие тех или иных иммунодоминантных пептидов тем или иным участкам молекулы МНС. Таким образом, можно заранее предсказать генетический ответ или его отсутствие на тот или иной агент.
В свою очередь это даст возможность не только заранее решить вопрос о том, ответит ли данный индивидуум на вакцинацию против того или иного болезнетворного агента, но и предсказать, насколько этот ответ будет физиологичен. Следовательно, позволит прогнозировать возможность развития ряда заболеваний аутоиммунного генеза (например, ревматоидный артрит и инсулин-зависимый сахарный диабет), в генезе которых, возможно, лежит также комплементарность иммунодоминантных пептидов инфекционных агентов конкретным эпитопам аллелей HLA.
1.1.5 Полиморфизм системы HLA и ее этнические различияБлагодаря такому важнейшему свойству системы HLA, как её экстремальный полиморфизм, стала возможна взаимная комплементарность иммунодоминантных сайтов молекул огромного числа различных инфекционных возбудителей и конкретных антигенов гистосовместимости. В свою очередь это явилось эффективным средством сохранения человека как вида в условиях постоянно изменяющегося генетического разнообразия микробного окружения [38].
Таким образом, экстремальный аллельный полиморфизм системы HLA является "мощным механизмом вариабельности и естественного отбора" человека как вида и позволяет ему противостоять постоянно эволюционирующему множеству патогенов. Доказательством этому в историческом плане может служить почти полное вымирание целых народов (в частности, американских индейцев в период открытия Америки), обладающих весьма низким по сравнению с другими этническими группами полиморфизмом системы HLA.
В последние годы стало известно, что полиморфизм системы HLA помимо ранее установленного межрасового и межэтнического различия имеет также и внутриэтнические различия. Эти различия были выявлены при переходе на использование методов молекулярно-генетического HLA-типирования, которое позволяет определять более 2000 аллельных вариантов генов HLA, в то время как типирование, осуществляемое на уровне продуктов генов HLA - антигенов HLA, позволяло выявить всего лишь около 200 специфичностей. Следует также отметить, что молекулярно-генетический уровень генотипирования позволяет сегодня вплотную приблизиться к пониманию генетически обусловленной филологической резистентности человека к определенным заболеваниям на популяционном уровне.
В таблице 1 (приложение) представлены данные по исследованию частоты встречаемости аллельных вариантов гена HLA DRB1*04 в 7 популяционных группах России. Выбор для анализа аллельных вариантов именно данного гена связан с тем, что с отдельными его аллелями HLA DRBl*040l, HLA DRB1*0404 и HLA DRB1*0405 ассоциирована предрасположенность к такому аутоиммунному заболеванию, как инсулин-зависимый сахарный диабет (ИЗСД). В то же время с HLA DRB1*0403 ассоциирована устойчивость к развитию заболеваний. Из представленных в таблице данных видно, что во всех популяциях, за исключением ненцев, высока частота аллеля HLA DRB1*0401, но в 3 из популяций (саамы, тувинцы, ненцы) в отличие от других популяций высока и частота аллеля-протектора (8,38; 5,35 и 7,16 соответственно). И именно в этих популяциях практически отсутствует заболеваемость ИЗСД. Аналогичная ситуация имеет место и в отношении 2 других аллелей - *0404 и *0405; частота первого из них является достаточно высокой у саамов и ненцев (5,33 и 10,14 соответственно), а частота аллеля *0405 повышена у тувинцев (5,75). Таким образом, протективный эффект является превалирующим по отношению к предрасполагающему [3].
Эта же таблица служит наглядным доказательством внутриэтнических различий по распределению аллелей HLA. Так, внутри русской популяции между москвичами и жителями Архангельской области имеются выраженные различия по аллелям HLA DRB1*0401 и *0404. Причем оба аллеля имеют выраженную ассоциацию с предрасположенностью к ИЗСД, частота которого достаточно высока в обеих указанных группах.
Таким образом, ясно, что полиморфизм системы HLA, характерный для каждой конкретной группы населения, оказывает существенное или даже определяющее влияние на биологическую стабильность данной группы.
В последние годы удалось показать, что ассоциированные с HLA показатели иммунного статуса могут различаться в разных этнических группах. Примером этого может быть исследование ассоциаций между отдельными параметрами иммунного статуса и HLA-специфичностями в двух этнических группах - русские (кавказоиды), буряты (ориенты). Данные приведены в таблице 2 (приложения).
Анализ этих данных свидетельствует о целесообразности дальнейшего межэтнического подхода к изучению ассоциированного с HLA качества иммунного ответа. Исследование данной физиологической функции системы HLA, несмотря на то, что оно стало развиваться относительно недавно, является весьма перспективным как в фундаментальном аспекте - в плане установления молекулярных механизмов указанных ассоциаций, так и в практическом, поскольку это направление имеет значение в плане прогноза возможности неблагоприятных воздействий (в том числе техногенных) окружающей среды на представителей различных этнических групп [25].
1.2 Механизмы ассоциации HLA с заболеваниями
Исключительный полиморфизм HLA наводит на мысль о существовании ее как своеобразного механизма защиты от агентов чужеродного, в том числе микробного и вирусного происхождения. Вот почему так интенсивно ведется поиск ассоциаций между HLA-антигенами и болезнями. Ранее были сформулированы гипотезы, объясняющие механизмы возможных ассоциаций HLA-антигенов с заболеваниями: молекулярная мимикрия, рецепторная, модификации вирусами HLA-антигенов, а также связи HLA с другими генами, в частности с генами иммунного ответа. Суть этих гипотез в следующем [10].
Согласно рецепторной теории HLA-антигены могут быть своеобразными рецепторами для патогенных вирусов, на которых они могут фиксироваться и повреждать клетку. Однако многие ученые предполагают, что под генетическим контролем могут находиться различные этапы взаимодействия вируса с клеткой, начиная от проникновения вируса в клетку и его репликацией и заканчивая трансформацией клетки под влиянием вирусного генома.
Некоторые вирусы (например, вирус кори) могут вызывать заболевание практически у любого человека. Эти данные указывают на то, что антигены системы HLA не являются рецепторами для вирусов.
Согласно теории мимикрии, микроорганизмы в процессе эволюции приобретают в структуре своих оболочек детерминанты, сходные с тканевыми антигенами человека. Это ведет к снижению иммунного ответа макроорганизма на тот или иной микроб или вирус, в результате чего они могут беспрепятственно проникать внутрь организма и вызывать патогенное действие.
Если придерживаться теории мимикрии, то можно ожидать доминантного характера наследования генов, ответственных за восприимчивость к болезни. Семейные исследования заболеваний в большинстве случаев подтверждают это. Однако по ряду заболеваний получены другие результаты.
Ученые, придерживающиеся теории модификации антигенов HLA вирусами, предполагают, что вирус при определенных условиях способен модифицировать антигены системы HLA. Это может иметь место при включении вирусного генома на уровне гена HLA или при его действии на РНК. Отмеченное явление может происходить лишь при избирательной локализации вируса в тканях, например, вируса гепатита B в печени. Эту гипотезу пока нельзя отвергнуть, но и доказать не представляется возможным.
Исследованиями, проведенными на мышах, показано, что гены Н-2 системы сцеплены с генами так называемого иммунного ответа - Ir. Гены этой области контролируют способность индивидуума к развитию иммунного ответа на различные искусственные и естественные антигены, причем этот ответ четко коррелировал с Н-2 гаплотипами. Линии мышей с гаплотипом Н-2b оказались способными давать сильный иммунный ответ на искусственный полипептид, а с гаплотипом Н-2k низкий ответ
В связи с полученными данными возникает вопрос, детерминируют ли иммунный ответ сами гены Н-2 или этот зависит от других генов, тесно сцепленных с ними. По мнению J. van Rood именно гены иммунного ответа являются как бы биологическим эквивалентом специфических вакцин.
Можно полагать, что индивидуумы, у которых отсутствуют гены, определяющие резистентность к какому-либо заболеванию, окажутся восприимчивы к нему, и наоборот. Данные, полученные на животных, можно перенести на человека лишь по аналогии, поскольку пока у людей гены иммунного ответа не обнаружены. Правда, имеются свидетельства об их присутствии в организме человека.
Таким образом, приходится констатировать, что ни одна из рассматриваемых теорий не может в полной мере объяснить связь HLA-антигенов с различными заболеваниями. Но есть вероятность, что каждая из предложенных гипотез, вносит свой вклад в восприимчивость к инфекционным заболеваниям.
1.3 Общее представление о туберкулезе и его ассоциация с различными генетическими факторамиТуберкулез или "Белая чума" был преобладающей проблемой здравоохранения в Европе и Америке в 18-м, 19-м и начале 20-го столетия. Значительные усилия были потрачены на решение этой проблемы. С появлением эффективной антибиотикотерапии в 50-х годах 20-го столетия, распространенность заболевания и интерес к нему резко упали. С конца 80-х, однако, начался всплеск заболеваемости туберкулезом в развитых странах наравне с развивающимися странами Восточной Европы, что послужило возрождению исследований туберкулеза и его возбудителя. Многие из вопросов прошлого теперь решаются на молекулярном уровне [8].
Один из основных вопросов, который занимал раньше исследователей, это взаимодействие микобактерий и защитных факторов организма, от которого зависит, будет ли человек заражен и разовьется ли у него туберкулез. Обсуждение причин туберкулеза уходит корнями в древнюю Грецию и Рим. В то время было составлено три различных объяснения заболеванию: наследственные факторы, инфекционный компонент и плохие условия окружающей среды. Гиппократ отдавал предпочтение наследственным факторам, Аристотель и Гален - инфекционному компоненту. Поскольку болезнь была больше распространена среди городской бедноты в быстро растущих городах недавно индустриализованной Европы, социальные реформаторы того времени связывали туберкулез с плохими условиями жизни рабочего класса и отвергали контагеозное объяснение. Хотя в последнее время и отдается предпочтение генетическому компоненту, в действительности же все три объяснения правильны и взаимосвязаны.
В 1882 году Кохом были открыты туберкулезные бациллы, что опровергло теории наследственного возникновения болезни или вследствие нездорового образа жизни низших слоев. Но некоторые аспекты эпидемиологии туберкулеза так и не были объяснены, так как выяснилось, что есть индивидуальные различия в восприимчивости: не все, подвергшиеся атаке микобактерий становятся инфицированными; даже когда инфекция может быть продемонстрирована с помощью положительной туберкулиновой пробы, приблизительно у одного из десяти зараженных людей развиваются симптомы болезни; течение болезни изменяется у различных людей (до антибиотикотерапии некоторые умирали от "скоротечного туберкулеза", в то время как другие выздоравливали или жили относительно долго с признаками хронического туберкулеза; у некоторых же болезнь развивалась лишь спустя годы после инфицирования). Без лечения туберкулез является фатальным для половины пациентов, у которых развились симптомы [16].
Поскольку туберкулез больше распространен в отдельных семьях и расовых или этнических группах, наследственная теория восприимчивости была наиболее вероятна, но требовала экспериментальных доказательств и имела трудности в устранении влияния компонента окружающей среды. В 1912 году статистик Карл Пирсон, пытаясь продемонстрировать расовые различия в восприимчивости к туберкулезу, задался вопросом о том, имеют ли люди, живущие в одинаковых условиях одинаковый шанс развития туберкулеза вне зависимости от их расы.
В наше время туберкулез является проблемой мирового масштаба. По данным Всемирной организации здравоохранения на 2008 год более двух миллиардов человек, то есть приблизительно треть населения Земли, инфицирована микобактериями. 1,7 миллионов человек умерла от туберкулеза в 2006 году, из которых 231 000 ВИЧ-инфицированных. Это приблизительно 4500 смертей ежедневно. В 2006 году было зарегистрировано 9,2 миллиона новых случаев туберкулеза, включая 709 000 среди ВИЧ-инфицированных [44].
В России ежегодно инфицируется более 9 тыс. детей (что на порядок выше, чем в других развитых странах), а число больных в 1997 г. по сравнению с 1991 г. выросло в 2,5 раза [12].
1.3.1 Иммунный ответ при туберкулезеКлинические признаки туберкулеза проявляются только у 10% инфицированных. В настоящее время стало понятно, что развитие инфекции М. tuberculosis и клинический туберкулез обусловлены сложным взаимодействием между биологическими свойствами самого инфекционного агента, средовыми факторами и физиологической индивидуальностью человека [33].
У большинства людей сразу же после инфицирования микобактериями развивается эффективный иммунный ответ, ограничивающий распространение агента. Менее 10% инфицированных, у которых развивается заболевание, имеют идентифицируемые факторы риска, такие как диабет, СПИД, пожилой возраст и т.д. У остальных заболевших развитие туберкулёза, по-видимому, обусловлено комплексным взаимодействием генетических и средовых факторов [15].
Основная протективная роль в иммунном ответе, направленном против внутриклеточных микобактерий туберкулеза принадлежит клеточным механизмам. Способность микобактерий переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации их из организма необходим специфический клеточно-опосредованный ответ. Специфичность его определяется антиген-распознающими CD8+ Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов [1].
Решающий момент специфического иммунного ответа - это ответ CD4 - T-лимфоцитов хелперов на распознавание антигена. На этом этапе определяется форма иммунного ответа: с преобладанием антител (гуморального) или с преобладание клеточных реакций (гиперчувствительности замедленного типа). Направление дифференцировки CD4 лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии интерлейкина-12 и ИФ-γ CD4-лимфоциты дифференцируются в воспалительные Th1-клетки, начинают продуцировать и секретировать ИЛ-2, ИФ-γ, ТНФ, и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а ИФ-γ - естественными киллерами, активированными в раннюю фазу на внутриклеточно паразитирующие микобактерии [4].
В течение 2-8 недель после первичного инфицирования, пока микобактерии продолжают размножаться внутри макрофагов, в организме человека развивается опосредованная Т-клетками ГЗТ. Иммунокомпетентные лимфоциты поступают в зону проникновения возбудителя, где они секретируют такие хемотаксические факторы, как интерлейкины и лимфокины. В ответ на это сюда же мигрируют моноциты и трансформируются в макрофаги, а затем - в гистиоцитарные клетки (макрофаги in situ), позднее организующиеся в гранулёмы [9]. Микобактерии могут персистировать в макрофагах многие годы, несмотря на усиленный синтез лизоцима этими клетками, однако дальнейшее размножение и распространение первичной инфекции ограничивается именно фагоцитозом.
0 комментариев