Навигация
Раза в неделю длительно
После внутривенного введения препарата следует ввести (не вынимая иглы) небольшое количество 5% раствора глюкозы (для промывания иглы).
Форма выпуска: капсулы по 0,14 г (№100); лиофилизированный порошок для инъекционных растворов во флаконах по 0,3 г.
Хранение: список Б. при температуре не выше + 250 C.
Гестонорона капронат (Gestonorone caproate)
Синоним: Депостат
Способ применения и дозы: вводят внутримышечно по 0,2 - 0,4 г (200 - 400 мг) 1 раз в неделю. Перед введением раствор подогревают в ампуле до температуры тела. При лечении мужчин рекомендуется 2 - 3 месячный курс, при возобновлении симптомов курс повторяют. Женщинам препарат вводят длительно.
Форма выпуска: 10% раствор в масле (с добавлением бензилбензоата) в ампулах по 2 мл (0,2 г).
Хранение: список Б.
Медроксипрогестерон (Medroxyprogesteronum)
Синонимы: Вераплекс, Депо-Провера, МПА, Провера, Фарлутал, Циклотал.
Способ применения и дозы: применяют внутрь, внутримышечно и в виде аэрозоля.
Форма выпуска: таблетки по 0,005; 0,01; 0,1; 0,25 и 0,5 г (5, 10, 100, 250 и 500 мг); гранулы по 0,2; 0,5 и 1 г; 15% суспензия для инъекций во флаконах по 1; 3,3 и 6,7 мл и в одноразовых шприцах по 1 мл и 20% - во флаконах по 2,5 и 5 мл; дозируемый аэрозоль.
Хранение: список Б.
Тамоксифен (Tamoxifenum)
Синонимы: Билем, Зитазониум, Интам, Йеноксифен, Новофен, Нолвадекс, тамифен, Тамоксен, Тамоксифенбене, Тамофен, Цемид.
Способ применения и дозы: при раке эндометрия и молочной железы применяют внутрь в виде таблеток по 0,01 г (10 мг) 2 раза в день или по 0,02 - 0,03 г 1 раз в день. При раке почки можно увеличить дозу до 0,1 г в сутки. При ановуляторном бесплодии назначают по 0,01 г 2 раза в день в течение 4 дней подряд, начиная со 2-го дня менструального цикла (при последующих 4-дневных циклах дозу иногда увеличивают до 0,02 - 0,04 г 2 раза в день).
Форма выпуска: таблетки по 0,01 и 0,02 г (№ 10, 20, 30, 60, 100) и 0,03 и 0,04 г (№10, 30).
Хранение: список Б.
Торемифен (Toremifene)
Синоним: Фарестон
Способ применения и дозы: обычная доза 0,06г (60 мг) ежедневно, при необходимости - до 0,24 г (240 мг) в день (2 раза по 0,12 г). В больших дозах иногда успешно применяется при недостаточности эффективности гормональных и цитостатических препаратов.
Форма выпуска: таблетки по 0,02 г (№30, 100) и 0,06 (№60).
Хранение: список Б.
Флутамид (Flutamide)
Синонимы: Нифтолид, Флулем, Флутакан, Флутаплекс, Флуцином, Фругил.
Способ применения и дозы: назначают внутрь по 0,25 г (1 таблетка) 3 раза в день. Лечение проводят длительно (в зависимости от течения заболевания).
Форма выпуска: таблетки по 0,25 г (№ 21, 84, 90, 100).
Хранение: список Б.
Ципротерон (Cyproterone)
Синонимы: Андрокур, Ципроплекс
Способ применения и дозы: применяют внутрь в виде таблеток после еды, запивая жидкостью. Начальная доза для мужчин 0,05 г 2 раза в день; при необходимости ее увеличивают до 0,1 г 2 - 3 раза в день. Женщинам назначают по 0,05 г 2 раза в день; детям - по 0,025 - 0,05 г 2 раза в день.
Форма выпуска: таблетки по 0,01 г (№ 15) и 0,05 г (№15, 20, 50); 10% раствор в масле в ампулах по 3 мл.
Хранение: список Б.
Финастерид (Finasteride)
Синонимы: Проскар, Финаст.
Способ применения и дозы: назначают внутрь по 0,005 г (до или после еды) 1 раз в день в течение нескольких месяцев.
Форма выпуска: таблетки по 0,005 г (№ 10, 28, 30).
Хранение: список Б.
Бикалутамид (Bicalutamide)
Синоним: Касодекс
Способ применения и дозы: назначают внутрь по 0,05 - 0,15 г 1 раз в день ежедневно. Обычно применяют в сочетании с гозерелином.
Форма выпуска: таблетки по 0,05 и 0,15 г (№28).
Хранение: список Б.
Пермиксон (Permixon)
Способ применения и дозы: назначают внутрь (во время еды) по 0,16 г 2 раза в сутки.
Форма выпуска: таблетки по 0,08 г (№60); капсулы по 0,16 г (№30).
Хранение: список Б.
Простаплант (Prostaplant)
Способ применения и дозы: назначают внутрь (не разжевывая, с небольшим количеством воды) по 1 капсуле 1 раз в день.
Форма выпуска: капсулы по 0,32 г (№30).
Хранение: список Б.
Анастрозол (Anastrozole)
Синоним: Аримидекс
Способ применения и дозы: назначают внутрь по 0,001 г 1 раз в день.
Форма выпуска: таблетки по 0,001г (№ 14, 28).
Хранение: список Б.
Летрозол (Letrozole)
Синоним: Фемара
Способ применения и дозы: назначают внутрь по 0,0025 г (2,5 мг) 1 раз в день длительно (5 - 10 лет и более).
Форма выпуска: таблетки по 0,0025 г (2,5 мг) (№30).
Хранение: список Б.
Хлодитан (Chloditanum)
Синоним: Митотан.
Способ применения и дозы: назначают внутрь (через 15 - 20 минут после еды), начиная с 2 - 3 г в сутки в первые 2 - 3 дня, затем из расчета 0,1 г/кг в сутки. Суточную дозу делят на 3 приема. Средняя курсовая доза 200 - 300 г. После приема каждых 80 - 100 г допускается перерыв в 2-3 дня.
Форма выпуска: таблетки по 0,5 г (№100).
Хранение: список Б.
Аминоглютемид (Aminoglutemide)
Синонимы: Мамомит, Ориметен.
Способ применения и дозы: назначают внутрь (во время еды) по 0,125 - 0,25 г 2 - 4 раза в день. Принимают ежедневно длительно.
Форма выпуска: таблетки по 0,25 г (№50, 100)
Хранение: список Б.
Обзор современных противоопухолевых средств
ТЕМОДАЛ - ПЕРСПЕКТИВНЫЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ДИССЕМИНИРОВАННОЙ МЕЛАНОМЫ КОЖИ
М.Е. Абрамов
ГУ РОНЦ им.Н. Н. Блохина РАМН, Москва
Темодал - перспективный препарат для лечения диссеминированной меланомы кожи. Диссеминированная меланома кожи является чрезвычайно опасным заболеванием, характеризующимся быстрым развитием, ранним метастазированием и недостаточной эффективностью современных лечебных методов. Определенные перспективы в лечении меланомы наметились с внедрением в клиническую практику цитостатического препарата второго поколения из класса имидазотетразинов - Темодала (темозоломида). Важным достоинством Темодала является способность легко проникать через гематоэнцефалический барьер и избирательно накапливаться в ткани опухоли, что чрезвычайно важно при лечении метастазов меланомы и других злокачественных новообразований в головной мозг, а также опухолей головного мозга. Подчеркивается способность Темодала улучшать качество жизни таких больных. Рассматривается эффективность применения Темодала в качестве монотерапии и в составе различных химиотерапевтических режимов. Обсуждается возможность использования этого препарата в схемах биохимиотерапии (в сочетании с различными цитокинами).
Меланома кожи является чрезвычайно опасным заболеванием, характеризующимся быстрым развитием, ранним метастазированием и недостаточной эффективностью современных лечебных методов. В настоящее время практически во всех странах мира наблюдается рост заболеваемости населения меланомой кожи.
Несмотря на отдельные успехи, достигнутые в лечении диссеминированной меланомы кожи за последние десятилетия, эта проблема актуальна и в настоящее время. Эффективность химио- и иммунотерапии остается достаточно низкой. Сведения о необычайно высоких результатах лечения с использованием какой-либо новой схемы, достигнутых в небольших группах пациентов, не подтверждаются в дальнейшем при проведении крупных многоцентровых исследований. Ремиссии, достигнутые при лечении отдельных больных меланомой, как правило, кратковременны. Серьезной проблемой остаются прогнозирование и преодоление резистентности опухолевых клеток к цитостатическим препаратам.
Основным направлением работы большинства исследователей, занимающихся лечением диссеминированной меланомы, является поиск новых эффективных цитотоксических препаратов и лекарственных комбинаций.
В настоящее время клиническое значение при лечении меланомы кожи имеет лишь небольшая группа химиопрепаратов, эффективность которых при монотерапии превышает 10%.
Одним из наиболее активных препаратов, эффективность которого при меланоме считается эталонной, является дакарбазин (5- [3,3-димилил-1-триазенил] -1Н-имидазол-4-карбоксамид). Это препарат синтетического происхождения. Его механизм действия обусловлен, главным образом, блокированием алкилтрансферазы. Дакарбазин остается основным средством лечения меланомы как в моно-, так и в полихимиотерапии на протяжении последних 20 лет. Эффективность дакарбазина в монотерапии составляет около 20% с широким спектром токсичности.
В 1984 г. Stevens и соавт. синтезировали новый цитостатический препарат второго поколения из класса имидазотетразинов - Темодал (темозоломид). Основными механизмами противоопухолевого действия Темодала являются метилирование ДНК и реакция алкилирования в O6 позиции гуанина с дополнительным алкилированием в позиции N7.
При приеме внутрь Темодал быстро абсорбируется и претерпевает спонтанный гидролиз с образованием активного метаболита MTIC. Его биодоступность составляет практически 100%. В отличие от дакарбазина превращение Темодала в активный метаболит не требует прохождения препарата через печень. Это уникальное свойство Темодала устраняет влияние индивидуальных колебаний биохимического метаболизма на его фармакокинетику.
Другой важной особенностью Темодала является его способность легко проникать через гематоэнцефалический барьер и избирательно накапливаться в ткани опухоли. Концентрация препарата в спинномозговой жидкости по отношению к концентрации в плазме составляет 29,4%, а через 4 часа увеличивается до 40%, что выгодно отличает Темодал от дакарбазина, который не проникает через гематоэнцефалический барьер. Возможно, что замена дакарбазина Темодалом в лекарственных схемах лечения позволит снизить частоту возникновения метастазов меланомы в ЦНС и расширить показания к назначению некоторых режимов химиотерапии.
Следует отметить низкую токсичность Темодала. Из проявления негематологической токсичности отмечаются незначительные тошнота и рвота (у 30% больных), которые полностью купируются назначением стандартных антиэметиков.
Гематологическая токсичность проявляется в основном лейкопенией и тромбоцитопенией, которые предсказуемы и легко обратимы. Миелосупрессия III-IV степени была отмечена в 5-11% случаях. Кумулятивной токсичности не выявлено. Снижение количества гранулоцитов и тромбоцитов наблюдается на 21-22-й день применения Темодала, и только у 5-8% пациентов может потребоваться редукция дозы при первых курсах.
В связи с удобством и простотой применения (прием внутрь), низким профилем токсичности Темодал рекомендуется использовать в амбулаторном режиме.
Другой важной особенностью Темодала является способность поддерживать качество жизни пациентов на достаточно высоком уровне. Больные, которым показано лечение этим препаратом зачастую относятся к наиболее тяжелой категории. Опухоли головного мозга, метастазы в головной мозг дают удручающую клиническую картину, поэтому очень важно, что по данным большинства авторов, приблизительно через 10 дней после начала лечения Темодалом наблюдается ослабление неврологической симптоматики.
Одним из важнейших механизмов действия этого препарата является его способность подавлять активность ряда ферментов, ответственных за репарацию ДНК. Обнаружено, что терапевтический эффект алкилирующих агентов и препаратов из группы нитрозомочевины связан с образованием производных O6-алкилгуанина. Эти производные во время репликации ДНК связываются с тимидином вместо цитозина, блокируя в конечном итоге пролиферацию клеток и вызывая их гибель. Эффективность цитотоксического действия указанных препаратов определяется действием пострепликативной системы репарации последовательностей O6-метилгуанин/тимидин. Белок O6-алкилгуанин-ДНК алкилтрансфераза (АГТ) отвечает за репарацию повреждений, вызванных O6-алкилгуанином. Этот фермент осуществляет перенос алкильной группы с O6 атома гуанина ДНК на свой остаток цистеина. При этом ДНК возвращается к нормальному немодифицированному состоянию, одновременно происходит инактивация АГТ.
Было показано, что чувствительность опухолевых клеток к химиотерапии зависит от уровня АГТ. Установлено, что дакарбазин и еще в большей степени Темодал способствуют снижению уровня АГТ в опухоли, что усиливает противоопухолевый эффект.
Эффективность Темодала в лечении метастатической меланомы была доказана в одном из ранних исследований, в котором препарат назначался 55 больным. Объективный ответ был отмечен у 21% пациентов (5% - полная и 16% - частичная ремиссия), еще у 14% больных наблюдалась стабилизация болезни. Медиана выживаемости при наличии объективного ответа и неэффективности лечения составляла 14,5 и 4,5 месяца соответственно.
В III фазе изучения сравнительной эффективности лечения диссеминированной меланомы Темодалом и дакарбазином была показана равная эффективность препаратов, но медиана выживаемости и качество жизни больных при применении Темодала были выше.
Особое внимание привлекает проблема лечения метастазов солидных опухолей в головной мозг. Наблюдаемый в последние годы рост частоты метастатических поражений головного мозга связан с достижениями современной химиотерапии, позволяющими повысить выживаемость онкологических больных. Сегодня метастазы в головной мозг развиваются у каждого пятого онкологического пациента. Наиболее часто это происходит при раке легкого (40%), молочной железы (17%) и меланоме (11%). Эффективность лечения метастазов в головной мозг (частичная ремиссия и стабилизация болезни) Темодалом в дозе 150 мг/м2 (1-7 и 15-21-й день каждого 4-недельного цикла) составляет при немелкоклеточном раке легкого 24%, раке молочной железы - 19% и меланоме кожи - 40%.
Эффективность химиотерапии при лечении диссеминированной меланомы кожи, как уже отмечалось выше, достаточно низка. В настоящее время перспективным подходом к лечению этой категории больных является использовании биохимиотерапии (сочетание цитостатиков и цитокинов), при которой удается добиться более высоких результатов. По результатам II фазы клинических исследований, частота объективных эффектов на фоне данного вида лечения достигает 40-50%, причем у каждого шестого пациента наблюдается полная ремиссия, и у половины из них достоверно увеличивается продолжительность жизни.
Paul M. J. и соавт. провели ретроспективный анализ группы больных, получавших лечение дакарбазином (n = 21) или Темодалом (n = 20). Было показано, что у эффективно леченых больных Темодал предупреждает развитие метастазов в головной мозг. В группе пациентов, получавших Темодал, по сравнению с больными из группы дакарбазина частота метастазирования уменьшилась в четыре раза (только в 2 случаях против 9). Эти данные подтверждаются результатами исследования по оценке частоты метастазирования в головной мозг у пациентов, ответивших на терапию дакарбазином или Темодалом. При применении последнего частота метастазирования оказалась существенно ниже. Основываясь на полученных результатах, авторы предлагают включать Темодал в схемы биохимиотерапии, при применении которых у ответивших на лечение пациентов в последующем часто регистрируются метастазы в головной мозг.
Наиболее интересной представляется комбинация Темодала и интерферона (ИФН) альфа-2бета. Хорошая переносимость, высокая эффективность и низкая токсичность делают возможным использование данной комбинации в амбулаторном режиме. По данным рандомизированного многоцентрового исследования DeCOG, результаты которого были доложены на ASCO в 2003 г., частота объективного ответа при лечении диссеминированной меланомы комбинацией ИФН альфа-2бета и Темодала составила 23,9 против 13,7% при использовании Темодала в монорежиме. Темодал назначали в дозе 200 мг/м2 1-5-й день 28-дневного цикла, ИФН альфа-2бета - по 5 млн МЕ/м2 подкожно ежедневно в течение первой недели, далее через день. В исследование были включены 294 пациента в 35 европейских центрах. Следует, однако, отметить, что повышение частоты ответа при сочетанном применении Темодала и ИФН альфа-2бета не привело к повышению выживаемости. По данным различных авторов, общая эффективность комбинации Темодала и ИФН альфа-2бета (в различных дозовых режимах) составляет до 27% с медианой выживаемости более 14 месяцев. Режим лечения оказался малотоксичным.
В 2003 г. de Gast G. C. и соавт. представили результаты лечения 74 больных диссеминированной меланомой кожи, которые получали Темодал в дозе 150-250 мг/м2 (1-5-й день каждые 28 дней), интерлейкин-2 - 4 млн МЕ/м2, гранулоцито-макрофагальный колониестимулирующий фактор - 2,5 мкг/кг и ИНФ альфа-2бета - 5 млн МЕ/м2 в виде подкожных инъекций 1-12-й день. Объективный эффект был отмечен в 31% случаев (5,4% полных ремиссий). Медиана выживаемости составила 252 дня, а одногодичная выживаемость - 41%. У некоторых пациентов при достижении эффекта или длительной стабилизации болезни удавалось выполнить оперативное вмешательство, что значительно улучшило результаты лечения. Отмечено увеличение токсичности в виде тромбоцитопении и нейтропении III-IV степени при применении Темодала в дозе 250 мг/м2.
Комбинация Темодала 200 мг/м2 1-5-й день и интерлейкина-2 в дозе 4,5 млн МЕ 4 раза в неделю, в течение 3 недель, начиная со второй недели курса оказалась менее эффективной. Общая эффективность (полная и частичная ремиссия) составила 22%. Токсичность была незначительной. Отмечено значительное увеличение времени до прогрессирования у эффективно леченых больных (до 39+ месяцев), вероятнее всего связанное с эффектом лечения интерлейкином-2.
Серьезной проблемой остается контроль рецидивов болезни, которые у успешно леченых больных в большинстве случаев реализуется в виде метастатического поражения ЦНС. С учетом высокой способности Темодала проникать через гематоэнцефалический барьер можно рассматривать вопрос о включении этого препарата в различные химиотерапевтические комбинации или замене в них дакарбазина Темодалом.
Существует продленный режим использования Темодала, используемый обычно при сочетанном назначении химио- и лучевой терапии. Наиболее часто он применяется при опухолях головного мозга и метастазах солидных опухолей в головной мозг. Впечатляющие результаты адъювантного лечения при мультиформных глиобластомах были доложены на пленарном заседании Американского общества клинических онкологов в 2004 г. В исследование были включены 573 больных. Темодал назначали в дозе 75мг/м2 ежедневно в течение до 42 дней и одновременно проводили лучевую терапию в дозе 60 гр (30 ежедневных фракций по 2 Гр). Затем пациентам проводили еще 6 циклов Темодала в дозе 150-200 мг/м2 (1-5-й день каждого 28-дневного цикла). В группе больных, не получавших лучевой терапии, Темодал также назначался в продленном режиме, но без дополнительных 6 курсов. Токсичность была умеренной. Комбинированная терапия значительно улучшала результаты лечения. Значительное повышение выживаемости было отмечено при комбинации Темодала в дозе 150 мг/м2 (1-5-й день каждого 4-недельного цикла) и лучевой терапии в дозе 24 гр при лечении метастазов меланомы в головной мозг. Медиана выживаемости пациентов, получавших только лучевую терапию, составила 35 дней против 180 дней у больных, которым проводили комбинированное лечение. Токсичность лечения была минимальной.
Интересные результаты были получены при оценке комбинации Темодала и доцетаксела. Шестьдесят пять больных диссеминированной меланомой получили лечение Темодалом в дозе 150 мг/м2 1-5-й день и доцетакселом в дозе 80 мг/м2 в 1-й день 28-дневного цикла. Частота объективного эффекта составила 27% (8% - полная ремиссия). Среднее время до прогрессирования в группе ответивших на лечение составило 11,2 месяцев, а средняя продолжительность жизни - 16 месяцев.
Daponte A. и соавт. продемонстрировали необычайно высокую эффективность применения комбинации Темодала и цисплатина у больных диссеминированной меланомой кожи. Тридцать семь пациентов получали лечение по схеме: цисплатин 75 мг/м2 в 1-й день и Темодал 200 мг/м2 1-5-й день каждого 4-недельного цикла. В случае достижения эффекта по окончании химиотерапии продолжали лечение ИНФ альфа-2бета по 5 млн МЕ 3 раза в неделю в течение года. Общая эффективность данного режима лечения составила 48,6% (24,3% полных регрессов). Медиана выживаемости составила 48 недель. Токсичность режима была умеренной.
Интересной представляется комбинация Темодала и иринотекана (Кампто). Целесообразность ее использования основана на данных об усилении эффективности иринотекана после предварительного удаления метилгуаниновой метилтрансферазной метиловой группы Темодалом. Gruber M. L. опубликовал результаты лечения указанной комбинацией 32 больных с рецидивами злокачественных глиом. Темодал назначали в дозе 200 мг/м2 в течение 5 дней, иринотекан - по 350 мг/м2 (2-часовая инфузия на 6-й день 28-дневного цикла). Максимально проводили 6 курсов, далее лечение продолжали только Темодалом до 6 месяцев. Токсичность режима была умеренной. У 28% больных был достигнут объективный эффект; 6-месячная выживаемость без прогрессирования достигала почти 40%. При анапластических астроцитомах эти показатели составили 36 и 71% соответственно.
Caraglis М. и соавт. оценивали комбинацию Темодала 200 мг/м2 1-5-й день и липосомального доксорубицина (Келикс) 40 мг/м2 в 1-й день 4-недельного цикла при лечении метастазов различных солидных опухолей в головной мозг. При применении данной схемы лечения было зарегистрировано 2 полных и 2 частичных эффекта у 12 пролеченных пациентов. Выживаемость больных с полной ремиссией превышала 27 месяцев. Сходные результаты были получены при применении разных доз Темодала и доксорубицина при лечении различных солидных опухолей. Общая эффективность составила 38% при умеренной токсичности.
Перспективными для будущего изучения являются комбинации Темодала и антиангиогенных препаратов. Отмечена высокая эффективность комбинации Темодала и талидомида при лечении диссеминированной меланомы. Тридцати восьми пациентам назначали Темодал 75 мг/м2, в течение 6 недель, с 2-недельным перерывом и талидомид 400 мг внутрь ежедневно. Объективный ответ был зарегистрирован у 32% больных. У некоторых эффективно леченых пациентов удалось выполнить оперативное лечение. Медиана выживаемости составила 9,5 месяцев.
Использование целекоксиба в комбинации с Темодалом не увеличивает эффективность последнего (объективный эффект - 21,5%) при лечении диссеминированной меланомы.
Таким образом, терапевтические методы лечения диссеминированной меланомы кожи не смогли до настоящего времени существенно улучшить показатели выживаемости больных. Особое внимание у этой категории больных придается качеству их жизни. Внедрение в клиническую практику Темодала позволило существенно улучшить данный показатель. Низкая частота побочных эффектов, предсказуемость и отсутствие кумулятивной токсичности позволяют широко использовать Темодал в амбулаторной практике как в монотерапии, так и в комбинациях. Способность легко проникать через гематоэнцефалический барьер делает Темодал препаратом выбора при лечении опухолей головного мозга и метастазов солидных опухолей в головной мозг. Темодал превосходит дакарбазин по способности снижать частоту метастазирования в головной мозг, что позволяет при его применении достигать более высоких показателей общей и безрецидивной выживаемости.
АНЕМИЯ ПРИ ХИМИОТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ: ЭФФЕКТИВНОСТЬ ЭПРЕКСА (ЭПОЭТИН АЛЬФА)
В.В. Бредер, Н.С. Бесова, В.А. Горбунова
ГУ РОНЦ им.Н. Н. Блохина РАМН, Москва
Анемия при химиотерапии злокачественных опухолей: эффективность Эпрекса (эпоэтин альфа).
В статье проведен анализ литературных данных о значении анемии для качества жизни и эффективности лечения онкологических больных. Представлен опыт собственного применения рекомбинантного человеческого эритропоэтина альфа (Эпрекс) при анемии, сопровождающей злокачественный процесс. Продемонстрирована высокая эффективность и безопасность терапии Эпрексом у этой категории больных. Даны рекомендации по оптимальным схемам дозирования препарата в зависимости от уровня гемоглобина крови. Отмечено выраженное позитивное влияние Эпрекса на параметры качества жизни пациентов - уменьшение слабости, повышение работоспособности. Своевременная коррекция пониженного уровня гемоглобина крови позволяет повысить эффективность и переносимость основного противоопухолевого лечения.
В отечественной медицинской литературе термин "раковая анемия" не нашел применения не только из-за некоторой резкости строгого перевода фразы "cancer anemia", но и вследствие недооценки важности проблемы. Чаще всего анемия рассматривается как один из симптомов заболевания или осложнение лечения без выделения в нозологическую единицу. Такая узкая, механистическая интерпретация снижения концентрации гемоглобина (Нb) крови приводит к недопониманию значения серьезных последствий этого состояния для организма и личности пациента онкологической клиники. Насколько специфична анемия при онкологическом заболевании, каковы последствия ее возникновения, может ли это повлиять на эффективность проводимого лечения? Это лишь часть вопросов, на которые крайне важно иметь ответы.
Раковая анемия - синдром, патологическое состояние организма, развившееся в результате онкологического заболевания, при этом регистрируется снижение уровня Нb крови ниже физиологической нормы (< 12 г/дл). Подчеркнем, что помимо таких видимых причин, как кровотечение, гемолиз, поражение костного мозга, гиперспленизм и дефицит кофакторов гемопоэза, в основе анемии при злокачественных опухолях лежит патологический процесс, аналогичный наблюдаемому при ревматоидном артрите и ряде хронических инфекций - синдром анемии хронического заболевания. Этот синдром развивается в результате активации опухолевым процессом иммунной системы и воспалительных реакций, что приводит к увеличению концентрации фактора некроза опухоли, интерферона-y и интерлейкина-1 в крови и тканях. Цитокины, вероятно, нарушают обмен железа, подавляют процесс дифференцировки клеток-предшественников эритроидного ряда и негативно влияют на выработку эритропоэтина - ключевого гормона для эритропоэза. Медиаторы воспаления уменьшают время жизни эритроцита со 120 дней (здоровый организм) до 90-60 дней как при ревматоидном артрите, так и при анемии злокачественного процесса.
Противоопухолевое лечение может значительно уменьшить количество эритроцитов в крови за счет миелосупрессии, нарушения синтеза гемопоэтических факторов, включая эритропоэтин, вырабатываемый в почках. Именно этот путь развития анемии реализуется при химиотерапии с производными платины, для которых свойственна нефротоксичность.
Частный случай или проблема в онкологии?
Анемия - хорошо известное осложнение злокачественных заболеваний и их лечения. Частота анемии у онкологических больных различается в зависимости от типа опухоли и характера терапии. Важно помнить, что анемия может быть одним из первых признаков заболевания, к тому же нет четкой взаимосвязи степени выраженности анемии и тяжести злокачественного процесса, определившего ее появление. Более половины пациентов со злокачественными заболеваниями легких, мочеполовой сферы, органов женской репродуктивной системы в течение болезни нуждаются в гемотрансфузии, а легкая или умеренная анемия встречается еще чаще. При лимфомах на момент постановки диагноза анемия (Нb < 12 г/дл) выявляется у 40% больных, к 3-4 курсу химиотерапии этот показатель возрастает до 70%. Европейское исследование анемии при раке - ECAS 2001
В 2001 г. было проведено самое большое исследование проблемы анемии в онкологии. European Cancer Anemia Survey (ECAS) - европейское исследование анемии при раке объединило и позволило проанализировать данные по 15 367 пациентам из более чем 750 клиник 24 стран Европы.
На момент включения в базу исследования противоопухолевое лечение не получали 53% больных, 40% пациентов проводилось лекарственное лечение (химиотерапия, иммунотерапия), лучевая терапия имела место у 5% больных и еще в 2% случаев в сочетании с химиотерапией. Анемия отмечалась у 35% пациентов с впервые выявленным онкологическим процессом, у 49% больных, получавших противоопухолевое лечение, и у 31% пациентов, находившихся в стадии ремиссии. Отмечено, что на протяжении болезни (6 месяцев наблюдения за включенными в базу исследования ECAS) анемия (Нb < 12 г/дл) наблюдалась у 72% пациентов с гематологической патологией и у 66% больных с солидными новообразованиями. Из них получали лечение по поводу анемии лишь 49% лиц, страдавших гемобластозами, и 39% пациентов с солидными опухолями. Лечение анемии начиналось, как правило, при низком уровне Нb (в среднем 8,9 и 10 г/дл при гематологических и солидных новообразованиях соответственно).
С целью поиска возможностей для улучшения качества жизни пациентов со злокачественными опухолями и вероятных резервов повышения эффективности лечения в Северной Америке и странах Европы за последнее десятилетие был проведен ряд ретроспективных исследований по изучению анемии - ее частоты, взаимосвязи с проводимым лечением, влияния на потребность в гемотрансфузиях и т.д. Ретроспективное исследование Skillings J. R. и соавт. обнаружило следующие закономерности в отношении анемии и химиотерапии:
химиотерапия приводит к снижению уровня Нb крови при всех видах онкопатологии;
исходно низкий уровень Нb определяет большую потребность в гемотрансфузиях при последующем лечении;
количество пациентов, нуждающихся в гемотранфузиях для лечения анемии, составляет 12-18%;
использование в лечении платиносодержащих режимов - значимый прогностический фактор развития анемии;
уровень Нb ниже 12 г/дл - главный прогностический фактор развития анемии на фоне химиотерапии.
При многофакторном анализе было показано, что уровень Нb < 12 г/дл, неудовлетворительный объективный статус больного и уровень лимфоцитов < 700/мм3 до начала химиотерапии ассоциируются с высокой вероятностью развития клинически значимой анемии в процессе лечения. Эти выводы нашли подтверждение в двух других крупных исследованиях, проведенных в Великобритании и Франции. При рассмотрении результатов лечения 1064 пациентов, получавших химиотерапию без производных платины, французские исследователи показали, что 14,5% из них проводились гемотрансфузии, причем этот показатель был выше в группах больных неходжкинскими лимфомами и раком яичников. Показано, что исходно низкий уровень Нb (< 10,5 г/дл) является прогностическим фактором необходимости проведения гемотранфузий при последующем лечении. В британском исследовании были проанализированы результаты химиотерапии с производными платины у 2719 больных. Было показано, что у 60% пациентов в процессе химиотерапии отмечался субоптимальный уровень Нb (< 12 г/дл), а 30% больным потребовались гемотрансфузии.
Ретроспективный анализ 957 случаев метастатического рака предстательной железы показал, что анемия (Hb < 12 г/дл) на момент выявления заболевания ассоциируется с меньшей выживаемостью, более коротким периодом без прогрессирования и меньшей вероятностью нормализации уровня ПСА.
Классификация и симптоматология анемии злокачественного процесса.
Анемия проявляется целым рядом симптомов, обусловленных развитием гипоксии в органах и тканях с последующим нарушением их функций. Степень выраженности этих симптомов зависит от ряда факторов, таких как глубина анемии, скорость развития, компенсаторных механизмов, сопутствующей патологии и особенно физиологического статуса пациента. По степени выраженности классификация Национального института рака (NCI) США выделяет легкую, умеренную, выраженную и тяжелую анемию.
Проявления анемического синдрома, их выраженность определяет не только уровень Нb крови, но и скорость снижения его концентрации. Медленно развивающаяся анемия у молодого человека долго остается клинически незаметной, как правило, до значительного или резкого уменьшения концентрации Нb или эпизода перегрузки. Для пожилого больного с букетом сопутствующих заболеваний даже незначительное, но быстрое снижение уровня Нb может иметь тяжелые последствия: ухудшение течения ишемической болезни сердца, неврологические, психотические расстройства и т.д. Анемия при хронической сердечной недостаточности сама по себе является фактором, ухудшающим выживаемость. Снижение уровня Нb ниже 8 г/дл у пациента, страдающего ишемической болезнью сердца, достоверно повышает вероятность эпизода коронарной недостаточности.
При внимательном и целенаправленном опросе больного выявляются другие признаки анемического синдрома: депрессия и нарушение сна, снижение либидо и головокружение при резком вставании, снижение способности к умственному труду, расстройства памяти и настроения, утомляемость.
Утомляемость - недооцененное проявление анемии.
Утомляемость (fatigue) - состояние слабости, следующее после эпизода физического/умственного напряжения и характеризующееся уменьшением работоспособности, снижением эффективности ответа на стимуляцию. Этот симптом встречается у 75% онкологических больных. Более того, в условиях доступности полноценного обезболивания утомляемость описывается как самый частый симптом рака. Исследование Vogelzang N. J. и соавт. на группе из 419 пациенток с различными онкологическими заболеваниями, выбранных случайным образом из 100 тыс. больных при телефонном опросе, показало, что у 78% из них имела место утомляемость в процессе болезни и лечения. Более 60% больных отмечали, что утомляемость ухудшала повседневную жизнь сильнее, чем раковая боль. В исследовании французских онкологов пациенты определили утомляемость как основной побочный эффект химиотерапии, более значимый чем тошнота и боль.
В нескольких исследованиях обнаружена взаимосвязь частоты утомляемости и противоопухолевого лечения. Доказано прямое влияние уровня Нb на утомляемость и остальные параметры качества жизни. Нормализация уровня Нb сопровождается достоверным улучшением субъективного состояния больных.
В исследовании Demetri G. D. и соавт, включавшем 2289 пациентов, получавших химиотерапию, показано, что эффективная коррекция анемии с использованием рекомбинантного эритропоэтина (эпоэтин альфа - Эпрекс) достоверно улучшала качество жизни пациентов (р < 0,001) независимо от результатов противоопухолевого лечения.
Лечение анемии: быть или не быть?
Хотя в современной литературе нет однозначных указаний на то, при каких показателях Нb крови у онкологических больных следует начинать лечение или профилактические мероприятия, какому методу отдавать предпочтение, большинство авторов пишут о необходимости своевременной коррекции анемии, сопровождающей опухолевый процесс.
Условно в лечении анемии можно выделить 2 подхода: патогенетический и симптоматический. К патогенетическому варианту можно отнести устранение причин анемии, в т. ч. эффективное противоопухолевое лечение, коррекцию дефицита кофакторов гемопоэза (железо, фолиевая кислота) и алиментарных нарушений. Отдельно следует рассматривать необходимость устранения абсолютного или относительного дефицита эндогенного эритропоэтина - прямого стимулятора эритропоэза, вырабатываемого в основном в почках. Пример симптоматического лечения - трансфузия эритроцитарной массы, восполняющая количественный дефицит эритроцитов.
Метод переливания крови и ее компонентов занимает одно из главных мест в истории медицины последнего столетия. Трансфузия эритроцитарной массы - признанный вариант лечения хронической анемии. Современные лаборатории, оснащенные по последнему слову техники, при анализе крови доноров на наличие инфекции используют наиболее точные методики (ПЦР-диагностика), основным недостатком которых является высокая стоимость. В Европе и США это свело к минимуму вероятность передачи вирусных инфекций - вируса иммунодефицита человека, сывороточного гепатита (В и С), цитомегаловируса и т.д. Однако среди осложнений гемотрансфузий по-прежнему актуальны сывороточный гепатит, СПИД, цитомегаловирусная инфекция, а также аллергические реакции, анафилаксия, перегрузка железом (гемосидероз печени и миокарда).
Несомненно, указанные риски влияют на решение врача о назначении трансфузии эритромассы при лечении анемического синдрома. Средний уровень Нb крови в странах Европы, при котором назначается переливание эритроцитной массы, составляет 8,2 г/дл. Принимая во внимание новые данные о значении анемии для качества жизни, эта точка отсчета неадекватна в большинстве случаев. Но даже если показанием к гемотрансфузии будет Hb < 9,0 г/дл, большую часть времени пациенты будут жить с субоптимальным уровнем Нb. Главное преимущество трансфузии эритроцитной массы - быстрое и дозируемое увеличение концентрации Нb крови - следует использовать в случаях острой симптомной анемии.
Однако в реальной клинической ситуации (особенно в случаях субоптимальной анемии) маловероятно, что онколог предложит пациенту и организует переливание эритроцитарной массы. Как правило, лечебные мероприятия ограничиваются перерывом в проведении противоопухолевого лечения с последующей редукцией доз цитостатиков, назначением препаратов железа, поливитаминов. В итоге трансфузия проводится крайне редко, поскольку у практических врачей нет общепринятого руководства (так называемого стандарта) по лечению раковой анемии и процедура возможна только по инициативе врача стационара. Для переливания крови необходима госпитализация, высока вероятность несвоевременного проведения процедуры из-за отсутствия эритромассы нужной группы крови и достаточного ее количества. Одна перелитая стандартная доза эритромассы позволяет увеличить концентрацию гемоглобина на 1 г/дл, и, конечно, для достижения физиологической нормы понадобится неоднократная гемотрансфузия на протяжении определенного периода времени. При этом пропорционально возрастает вероятность иммуносупрессии, аллергических реакций и других вышеуказанных осложнений.
Эпрекс - рекомбинантный человеческий эритропоэтин-альфа (эпоэтин альфа) является оптимальным выбором в большинстве случаев анемии у онкологических больных. Препарат стимулирует дифференцировку клеток-предшественников эритроидного ряда, воздействуя на митоз. Применение Эпрекса обычно позволяет компенсировать абсолютный или относительный дефицит эндогенного эритропоэтина, что в конечном итоге приводит к увеличению концентрации Нb крови.
В двух крупнейших исследованиях, проведенных при участии практических онкологов США, обобщен опыт применения Эпрекса при анемии на фоне химиотерапии более чем у 4000 пациентов, страдавших немиелоидными злокачественными заболеваниями. Применение эпоэтина альфа в режиме 150 МЕ/кг подкожно 3 раза в неделю в течение 16 недель позволило получить значимый (> 2 г/дл) прирост уровня Нb у 53,4% пациентов при среднем приросте от начального уровня 1,8 г/дл и 2,1 г/дл. Зарегистрировано более чем 50% -ное уменьшение числа гемотрансфузий и количества доз перелитой эритромассы в расчете на 1 пациента за 1 месяц. Отмеченное улучшение основных параметров качества жизни (энергия, ежедневная активность, качество жизни в целом) наблюдалось независимо от эффективности противоопухолевого эффекта и прямо зависело от степени прироста концентрации Нb. Максимальное, статистически достоверное улучшение параметров качества жизни наблюдалось при приросте Нb более чем на 2 г/дл.
В отделении химиотерапии РОНЦ РАМН было проведено исследование эффективности Эпрекса в лечении платино-индуцированной анемии. Больные раком легкого, яичников и молочной железы (n = 24), у которых на фоне химиотерапии, содержавшей производные платины, отмечалась анемия 2 степени (Hb < 9,6 г/дл), получали в течение 8 недель терапию Эпрексом в дозе 10 тыс. МЕ 3 раза в неделю подкожно. В исследуемой группе (21 пациент) запланированный прирост уровня Hb (> 2 г/дл) к окончанию лечения был достигнут у 14 больных (66,7%). Прогностически значимый прирост Hb (> 1г/дл) к 5 неделе отмечался у 17 пациентов, 3 из них закончили терапию Эпрексом досрочно в связи с окончанием химиотерапии (прогресс заболевания). Приведем клинический случай из представленного исследования.
Пациент З., 49 лет. В октябре 2000 г. установлен диагноз диссеминированного немелкоклеточного рака легкого: выявлена центральная опухоль правого легкого с метастазами в лимфоузлы средостения и плевру справа, осложненная синдромом сдавления верхней полой вены, экссудативным плевритом справа и дыхательной недостаточностью 2 ст. Цитологическое заключение: недифференцированный рак легкого. Объективный статус по шкале Карновского - 40%. Химиотерапия: карбоплатин AUC 6 (общая доза 650 мг) в/в в 1-й день, циклофосфан 500 мг/м2 (общая доза 1000 мг) в/в в 1-ый день, этопозид 100 мг/м2 в/в во 2, 3, 4-ые дни (общая доза 600 мг). При контрольном обследовании после 2 курсов химиотерапии отмечен частичный регресс измеримых проявлений опухолевого поражения и исчезновение правостороннего плеврита. Субъективное состояние больного значительно улучшилось, объективный статус по шкале Карновского - 90%. В процессе лечения отмечалось снижение уровня Hb с 13,6 до 9,8 г/дл к моменту начала 3 курса химиотерапии (28-30.12.2000).
При контрольном визите в клинику 10 января 2001 г. больной предъявлял жалобы на выраженную слабость, одышку и сердцебиение при незначительной нагрузке, головокружение, нарушение сна. Объективно: состояние больного средней тяжести (статус по шкале Карновского - 40%). Бледность кожных покровов, тахикардия, одышка в покое. Описанная клиническая картина предполагала прогресс злокачественного процесса, но по результатам срочной R-графии органов грудной клетки отмечен дальнейший регресс опухоли правого легкого. В анализе крови от 10.01.01 выявлена анемия 4 степени (Hb 5,0 г/дл, гематокрит 29%, лейкоциты 2,4 тыс., тромбоциты 109 тыс), что было расценено как осложнение проводимой химиотерапии. Начато лечение Эпрексом в режиме 10 тыс. ЕД п/к 3 раза в неделю одновременно с приемом препарата перорального железа (в суточной дозе Fe 200 мг). Уже к 4 неделе лечения было отмечено клинически значимое восстановление уровня Hb крови (10,5 г/дл). Как видно на представленном графике, терапия Эпрексом позволила нормализовать уровень Hb, его суммарный прирост за 8 недель лечения составил 8 г/дл. При проведении 5 и 6 курсов химиотерапии анемии не было. Последующее наблюдение выявило некоторое снижение концентрации Нb, но на протяжении 4 недель после окончания лечения Эпрексом этот показатель оставался в пределах физиологической нормы.
Это наблюдение - один из наиболее ярких и показательных примеров эффективности Эпрекса в лечении анемии злокачественного процесса. Препарат эффективен, удобен в использовании, побочные эффекты отмечаются редко и, как правило, не имеют клинического значения, что позволяет использовать его амбулаторно, у больных с сопутствующими заболеваниями, на фоне противоопухолевого лечения.
Эпрекс следует назначать при анемии 1, 2 и 3 степени, при быстром (1 г/дл за 1 месяц) снижении уровня Hb на фоне лечения, при наличии противопоказаний к гемотрансфузии. Стандартный дозовый режим предполагает подкожное введение 10 тыс. МЕ Эпрекса 3 раза в неделю. Длительность применения препарата ограничивается, как правило, его эффективностью. В случае эффекта - повышение Hb на 1 г/дл за 4 недели лечения в дозе 10 тыс. МЕ 3 раза в неделю - терапия продолжается до достижения границы физиологической нормы Hb (> 12 г/дл). Далее лечение Эпрексом может быть продолжено с редукцией дозы на 30% (2 введения по 10 тыс. МЕ в неделю) до уровня Hb 14 г/дл. В последующем препарат можно использовать повторно при рецидиве анемии.
Эффективность Эпрекса не зависит от концентрации в крови эндогенного эритропоэтина, уровня сывороточного железа и объективного статуса пациента. Одновременное с Эпрексом применение препаратов железа (200 мг/сут) рекомендуется у больных со сниженным уровнем ферритина плазмы (менее 100 нг/мл). Лечение эпоэтином альфа в стандартных дозах малоэффективно приблизительно у 30% пациентов (прирост Hb < 1 г/дл за 4 недели), но при уточнении противопоказаний к его применению эта цифра может быть существенно меньше. Основные противопоказания включают неконтролируемую артериальную гипертензию, кровотечение/кровопотерю, тяжелые коагулопатии, гемоглобинопатии, активные инфекции, нарушение белково-синтетической функции печени, значительное снижение резервов костномозгового кроветворения после многократных курсов химиотерапии и лучевого лечения, неблагоприятный прогноз жизни (< 8 недель), кахексию.
По результатам открытых нерандомизированных и рандомизированных плацебо-контролируемых исследований уменьшение кратности введения (1 раз в неделю) при одновременном увеличении разовой дозы Эпрекса и дозовой интенсивности (300 МЕ/кг и более) эффективно повышает уровень Hb в 68-80% случаев и значительно уменьшает потребность в гемотрансфузиях [30, 31]. Уменьшение частоты введения позволяет снизить затраты на медицинское обслуживание. В 2004 г. в США зарегистрирована и активно используется дозировка эпоэтина альфа 40 тыс. ЕД 1 раз в неделю.
Увеличение/нормализация уровня Hb крови - основной объективный критерий эффективности Эпрекса. Серия клинических исследований выявила непосредственную связь концентрации Hb и параметров качества жизни. Оптимальный эффект в отношении качества жизни отмечен при повышении уровня Hb с субоптимального (10 г/дл) до нижней границы нормы (12 г/дл). Дальнейшее возрастание концентрации Hb сопровождается незначительным улучшением показателей качества жизни. Анемия, развившаяся на фоне противоопухолевого лечения, как правило, углубляется от курса к курсу. Чем больше разрыв с физиологической нормой, тем больше сил и времени потребуется организму пациента и лечащему врачу для его устранения. Таким образом, выявление анемии является показанием к началу ее лечения.
В проспективном рандомизированном исследовании Savonije J. и соавт. с участием 315 пациентов, получавших химиотерапию с производными платины, сравнивали эффективность эпоэтина альфа и наилучшего лечения при анемии. Авторы показали достоверное возрастание параметров качества жизни и повышение уровня Нb при применении Эпрекса с уменьшением потребности в гемотрансфузиях.
Группа итальянских исследователей провела рандомизированное исследование (EPO-INT-47) эффективности Эпрекса при анемии 1 степени (Нb = 10-12 г/дл). В равном соотношении (1:
1) 214 больных раком молочной железы на фоне продолжавшейся химиотерапии получали либо Эпрекс 10 - 20 тыс. ЕД 3 раза в неделю на протяжении до 24 недель и 4 недели после окончания химиотерапии, либо наилучшее поддерживающее лечение. Применение Эпрекса приводило к быстрому и достоверному (р < 0,001) увеличению уровня Нb c исходного уровня 10,7 г/дл до 12,3 г/дл к окончанию программы лечения. Зарегистрировано достоверное уменьшение потребности в гемотрансфузиях в сравнении с группой поддерживающего лечения. Авторы делают вывод, что ранняя коррекция анемии может предупреждать ухудшение качества жизни, связанное с проведением химиотерапии и проявлениями анемии. В аналогичном по дизайну исследовании, проведенном в группе больных раком яичников (n = 182), получавших платиносодержащую химиотерапию, при использовании Эпрекса и наилучшего симптоматического лечения отмечены статистически достоверные различия в приросте уровня Нb, уменьшении потребности в гемотрансфузиях (8 против 30%) и улучшении параметров качества жизни пациенток.
Заключение
Большинство врачей привыкли считать неизбежным развитие легкой или умеренной анемии у онкологических больных. Считается, что снижение уровня Нb до 10 г/дл и даже до 8 г/дл не приносит значимого вреда пациенту. Насколько ошибочна подобная точка зрения, показали исследования по связи качества жизни с анемией, при этом своевременная и адекватная коррекция анемии значимо повышала благополучие пациентов. Показано достоверное влияние коррекции анемии на эффективность лучевого лечения, в т. ч. и в сочетании с химиотерапией [35, 36].
Опубликованы результаты рандомизированного плацебоконтролируемого исследования эффективности лечения анемии у 375 больных, получавших химиотерапию. Помимо снижения потребности в гемотрансфузиях отмечена четкая тенденция к повышению выживаемости в группе, получавшей эпоэтин альфа. Группа итальянских исследователей проанализировала результаты лечения 394 пациентов, которым по поводу метастатического процесса проводилась химиотерапия с 5-фторурацилом. Оказалось, что анемия является значимым фактором прогноза эффективности проводимого лекарственного лечения. При сопутствующей анемии объективный эффект химиотерапии отмечен в 26,5% случаев, а в группе больных с нормальным уровнем гемоглобина - в 40,6%. Многофакторный анализ подтвердил, что уровень Нb - независимый фактор прогноза продолжительности времени до прогресса заболевания и выживаемости больных.
Результаты проспективных и ретроспективных исследований, проведенных за последнее десятилетие, убедительно свидетельствуют, что проблема анемии, ее влияние на больного явно недооценены. Внедрение в клиническую практику ряда новых цитостатиков, активное использование агрессивных режимов лечения, включая одновременную лучевую и химиотерапию (например, при локализованном мелкоклеточном раке легкого), использование высоких доз интерферонов и интерлейкинов позволяет улучшить результаты лечения злокачественного заболевания. Однако интенсификация лечения ухудшает качество жизни пациентов и требует активной поддерживающей терапии. При этом улучшение функционального статуса больного, включая своевременную коррекцию анемии, можно рассматривать как значимый резерв повышения эффективности противоопухолевого лечения.
Литература
1. Машковский М.Д. Лекарственные средства. - 15 изд., перераб., испр. и доп. - М.: РИА "Новая волна": Издатель Умеренков, 2007
2. http://www.prodenas.ru
3. http://www.medvopros.com
4. http://sls. e-help.ru
5. http://www.pharmateca.ru
6. Журнал "Фарматека" Онкология № 18 (95), 2004
Похожие работы
... , ухудшение мышления, частые позывы на мочеиспускание, сопровождающиеся болью. Противопоказания Беременность. Брунеомицин (Bruneomycinum) Фармакологическое действие Обладает отчетливой противоопухолевой активностью. Оказывает значительное ингибирующее действие на кроветворение. Показания к применению Лимфогранулематоз, лимфосаркома, опухоль Вильмса и нейробластома. Способ применения ...
... к производству медицинской продукции в соответствии с международными требованиями, что несомненно будет способствовать повышению обеспеченности населения и учреждений здравоохранения России качественными и высокоэффективными лекарственными средствами. [9] 3. СТРАТЕГИЧЕСКИ ЗНАЧИМЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА 3.1 О Перечне стратегически значимых лекарственных средств Председатель Правительства ...
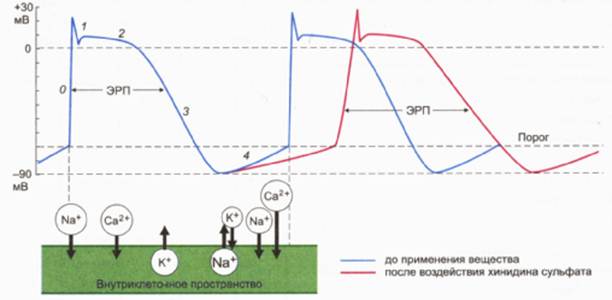
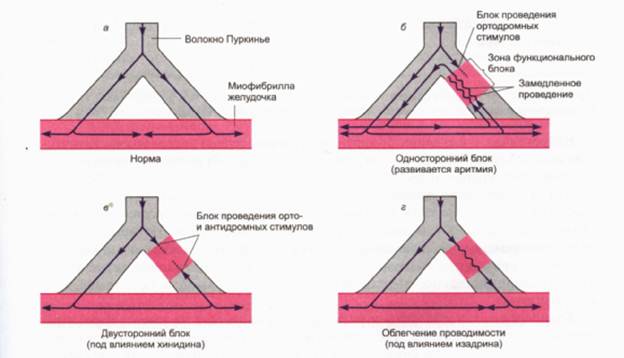
... беременности возможно лишь в том случае, когда ожидаемый терапевтический эффект превышает возможное отрицательное действие на плод. PROCAINAMIDE (ПРОКАИНАМИД) ФАРМАКОЛОГИЧЕСКОЕ ДЕЙСТВИЕ Антиаритмическое средство класса IА, обладает мембраностабилизирующей активностью. Понижает возбудимость, проводимость и автоматизм сердечной мышцы, подавляет образование импульсов в эктопических очагах, ...
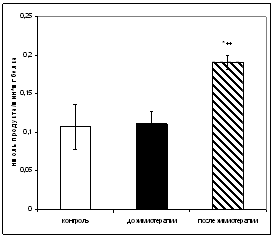
... больных до и после химиотерапии может быть использовано в качестве дополнительных биохимических критериев при наблюдении за эффективностью проводимого лечения [6,33]. 3.2 Исследование активности ангиотензинпревращающего фермента в сыворотке крови онкологических больных при химиотерапевтическом воздействии Результаты исследования показали, что активность АПФ у онкологических больных до ...


0 комментариев