Навигация
Патологическая физиология. Учебник для студентов медицинских вузов./Под ред. Н.Н.Зайко. – Киев: Вища школа, 1985 – 575 с
1. Патологическая физиология. Учебник для студентов медицинских вузов./Под ред. Н.Н.Зайко. – Киев: Вища школа, 1985 – 575 с.
2. Саркисов Д.С., Пальцев М.А., Хитров Н.К. Общая патология. – М: медицина, 1997 – 608 с.
РАЗДЕЛ 2. ТИПОВЫЕ ПАТОЛОГИЧЕСКИЕ ПРОЦЕССЫ
Тема 3. Патология обмена веществ. Дистрофии
Патология водно-электролитного обмена
Нарушение баланса воды и электролитов представляет собой одно из самых серьезных отклонений гомеостаза, которое отражается на функции различных органов и систем и может представлять опасность для жизни. Вместе с тем нарушения обмена воды и электролитов сопровождают многие заболевания различной этиологии и накладывают отпечаток на развивающуюся клиническую картину.
В патологических отклонениях вводно-электролитного гомеостаза путем искусственного вычленения можно выделить следующие проявления, обусловленные:
- нарушением внешнего водного баланса. Изменение в организме соотношения между количествами поступающей и выделяющейся воды приводит к развитию: дегидратации – обезвоживанию организма при отрицательном водном равновесии; гипергидратации – накопления избытка воды в случаях положительного водного баланса.
- нарушением распределения воды по секторам. При этом возможно: уменьшение объема жидкости в секторах, т.е. развитие вне- или внутриклеточной дегидратации; задержка воды в секторах – вне- или внутриклеточные гипергидратации; нарушение соотношений объемов секторов – дисгидрии.
- нарушением баланса электролитов в организме, приводящее к изменению осмотических концентраций секторов.
Классификация нарушений водно-электролитного обмена сталкивается с определенными трудностями, так как ни одно из перечисленных нарушений изолировано не встречается: изменения внутреннего или внешнего баланса воды приводят к электролитному дисбалансу, а первично возникающие в каком-либо секторе отклонения влекут за собой изменения в других секторах. Наиболее удобной в медицинской практике и достаточно полной и обоснованной с теоретических позиций является классификация, подразделяющая все нарушения водно-электролитного обмена на 6 групп: гипертонические, гипотонические и изотонические дегидратации и гипертонические, гипотонические и изотонические гипергидратации.
Гипертоническая дегидратация характеризуется формированием абсолютного или относительного дефицита воды в организме, при котором потери воды превышают ее поступление или эндогенное образование. В развитии гипертонического обезвоживания имеют следующие факторы:
1. Недостаточное поступление воды в организм, связанное:
· с полным отсутствием воды при пребывании в пустыне, завалах в шахтах, пещерах, подвалах и т.д.;
· с невозможностью приема воды человеком при беспомощных состояниях обусловленных возрастом, утратой сознания, обездвиживанием, при нарушении глотания или прохождения воды по пищеводу, при отсутствии чувства жажды на почве травм или психических заболеваний;
· с использованием в питании сухих, концентрированных, богатых солями продуктов.
2. Избыточные потери гипотонических жидкостей, которые могут развиваться как почечным путем, так и при участии внепочечных механизмов:
· при хронических заболеваниях почек (гипо- и изостенурия);
· при осмотическом диурезе, например, при сахарном диабете, когда выделение глюкозы в процессе фильтрации, повышая концентрацию первичной мочи, затрудняет реабсорбцию воды и ведет к полиурии, или при бесконтрольном приеме осмотических диуретиков;
· при нарушении реабсорбции воды в почках вследствие недостаточности секреции вазопрессина (антидиуретического гормона) – это наблюдается при несахарном диабете;
· при повышенном потоотделении (осмолярность пота ниже осмолярности плазмы) в связи с высокой температурой окружающей среды, особенно при работе в горячих цехах, при лихорадке;
· при длительной гипервентиляции, что наблюдается при трахеобронхитах, пневмониях, трахеостомах, истерии, плаче. Особенно быстро этим путем развивается обезвоживание у детей, которые при дыхании теряют больше воды, чем взрослые;
· при поражении кишечника, сопровождающегося выделением водянистого стула.
Картина проявлений при гипертонической дегидратации складывается из первичных нарушений и развивающихся компенсаторных реакций и механизмов. Преобладание потерь воды над выделением электролитов отражается, прежде всего, на внеклеточном секторе, создавая в нем гиперосмолярность. Уменьшение объема водных секторов происходит непропорционально: существенно снижается содержание жидкости в интерстициальном секторе, а повышение в нем осмотической концентрации приводит к передвижению воды из клеток, являясь непосредственной причиной внутриклеточной дегидратации. Сохранению объема плазмы крови способствует перераспределение внутриклеточной жидкости и коллоидно-осмотичексое давление белков, удерживающее воду в сосудистом русле. Регулярные механизмы способствуют повышению осмотической концентрации и восстановлению объемов секторов: увеличивается продукция антидиуретического гормона, который ограничивает потери воды, а центральные механизмы формируют выраженное чувство жажды.
В развитии клинической картины гипертонической дегидратации ведущую роль играет обезвоживание клеток. По мере углубления обезвоживания мозговых клеток появляется мучительное чувство жажды, слабость, апатия, сонливость, которые затем могут перейти в беспокойство, возбуждение с затемнением сознания и галлюцинациями, нарушается ритм дыхания, возможны судороги, развитие комы. Внутриклеточная дегидратация других органов и систем проявляется в потери веса. Кожа становится сухой, морщинистой, утрачивает эластичность, заостряются черты лица. Язык и слизистые сухие, покрасневшие, затруднено глотание. Повышается температура тела из-за нарушения процессов физической терморегуляции. Компенсаторно в большинстве случаев развивается олигурии с высокой плотностью мочи, за исключением ситуаций, возникновение которых связано с нарушением концентрационной способности почек (несахарный диабет и др.). Дефицит жидкости при средней степени обезвоживания доходит до 4 – 5 литров.
Уменьшение содержания воды во внутрисосудистом русле в начальных стадиях развития дегидратации выражено меньше, чем в других секторах, но по мере обезвоживания повышается величина гематокрита, концентрации натрия и других компонентов, что указывает на сгущение крови. На этом этапе возможно появление признаков нарушения кровообращения, падения АД, развитие шока. Дефицит воды в организме в этих случаях доходит до 7 -8 литров.
Терапевтические мероприятия при гипертонической дегидратации должны быть направлены на ликвидацию дефицита воды и восстановление нормальной осмотической концентрации секторов, что достигается введением растворов сахаров (5% глюкозы), не содержащих электролитов. При этом необходимо учитывать степень тяжести обезвоживания, вес больного, концентрацию катионов натрия и калия в плазме.
Изотоническая дегидратация характеризуется дефицитом эквивалентных количеств воды и электролитов. Потери изотонических жидкостей могут наблюдаться:
· при поражениях желудочно-кишечного тракта, ведущих к утрате пищеварительных соков: рвота, поносы;
· при обширных поражениях кожи, слизистых и других тканей, ведущих к транссудации и экссудации: ожоги, обширные раны, перитонит;
· при острых кровопотерях;
· при нарушениях функций почек, ведущих к полиурии; при действии диуретиков.
При изотонической дегидратации уменьшается, прежде всего, объем внеклеточной жидкости – интерстициального и, в особенности, внутрисосудистого секторов. Это предопределяет клиническую картину, которая складывается из симптомов нарушения кровообращения. В патогенезе проявлений изотонической дегидратации необходимо учитывать возможность развития нарушений кислотно-основного равновесия, так как потеря пищеварительных соков с кислотами (желудочный сок) или основными (секрет поджелудочной железы и др.) свойствами приводит к сдвигам этого баланса. В равной степени возможно развитие лактоацилоза, обусловленного циркуляторной гипоксией.
Общая симптоматика при изотонической дегидратации неспецифична и проявляется в повышенной утомляемости и замедлении психических реакций, в дальнейшем возможно помрачение сознания.
Ведущим симптомокомплексом является нарушение кровообращения. Снижение объема внутрисосудистого сектора приводит к уменьшению притока венозной крови к сердцу, снижается сердечный выброс, появляется тахикардия. По мере развития дегидратации резко падает величина АД, что может привести к гиповолемическому шоку. Степень падения АД служит важным критерием для оценки тяжести дегидратации. В далеко зашедших случаях при систолическом давлении ниже 90 мм рт ст. дефицит жидкости составляет 5 – 6 литров.
Тургор тканей понижен, глазные яблоки мягкие, появляются трещины на языке, отмечается олигурия (за исключением случаев поражения почек и применения диуретиков). Осмотическое давление плазмы сохраняется в норме, хотя зачастую бывает повышен уровень калия в крови. Возможно повышение показателя гематокрита.
Лечение изотонической дегидратации должно проводиться комплексно и состоять из противошоковых мероприятий с использованием электролитных и коллоидных растворов. Необходимо учитывать кислотность теряемых организмом жидкостей и коррегировать отклонения в кислотно-основном балансе. В случаях тяжелых кровопотерь показано переливание плазмы или цельной крови. Медикаментозное лечение должно способствовать нормализации деятельности сердечно-сосудистой системы.
Гипотоническая дегидратация характеризуется преобладанием дефицита электролитов, прежде всего катионов натрия, и дефицитом воды во внеклеточном секторе. Появление такого рода дефицита может быть связано:
· с недостаточным поступлением хлорида натрия в организм. Этот механизм необходимо принимать во внимание, так как ограничение приема поваренной соли может оказаться еще и разрешающим фактором в развитии гипотонической дегидратации при различных патологических состояниях, ведущих к потере электролитов;
· с потерей солей почечным путем при нарушении центральной или гуморальной регуляции (последствия энцефалитов, травм стволовой части головного мозга, поражения надпочечников, с проявлениями гипоальдостеронизма), при тубулярном нефрозе и других поражениях почек, при бесконтрольном применении диуретиков;
· с потерей изо- и гипоосмотических жидкостей и последующим возмещением их водой или безэлектролитными напитками (чай, газированные фруктовые воды и т.п.). Такая картина может сложиться в процессе работы в горячих цехах, сопровождаемой усиленным потоотделением, когда жажда утоляется чистой водой; при рвотах и поносах с восполнением потерь сладким чаем;
· с голоданием. Роль фактора, снижающего осмотическую концентрацию, играет при этом образующаяся эндогенно вода.
Первично возникающий дефицит электролитов и воды уменьшает объем внеклеточного сектора, а преобладание потерь солей обуславливает развитие гипотоничности. Это вторично вызывает смещение воды во внутриклеточный сектор и его «обводнение», усугубляя обезвоживание внутрисосудистого и интерстициального секторов. Таким образом, формируется состояние смешанной дисгидрии: внеклеточная дегидратация с внутриклеточной гипергидратацией. Понижение осмотического давления стимулирует антидиуретический и антинатрийуретический механизмы, которые компенсаторно вызывают снижение диуреза и уменьшение концентрации хлорида натрия в моче.
Клиническая картина складывается из симптомов внеклеточной дегидратации, гипергидратации клеток, в особенности ЦНС. Проявлением уменьшения объема и осмотического давления внеклеточной жидкости является сморщивание, потеря эластичности и снижение тургора кожи, мягкость глазных яблок. Разнообразны симптомы со стороны системы кровообращения. Отмечается тахикардия, недостаточное наполнение вен, снижение температуры тела и цианотичность кожи и слизистых оболочек. По мере нарастания тяжести дегидратации падает АД, вплоть до развития шока.
Внутриклеточная гипергидратации дает симптомы центрального генеза: апатию, ступор и нарушения сознания, обмороки, судороги. Характерно отсутствие жажды, или даже появление отвращения к воде.
Возникшая олигурия приводит к быстро нарастающей гиперазотемии. Осмотическое давление плазмы и содержание в ней натрия понижено.
Терапевтические мероприятия должны сводиться устранению дефицита электролитов и воды путем введения изо- или гипоосмотических растворов, содержащих глюкозу. В зависимости от кислотно-основного статуса организма используется либо хлорид, либо гидрокарбонат натрия. Введение избытка натрия может усилить обезвоживание: в связи с этим гипертонические растворы солей используют в исключительных случаях, когда развиваются неблагоприятные последствия снижения концентрации электролитов в плазме крови, когда нарушена реабсорбция натрия в почках или имеет место его потеря другими путями.
Гипотоническая гипергидратация характеризуется накоплением в организме воды без пропорциональной задержки электролитов. Ведущим механизмом в развитии «водного отравления» является преобладание положительного компонента водного баланса над выделением жидкости из организма. Причинами возникновения подобного дисбаланса могут быть:
· избыточное поступление воды в организм при ее повышенном потреблении или чрезмерно активном лечении дегидратации (в особенности сопряженной с потерями электролитов), бессолевыми жидкостями или напитками; картина усугубляется, если протекает на фоне ограниченной функции почек;
· острая почечная недостаточность при различных патологических состояниях и различные поражении почек, ведущие к анурии или олигурии;
· травмы и послеоперационные состояния, при которых в развитии гипотонической гипергидратации играют роль гиперсекреция вазопрессина, снижение выделительной функции почек, терапевтические инфузии бессолевых жидкостей и другие факторы;
· нарушения регуляции вводно-электролитного обмена, на фоне которых особенно легко развивается «водное отравление»: при повышении секреции вазопрессина, при недостаточности надпочечников;
· выраженная активация катаболизма при хронических заболеваниях, ведущих к истощению: голодании, туберкулезе, злокачественных опухолях, кахексии. Потери до 15% массы тела резко повышают потенциальную возможность развития гипотонической гипергидратации;
· сочетанное воздействие бессолевой диеты и диуретиков при лечении отеков, которое может перевести изотоническую гипергидратацию в «водное отравление».
Патофизиологические механизмы гипотонической гипергидратации связаны с первичным накоплением воды, происходящим во внеклеточном секторе и неподкрепляемом эквивалентным повышением содержания солей. Это в свою очередь приводит к гипоосмолярности экстрацеллюлярной жидкости и вызывает перемещение воды по осмотическому градиенту во внутриклеточный сектор, объем которого повышается. Гиперволемия тормозит продукцию альдостерона и тем самым уменьшает реабсорбцию натрия и хлора, что еще более усугубляет гипоосмолярность. В связи с этим возможно развитие гемолиза и нарушение мочеобразовательной функции почек.
Клинически проявляется главным образом в симптомах внутриклеточной гипергидратации, что сопровождается ухудшением самочувствия и нарастания массы тела. Неврологические и психические расстройства являются ведущими: у больных развивается апатия, сонливость, головная боль, анизокория, помрачение сознания, кома. Возможно появление мышечных подергиваний, тремора, судорог. Тошнота усиливается после приема пресной воды, а наступающая внезапно рвота не приносит облегчения. Жажда отсутствует, вплоть до отвращения к воде. Слизистые оболочки влажные.
В крови обнаруживается гипонатриемия, гипокалиемия и гипопротеинемия, снижается содержание гемоглобина и величина гематокрита. Осмотическая концентрация мочи понижена, часто отмечается олигурия. В тяжелых случаях развивается отек легких, гидроторакс, асцит.
Комплекс терапевтических мероприятий должен быть направлен на удаление избытка воды и восстановление осмотической концентрации. Это достигается полным запретом приема жидкостей (лечение жаждой), стимуляцией потоотделения (горячие аппликации, потогонные препараты), инфузией осмотических диуретиков. Острые проявления гипотонической гипергидратации могут быть устранены внутривенным введением гипертонических солевых растворов, однако это допустимо только при снижении общего количества солей в организме.
Гипертоническая гипергидратация характеризуется непропорциональной задержкой воды и электролитов во внеклеточном секторе, с преобладанием избытка последних. Это может наблюдаться:
· при энтеральном поступлении насыщенных солевых растворов (вынужденное питье морской воды);
· в некоторых ситуациях, связанных с нарушением функции почек;
· при острой почечной недостаточности, остром гломерулонефрите или при ограничении функциональной способности почек (в послеоперационном периоде), при введении изо- или гипертонических солевых растворов;
· при опухолях надпочечников, сопровождающихся избыточной продукцией альдостерона.
Патофизиологические механизмы гипертонической гипергидратации можно представить в следующей последовательности: преобладание задержки электролитов над накоплением воды во внеклеточном секторе, вызывая гиперосмолярность, приводит к перемещению воды из внутриклеточного сектора в интерстициальное пространство. Это создает внутриклеточную гипергидратацию и усугубляет картину внеклеточной гипергидратации, что способствует развитию отеков.
Клиническая картина характеризуется превалированием нейропсихических расстройств, обусловленных обезвоживанием нервных клеток. Это сочетается с симптомами гипергидратации и гиперосмолярности внеклеточного сектора. Больные неуравновешенны, беспокойны, возбуждены; возможно, помрачение сознания, развитие судорог, комы. Сильная жажда парадоксально сочетается с отеками, чаще нижних конечностей, но возможно также развитие отека легких. В плазме крови повышено содержание катионов натрия и осмотическое давление.
Терапевтические мероприятия должны быть направлены на восстановление внеклеточной изотонии и возвращение воды в клетки. Необходимо ограничить поступление солей в организм назначением соответствующей диеты и запрещением введения электролитных растворов. Повысить выведение солей из организма можно назначением салуретиков, белковых препаратов крови (плазма, альбумин крови). Перорально рекомендуется чистая вода, парентерально назначаются инфузии растворов сахаров без электролитов, предпочтительнее использование сорбитола или маннитола для стимуляции диуреза.
Изотоническая гипергидратация характеризуется пропорциональным накоплением воды и электролитов, то есть задержкой изотонической жидкости во внеклеточном секторе. Нарушение распределения жидкости во внеклеточном секторе при неизмененном или положительном водном балансе представляет собой патологический процесс, именуемый отеком – при задержке изотонической жидкости в интерстициальном секторе, или водянкой – при скоплении ее в трансцеллюлярном пространстве (асцит, гидроторакс, гидроперикардит и т.д.).
Отеки создают неблагоприятные условия для функционирования тканей, нарушая условия жизнедеятельности, затрудняя кровообращение и газообмен, механически сдавливая клетки и приводя в конечном итоге к их дистрофии и гибели. Нередко отеки сопровождаются отклонениями кислотно-основного и электролитного балансов, что усугубляет клиническую картину. Отечная жидкость нарушает структуру межуточной субстанции, расщепляет коллагеновые, эластиновые и ретикулярные волокна, влияет на проницаемость мембран микроциркуляторного русла. Отечная жидкость в легких вначале скапливается в межуточной ткани, а затем в альвеолах, формируя последовательно интерстициальный и альвеолярный отеки. В печени она распространяется по ходу портальных трактов и перисинусоидальных пространств, в почках – в строме мозгового вещества и т.д. Степень тяжести отека для организма определяется характером основного заболевания, интенсивностью развития и локализацией. В ряде случаев отеки и водянки могут представлять угрозу для жизни (отек гортани, легких, мозга, гидроцефалия и т.д.).
Отеки представляют собой нарушение равновесия в обмене воды между кровью, тканевой жидкостью и лимфой. Причины возникновения и развития отеков можно разбить на две группы: отеки, вызванные изменением факторов, определяющих местный баланс воды и электролитов и вторая группа – отеки, обусловленные регуляторными и почечными механизмами, приводящими к задержке натрия и воды в организме.
Развитию отеков способствуют следующие изменения факторов местного баланса воды и электролитов:
· рост внутрикапиллярного гидростатического давления, что может быть связано с локальными изменениями микроциркуляции, нарушениями венозного оттока при механическом сдавлении, тромбофлебитах или обусловлено нарушениями кровообращения при избыточных гемотрансфузиях, при право- или левожелудочковой недостаточности;
· снижение механического противодавления ткани процессу фильтрации при действии глюкокортикоидов, тормозящих образование коллагена;
· уменьшение онкотического давления плазмы вследствие потери белков при ожогах, при нефротическом синдроме, или вследствие нарушения их синтеза при заболеваниях печени, а также из-за снижения образования и повышенного распада белков при голодании;
· увеличение осмотического или онкотического давления тканевой жидкости, например, при активации катаболической фазы обмена в очаге воспаления;
· повышение проницаемости гистогематических барьеров при гипоксии, при действии эндогенных и экзогенных токсинов, или биологически активных веществ (гистамина, серотонина, нуклеотидных метаболитов и других соединений);
· нарушение лимфооттока как следствие рефлекторного спазма лимфатических сосудов при повышении давления в верхней полой вене, механическом сдавлении, после удаления лимфоузлов.
В развитии отеков важную роль играют общие механизмы регуляции водного баланса. При патологических состояниях различного генеза, когда ставится под угрозу такой важный параметр кровообращения как минутный объем сердца и в некоторых других ситуациях запускаются гормональные механизмы задержки натрия и воды. Механизмы активной задержки натрия включают катехоламины, ренин-ангиотензивную систему и альдостерон. Любой из них сам по себе усиливает задержку натрия, а также может включать и другие механизмы. Ангиотензин является важнейшим регулятором секреции альдостерона. Катехоламины и ангиотензин представляют инструмент быстрого реагирования для сохранения объема крови. Альдостерон – это механизм медленного, но более длительного срабатывания. Эта совокупность регуляторных воздействий имеет большее значение в фазе динамического нарастания отеков. В далеко зашедших случаях задержка натрия происходит за счет снижения клубочковой фильтрации, а повышение альдостерона – за счет снижения метаболизма кортикоидов в печени.
В зависимости от локализации и распространенности отеки подразделяются на общие и местные. Классификация отеков по патогенетическим механизмам затруднительна в связи с тем, что в реальных ситуациях возникновение их обусловлено, как правило, изменением нескольких факторов, комбинационное сочетание которых может меняться в зависимости от причин, вызывающих отеки. В клинической практике используется этиологическая классификация отеков, дающая возможность полно описать механизмы их развития и подходы к терапии. Наиболее распространенным является деление на сердечные, нефротические, кахектические, воспалительные, аллергические отеки, отеки при циррозе печени и ряд других.
В механизме развития сердечных, нефротических, кахектических и некоторых других отеков узловым моментом является нарушение гемодинамики, ведущее к гиповолемии и запуску гормональных механизмов задержки в организме катионов натрия и воды, которые перераспределяются в интерстициальный сектор. При сердечной недостаточности нарушения гемодинамики обуславливают центральную венозную гипертензию, ведущую к рассогласованию взаимодействия локальных факторов водного баланса внеклеточного сектора: появлению капиллярной гипертензии, повышению проницаемости сосудистой стенки вследствие гипоксии, нарушению лимфооттока, то есть реализуются механизмы застоя. Однако определяющими в развитии сердечных отеков являются нарушения кровообращения, что приводит к активации рении-ангиотензиновой системы, вторичному гиперальдостеронизму, избыточной продукции вазопрессина и как следствие всего этого – к задержке натрия и воды.
При гломерулонефритах имеет место уменьшение выведения натрия и воды ввиду снижения фильтрации в пораженных клубочках. Наряду с этим нарушение почечного кровотока запускает рении-ангиотензиновую систему со всеми вытекающими из этого последствиями. При нефротических и кахектических отеках пусковым механизмом выступает гипопротеинемия, обуславливающая перераспределение воды в интерстициальный сектор, а развивающиеся вследствие этого гиповолемия и нарушения гемодинамики запускают гормональные механизмы задержки натрия и воды. При кахексии картина усугубляется резким превалированием фазы катаболизма, что приводит к нарушению проницаемости клеточных и капиллярных мембран и повышает осмолярность внеклеточного сектора.
При циррозе печени первоначально развивается асцит, ведущим фактором, в механизмах которого является портальная гипертензия. На дальнейшее развитие отеков влияет снижение белоксинтезирующей функции печени, следствием чего является гипоальбуминемия. В последующем срабатывают механизмы гормональной задержки воды и натрия. Стабильность вторичного гиперальдостеронизма поддерживается нарушением метаболизма стероидных гормонов в гепатоцитах.
Местные отеки могут возникать под влиянием различных причин и, в частности, факторов, вызывающих повреждение ткани и развитие воспаления. В случае действия антигенов – аллергенов на предварительно сенсибилизированный организм развивается аллергический отек. При воспалении и аллергии главным механизмом, приводящим к отек является повышение проницаемости капиллярных мембран под влиянием гистамина, серотонииа, брадикинина, иммунных комплексов, токсинов, продуктов метаболизма, компонентов системы комплемент. Поддерживает отек в очаге воспаления возникающие нарушения микроциркуляции.
Принципиальные подходы к лечению отеков состоят в следующем:
· необходима эффективная терапия основного заболевания;
· должен быть установлен отрицательный водный и электролитный (по натрию) баланс. Для этого ограничивается количество воды и солей в рационе, используются диуретики, угнетающие реабсорбцию воды, и салуретики, оказывающие натрийуретический эффект;
· следует воздействовать на гормональные механизмы задержки натрия препаратами, снижающими эффект действия ангиотензина и альдостерона;
· с учетом патогенетических механизмов возникновения и развития отека возможно назначение белковых препаратов крови и кровезаменителей, повышающих коллоидно-осмотическое давление, капилляроукрепляющих средств. Лечение отеков должно проходить под постоянным контролем электролитного состава плазмы крови.
Патология минерального обмена.
Минеральные вещества (соли) входят в состав всех клеток и тканей тела и являются их необходимой составной частью. Солевой обмен тесно связан с водным обменом, поскольку большинство минеральных соединений находится в форме водных растворов. Часть минеральных веществ связана с белками и другими органическими соединениями. Нарушение минерального обмена определяется недостаточным поступлением и усвоением этих веществ, но может быть и следствием нарушения функции эндокринной системы (гипофиза, надпочечников, щитовидной и паращитовидных желез) или недостаточностью поступления с пищей некоторых витаминов (например, витаминов группы Д).
Нарушение обмена натрия и калия. Натрий и калий содержатся в организме преимущественно в виде ионов хорошо растворимых солей; эти элементы содержаться во всех тканях. Характерным является наличие большого количества натриевых солей (главным образом хлоридов, фосфатов и бикарбонатов натрия) во внеклеточных жидкостях – плазме крови, лимфе, ликворе, пищеварительных соках. Соли калия, напротив, преобладают в содержимом клеток. Обмен ионов натрия и калия тесно взаимосвязан. Нарушения обмена натрия тесно связаны с нарушением водного обмена: чем сильнее задержка натрия в организме, тем более выражена задержка воды.
Последствия гипонатриемии: понижается осмотическое давление внеклеточной жидкости, вода согласно закону осмоса поступает в клетки – клетки набухают, например, гипергидратация клеток мозга, почек, эритроцитов и соответственно нарушается функция этих клеток. Снижение в крови концентрации натрия ведет к мышечной слабости, ослаблению пульса, падению АД, вплоть до коллапса, что объясняется уменьшением потенцирующего действия натрия на действие адреналина. При значительной потере натрия наблюдается выход из клеток ионов калия, что нарушает деятельность сердца, скелетной и гладкой мускулатуры, развивается мышечная адинамия, потеря аппетита.
Последствия гипернатриемии: повышение осмотического давления крови и внеклеточной жидкости, в результате чего внутриклеточная жидкость переходит во внеклеточное пространство – возникает дегидратация клеток и их сморщивание, нарушение функции. Избыток натрия во внеклеточной жидкости способствует задержке воды и развитию отеку, а также развитию гипертонии, так как натрий потенцирует действие адреналина на гладкую мускулатуру артериол и способствует их сужению.
Гипокалиемия – понижение концентрации калия в крови возникает при недостаточном поступлении калия с пищей или в случае потери калия с пищеварительными соками при рвоте, поносах (концентрация калия в пищеварительных соках примерно в 2 раза выше, чем в плазме крови); усиленное выделение калия с мочой, приводящее к гипокалиемии может возникать при избыточной выработке альдостерона (гиперальдостеронизм), так как избыток альдостерона тормозит реабсорбцию калия в почках. Последствия гипокалиемии: происходит изменение потенциала нервных и мышечных клеток и снижение их возбудимости, что ведет к гипорефлексии, мышечной слабости, понижению моторики желудка и кишечника, снижению сосудистого тонуса. Тяжелая гипокалиемия и связанные с ней расстройства энергетического обмена в почечной ткани ведут к нарушению в канальцах почек процессов реабсорбции и секреции различных веществ (воды, сахара, солей и др.).
Гиперкалиемия – повышение концентрации калия в плазме крови выше 6 ммоль/л – более опасна, чем калиемия. Когда концентрация калия в плазме достигает 8 – 13 ммоль/л, возможна смерть в результате «калиевой интоксикации», возникающей вследствие понижения выведения калия почками и усиленного тканевого распада, ведущего к освобождению тканевого калия. Она может произойти даже от быстрого переливания значительных количеств крови, так как выход калия из эритроцитов может иметь место путем диффузии без явлений их гемолиза. Клинически калиевая интоксикация проявляется в парестезиях, сердечной слабости, аритмиях; угрожающими признаками калиевой интоксикации являются коллапс, брадикардия, помрачение сознания. В случае летального исхода смерть наступает от остановки сердца в фазу диастолы желудочка.
Нарушение обмена магния.
Магний является вторым по концентрации катионом внутриклеточной среды, основная часть магния входит в состав костной ткани, и он в известной степени является антагонистом кальция. Он необходим для действия некоторых ферментов, катализирующих распад углеводов, а также для действия фосфатаз. Половина магния находится в скелете.
Гипермагниемия возникает при потреблении пищи, богатой магнием (фасоль, горох, пшено и др.), при явлениях ацидоза и нарушении выделения магния почками (уремия). При этом развивается депрессия и сон.
Гипомагниемия встречается при панкреатите, вследствие нарушения всасывания магния. Клинически проявляется тетанией.
Нарушение обмена железа и микроэлементов.
Нарушение обмена железа.
Недостаток железа в организме возникает либо в результате недостаточного поступления его с пищей, либо нарушения всасывания в стенке тонкой кишки. Нарушение всасывания железа возникает при недостатке соляной кислоты и витамина С, которые необходимы для перевода 3-валентного железа пищевых продуктов в 2-валентную форму, участвующую в обменных процессов. Наличие в просвете кишки соединений, связывающих железо (фосфаты, фитин и др.) также затрудняют всасывание его в кишечной стенке. Воспалительный процесс, избыток муцина на слизистой оболочке кишечника также затрудняют всасывание. Недостаток железа, прежде всего, отражается на кроветворении и приводит к развитию гипохромной анемии.
Избыток железа в крови приводит обычно к отложению железистых соединений в тканях. Возможно поступление и отложение окислов 3-валентного железа в легких – сидероз, что в дальнейшем приводит к развитию пневмосклероза. Чаще в организме встречается отложение эндогенного железа в виде гемосидерина, освобождающегося при массивных разрушениях эритроцитов. Оно может быть местным (на месте кровоизлияний в результате травмы) или общее (при заболеваниях, связанных с внутрисосудистым разрушением эритроцитов, при гемолитических анемиях, пернициозной анемии, желтухах). Гемосидерин при этом откладываются в клетках ретикуло-эндотелиальной системы, паренхимы печени, в извитых канальцах почек, в эпителии поджелудочной железы, клетках надпочечников и др.
Нарушение обмена меди. В процессе кроветворения обмен железа тесно связан с обменом меди. Медь способствует депонированию в печени железа, использованию его для синтеза гемоглобина и таким образом стимулирует кроветворную функцию костного мозга. Поэтому в результате недостаточности меди в организме уменьшается всасывание и использование железа, что ведет к развитию гипохромной и микроцитарной анемии; а также может способствовать развитию сахарного диабета (медь ингибирует инсулиназу) и кариеса зубов.
Обычно основная масса меди из крови попадает в печень, где образуется соединение белка с 6 атомами меди – церулоплазмин. При недостаточности фермента, осуществляющего включение меди в активный центр церулоплазмина в печени, медь переходит в кровь и соединяется с аминокислотами. Комплекс меди с аминокислотами является плохо растворимыми соединениями и откладываются в ряде тканей – чечевидном ядре мозга, клетках печени, селезенки, сетчатки глаза. Возникают дегенеративные изменения в органах, светобоязнь, аминоацидурия. Заболевание это носит название – гепатолентикулярная дегенерация.
Нарушение обмена кобальта. Кобальт также является важным фактором в процессе кроветворения. Он играет роль катализатора, способствующего более быстрому переходу депонированного железа в состав гемоглобина. Кобальт оказывает стимулирующее действие на образование эритроцитов, созревание нормобластов и поступление зрелых форм эритроцитов в циркулирующую кровь. Недостаточность кобальта (недостаточное поступление его с пищей, неполное всасывание его в тонкой кишке, нарушение комплексирования кобальта с бета-глобулином) в организме ведет к развитию гипохромной и пернициозной анемии. Избыток кобальта - к полицитемии и изменению продукции глюкагона.
Нарушение обмена цинка. Цинк входит в состав многочисленных ферментов (карбоксипептидаза, карбоангидраза, трансфосфорилаза, уриказа, дегидрогеназа) и гормонов (поджелудочной железы – инсулин, возможно – гормонов половых желез и гипофиза). Будучи связан с ферментами, гормонами, витаминами он оказывает значительное влияние на важнейшие жизненные процессы – развитие и рост организма, размножение, кроветворение, обмен белков, жиров и углеводов. При дефиците цинка возможна инсулиновая недостаточность и значительные нарушения обмена веществ, нарушаются процессы окостенения – снижается активность остеобластов, в результате возникает деминерализация костей.
Нарушение обмена марганца: недостаток марганца приводит к остеопорозу, нарушению функции половых желез. Избыток марганца вызывает поражение центральной нервной системы (паркинсонизм).
Нарушение обмена фтора. Основная биологическая роль фтора связана с его участием в процессе развития зубов и костеобразования. Избыточное поступление фтора в организм приводит к развитию флюороза, который характеризуется появлением крапчатости эмали, при более тяжелых формах – в хрупкости зубов. Избыток фтора может быть и причиной остеопороза. Недостаток фтора наряду с нехваткой молибдена и других микроэлементов способствует развитию кариеса зубов.
Избыток молибдена в почве и пищевых продуктах способствует эндемическому развитию подагры
Минеральные дистрофии - это количественные и качественные структурные изменения в клетках и/или межклеточном веществе органов и тканей, обусловленные нарушением минерального обмена.
Нарушение обмена кальция в тканях организма называют обызвествлением.
В зависимости от преобладания общих или местных факторов в развитии кальцификации различают три формы обызвествления:
1 - метастатическое;
2 - дистрофическое;
3 - метаболическое.
Метастатическая кальцификация возникает при увеличении концентрации кальция или фосфора в крови (гиперкальциемия). Кальцификация происходит наиболее часто в стенках артерий, альвеолярных перегородках легких, в слизистой оболочке желудка, в миокарде левого желудочка и в почках. Причины метастатического обызвествления связаны с усиленным выходом солей кальция из депо и с пониженным выведением солей кальция из организма. Исход неблагоприятен: выпавшие соли практически не рассасываются.
При кальцификации почечного интерстициума (нефрокальциноз) может возникать хроническая почечная недостаточность. Обширная кальцификация кровеносных сосудов может приводить к ишемии, особенно в коже. Редко при обширном повреждении легочных альвеол возникают нарушения диффузии газов. Кроме этих случаев, кальцификация не нарушает функции паренхиматозных клеток в тканях.
При дистрофическом обызвествлении (петрификации) метаболизм кальция и фосфора не нарушен. Их уровень концентрации в сыворотке крови нормальный. Кальцификация происходит в результате местных нарушений в тканях. Отложения солей кальция имеют местный характер и обычно обнаруживаются в тканях омертвевших или находящихся в состоянии глубокой дистрофии. Основная причина дистрофического обызвествления - физико-химические изменения тканей, сопровождающиеся ощелачиванием среды в связи с усиленным потреблением кислорода и выделением углекислоты, изменением свойств белковых коллоидов (коагуляцией белка) и усилением активности фосфатаз. В таких тканях появляются разных размеров очаги каменистой плотности - петрификаты.
Метаболическое обызвествление (интерстициальный кальциноз). Механизм его развития до конца не ясен. Главное значение придают нестойкости буферных систем (pH и белковые коллоиды) крови и тканевой жидкости, в связи с чем кальций не удерживается в них даже при его невысокой концентрации, часто играет роль наследственная предрасположенность.
Интерстициальный кальциноз различают:
1 - системный;
2 - ограниченный.
Примером интерстициального системного кальциноза служит опухолеподобный кальциноз. Интерстициальный ограниченный кальциноз, или известковая подагра, характеризуется отложением солей кальция в виде пластинок в коже рук, реже - ног. Исход неблагоприятен: выпавший кальций обычно не рассасывается или рассасывается с трудом.
Имеют значение распространенность, локализация и характер обызвествления.
Витамин D встречается в двух формах: эргокальциферол (витамин D2) и холекальциферол (витамин D3). Содержится в печени тунца, трески, палтуса, желтке яиц, молоке. Природный провитамин D2 - эргостерин (растительного происхождения), D3 - 7-дегидрохолестерин (животного происхождения). Под влиянием фотоизомеризации они превращаются в соответствующие витамины. Витамин D можно отнести к прогормонам. 7-дегидрохолестерин в коже под воздействием ультрафиолетового облучения превращается в холекальциферол, в печени - в кальцифедиол, а в почках - в кальцитриол. Кальцитриол является гормоном по своим свойствам и регулирует обмен кальция. Кацифедиол - циркулирующий метаболит холекальциферола. Синтетические аналоги кальцитриола - кальцинотриол (псоркутан), эргокальциферола - альфа-кальцидол.
Витамин D всасывается в тощей и подвздошной кишке в присутствии желчи, в лимфе связывается с липопротеидами хиломикронов. В печени переносится с липопротеидов на глобулины. Накапливается в костях, печени, мышцах.
При введении кальциферолов потеря солей кальция и фосфора с калом быстро сокращается, а содержание их в крови возрастает. При этом холекальциферол обладает выраженной мембранной активностью (повышает проницаемость мембран кишечного эпителия, облегчая чрезмембранные транспорты катионов кальция и других двухвалентных катионов), а эргокальциферол активирует кальцийсвязывающий белок. Усиление всасывания фосфатов - это вторичный процесс. Все это приводит к возрастанию концентрации ионов кальция и фосфатов в крови, усилению их захвата костной тканью, стимуляции процессов оссификации. В обмене кальция и фосфора принимают участие паратгормон и тиреокальцитонин. Холекальциферол также тормозит пролиферацию кератоцитов кожи и активирует их дифференцировку.
Гиповитаминоз D у детей проявляется рахитом: нарушается обызвествление костей, происходит деформация конечностей, грудной клетки, головы, задержка появления зубов, возникают гипотония, нарушения в развитии ребенка, поражения ЦНС.
При гипервитаминозе D (избыточное поступление витаминов D2 и D3) происходит деминерализация костей. Содержание кальция в крови увеличивается, он выделяется с мочой. Возникает патологическое отложение кальция в почках, сосудах, сердце, легких, кишечнике с нарушением функции этих органов. Механизм токсического действия витамина D заключается в следующем: избыток витамина подвергается быстрому окислению с образованием свободных радикалов и продуктов переоксидации ненасыщенных жирных кислот. Эти продукты в водной среде являются сильными окислителями, легко повреждающими структуру липопротеидных мембран клетки и субклеточных структур. В этом случае избыток витамина D способствует выходу кальция из клетки и переходу его в кровь, лимфу и другие биологические жидкости. Токоферол (витамин Е), являющийся сильным биологическим антиоксидантом, тормозящим самопроизвольные процессы перекисного окисления ненасыщенных липидов, снимает токсическое действие избытка витамина D. При хроническом отравлении витамином D наблюдаются общая и мышечная слабость, тошнота, апатия, сонливость, угнетение сознания, жажда, боль в животе, поносы, гипертермия, тахикардия, дегенеративные изменения в миокарде и другие нарушения. Лечение гипервитаминоза: ретинол, тиамин, кислота аскорбиновая.
Тема 4. Патология теплорегуляции. Лихорадка
Становление в эволюции гомойотермии (температурный гомеостаз) шло по пути совершенствования теплопродукции (химическая теплорегуляция), но особенно – теплоотдачи (физическая терморегуляция). Физическая терморегуляция формируется, прежде всего, в связи с возникновением и развитием нервно-сосудистых образований, усложнением нервной системы и появлением центра терморегуляции.
Теплопродукция осуществляется в большей мере в мышцах и в меньшей – в висцеральных органах. Выделяют сократительный и несократительный термогенез. Сократительный термогенез обеспечивается произвольными мышечными движениями, мышечной дрожью (непроизвольные подергивания отдельных мышечных групп) и сокращением гладких мышц кожи («гусиная кожа»). Несократительный термогенез обеспечивается обменом веществ, интенсивность которого во многом зависит от действия гормонов (катехоламинов, тироксина, трийодтиронина).
Теплоотдача осуществляется следующими путями:
- теплоизлучением – радиационная теплоотдача,
- конвекцией – движением и перемешиванием воздуха вокруг поверхности тела,
- теплопроведением – отдачей тепла при соприкосновении,
- испарением.
Теплоотдача этими путями во многом определяется интенсивностью кровотока в сосудах кожи: при переходе, например, от холода к теплу теплоотдача с поверхности кожи увеличивается в десятки раз за счет расширения микрососудов кожи и возрастания скорости кровотока. Наибольшее значение для человека имеет испарение.
Соотношение теплопродукции и теплоотдачи, т.е. тепловой баланс, обеспечивается работой центра терморегуляции (совокупность терморегулирующих нейронов), который расположен в преоптической области гипоталамуса около дна III желудочка, хотя и другие отделы ЦНС, начиная с сегментарных центров спинного мозга и кончая корой большого мозга, участвуют в терморегуляции. Установлено, что термочувствительные нейроны («холодовые» и «тепловые») расположены преимущественно в предзрительном поле передней гипоталамической области, куда поступает информация от периферических (поверхностных и глубоких) терморецепторов. Эта зона обладает и непосредственной чувствительностью к температурным колебаниям. Роль задней гипоталамической области заключается в том, что здесь происходит интеграция температурной информации и формирование эффекторных стимулов, управляющих физической и химической терморегуляцией. Разрушение ее или всего гипоталамуса делает животных пойкилотермными. При разрушении передней гипоталамической области способность лихорадить через некоторое время восстанавливается.
Роль центра терморегуляции заключается в том, чтобы сохранять температурный гомеостаз, уравновешивая процессы теплопродукции и теплоотдачи. Это возможно благодаря тому, что центр терморегуляции работает как кибернетическое устройство в точно заданном режиме и колебания температуры (суточные) допускаются только в узких пределах от «установочной точки». Таким образом, организм теплокровных представляется как биологический термостат, температура которого целиком зависит от того, на какую точку поставлен терморегулятор, т.е. соответствующий центр мозга. Эта установочная точка может быть изменена в двух случаях: либо при чрезвычайном воздействии (перенагревание, гипотермия, замерзание, гипоксия), когда этот механизм полностью или частично выводиться из строя, либо при действии пирогенов, когда установочный механизм не разрушается, а изменяется так, что установочная точка перемещается на более высокий уровень.
На основании тонких электрофизиологических исследований этот механизм представляется следующим образом. В гипоталамическом центре терморегуляции имеются нейроны трех типов: чувствительные к теплу, чувствительные к холоду и «глухие» к колебаниям температуры. Допускают, что главную роль играют последние. Они генерируют сигналы стандартного характера, которые служат сигналом сравнения для термочувствительных нейронов. Если под влиянием пирогена меняется функция термочувствительных нейронов, то это приводит к изменению сигнала сравнения и, следовательно, точки температурного гомеостаза, который этот сигнал определяет.
Есть и другое объяснение формирования установочной температуры. Оно состоит в том, что установочная точка определяется первичным состоянием функций теплочувствительных и холодочувствительных нейронов. С помощью микроэлектронной техники было показано, что под влиянием пирогена активность холодочувствительных нейронов повышается, а теплочувствительных – снижается. В связи с этим понижается порог чувствительности центра терморегуляции к холоду и нормальная температура воспринимается, как пониженная. Тогда перекрываются пути отдачи тепла, температура тела повышается и на этом уровне остается некоторое время (на период лихорадки).
Кроме пирогенов в формировании лихорадочной реакции определенную роль играют и другие вещества, прежде всего гормоны. Сами гормоны лихорадки не вызывают, но, оказывая влияние на центр терморегуляции, они модулируют его работу, т.е. настраивают на иной лад, повышая или понижая его чувствительность к пирогенам. При тиреотоксикозе инфекционные заболевания обычно протекают с более высокой температурой. У лиц с пониженной функцией щитовидной железы или гипофиза сопутствующие инфекционные заболевания сопровождаются менее выраженной лихорадкой. При этом надо иметь в виду, что тироксин не только повышает чувствительность теплового центра к пирогенам, но и оказывают разобщающее действие на окисление и окислительное фосфорилирование в тканях. Гликокортикоиды (кортизол) тормозят развитие лихорадочной реакции вследствие того, что они ингибируют метаболические процессы в лейкоцитах, и в том числе образование в них пирогенов.
В процессе эволюционного развития лихорадочная реакция сложилась, прежде всего, как ответ на проникновение в организм микроорганизмов и их токсинов.
Лихорадка - это общая неспецифическая защитная реакция организма, возникающая при действии пирогенов, характеризуется повышением температуры тела вследствие перестройки центров терморегуляции на новый уровень функционирования.
Источники тепла в организме:
- первичная теплота (химическая теплопродукция);
- вторичная теплота;
- первичная теплота - то тепло, которое образуется в результате метаболизма.
Вторичная теплота - то тепло, которое образуется в результате работы органов и тканей. Важный источник тепла - работа скелетных мышц в виде произвольной мышечной деятельности, мышечной дрожи и терморегуляции мышечного тонуса (не сокращение мышц, а мелкие вибрации мышечной мембраны).
Механизмы теплоотдачи:
1 - прямой контакт;
2 - конверсия (через среду, через воздух). В отдаче тепла важен тонус сосудов кожи. Расширение сосудов способствует теплоотдаче.
3 - радиация (излучение тепла) - с поверхности тела идут электромагнитные волны инфракрасного диапазона.
4 - испарение со слизистых оболочек при дыхании (у человека не особенно важен), с участием потовых желез - самый эффективный путь теплоотдачи. Вода обладает высокой теплоемкостью. С одним метром пота выделения одна треть суточной продукции тепла организмом - 2400 кДж.
Пирогены - этиологические факторы лихорадки, вещества, вызывающие лихорадочную реакцию. Различают экзопирогены (попадают в организм извне) и эндопирогены (вырабатываются в организме). Экзопирогены различают инфекционной природы и неинфекционные. Инфекционные пирогены: липополисахариды оболочек бактерий - компонент бактериального эндотоксина. Термостабильные, не обладают видовой специфичностью, возможно развитие к ним толерантности. Слабой пирогенной активностью обладают бактериальные белки: стафилококковые, стрептококковые токсины. Слабой пирогенной активностью обладают вирусы, простейшие. Неинфекционные экзопирогены: лекарственные препараты, чужеродные белки. Эндопирогены вырабатываются в собственных клетках организма (нейтрофилах, моноцитах, макрофагах) под влиянием эндопирогенов. Эндопирогены - белки с молекулярной массой 1,5=40 тыс. Дальтон, они термолабильны, обладают видовой специфичностью, к ним не формируется толерантность. Эндопирогены образуются под влиянием лимфокинов - биологически активных веществ лимфоцитов. Стимулятором образования эндопирогенов является интерлейкин. Процесс образования эндопирогенов может быть индуцирован также другими веществами, в том числе гормонами
Этапы развития лихорадки.
1 – Первичные пирогены – попадают в организм вместе с возбудителем, образуются в собственных тканях организма.
2 – Синтез лейкоцитарных (вторичных) пирогенов - ЛП, нейтрофильные гранулоциты, макрофагоциты.
3 – Проникновение ЛП через кровь и спинномозговую жидкость в мозг.
4 – Действие на нейроны передней гипоталамической области.
5 – Перестройка центра терморегуляции, ограничение теплоотдачи и увеличение теплопродукции.
6 – Повышение температуры тела до новой установочной точки, на которой продолжается поддержание температурного гомеостаза.
Стадии лихорадки
Лихорадочный процесс всегда протекает в три стадии:
I стадия (st. incrementi) - стадия повышения температуры.
II стадия (st. fastigii) - стадия снижения температуры.
III стадия (st. decrementi) - стадия снижения температуры.
Стадия повышения температуры.
Подъем температуры в этой стадии отражает перестройку терморегуляции: уменьшается теплоотдача, увеличивается теплопродукция. Теплоотдача уменьшается в результате сужения периферических сосудов и уменьшения притока теплой крови к тканям, торможения потоотделения и снижения испарения, сокращения мышц волосяных луковиц ("гусиная кожа"). Увеличение теплопродукции достигается за счет активизации обмена веществ в мышцах на фоне повышенного тонуса мышц и мышечной дрожи. Мышечная дрожь связана со спазмом периферических сосудов, уменьшение притока крови приводит к снижению температуры кожи на несколько градусов. Терморецепторы возбуждаются, возникает ощущение голода - озноб. В ответ на это центр терморегуляции посылает эфферентные импульсы к двигательным нейронам - возникает дрожь. Одновременно увеличивается образование тепла в органах (печень, легкие, мозг) в результате трофического действия нервов на ткань, когда активируются ферменты, увеличивается потребление кислорода и выработка тепла. Влияние гуморального фактора в разбалансировании теплового гемостаза: в гипоталамусе вырабатывается тиреотропипрелизит - фактор, который стимулирует образование в гипофизе тиреотропного гормона и выработку серотонина щитовидной железой. В результате усиливается обмен веществ, возникает набухание митохондрий и разобщение дыхания и фосфорилирования - увеличивается теплопродукции.
Стадия стояния повышенной температуры.
После того как температура поднялась на определенный уровень, она в течение некоторого времени (дни, часы) остается там. Увеличение теплоотдачи стабилизирует температуру на определенном уровне. Включение теплоотдачи осуществляется благодаря расширению периферических сосудов, (бледность кожи изменяется ее гиперемий, кожа горячая на ощупь, возникает чувство жара). Поддержание температуры на повышенном уровне объясняется тем, что под влиянием лейкоцитарного пирогена меняется установочная точка центра терморегуляции. По степени повышения температуры различают следующие ее виды:
А) субфебрильная - повышение температуры до 38 °С;
Б) умеренная - 38-39 °С;
В) высокая - 39-41 °С;
Г)гиперпиретическая - выше 41 °С.
Стадия снижения температуры.
Связана с уничтожением пирогенов. После прекращения действия пирогенов центр терморегуляции приходит в прежнее состояние, установочная точка температуры опускается до нормального уровня. За счет расширения сосудов кожи, обильного потоотделения и частого дыхания образовавшееся в организме тепло выводится. Варианты снижения температуры:
а) литическое (lisis) - постепенное, в течение нескольких часов;
б) критическое (krisis) - быстрое. Опасно, т. к. может произойти слишком резкое расширение сосудов и опасный для жизни коллапс.
Защитная роль лихорадки:
1) повышенная температура тела препятствует размножению многих микроорганизмов; понижает их устойчивость к лекарственным препаратам. В связи с этим повышение температуры (пиротерапия) эффективно используют для лечения костно-суставного туберкулеза;
2) при повышении температуры усиливаются обменные процессы в организме, и многие токсические вещества разрушаются в "метаболическом котле";
3) при лихорадке активируется фагоцитоз;
4) увеличивается содержание в крови защитных веществ - белков: лизоцим, интерферрон, пропердин, комплимент;
5) активируются механизмы общего адаптационного синдрома;
6) активируется симпатоадреналовая система, увеличивается сердечный выброс;
7) улучшается кислородтранспортная функция эритроцитов;
8) усиливается выброс крови из депо;
9) стимулируется гемопоэз;
10) активируется антитоксическая функция печени.
Гипертермия.
Повышение температуры может возникнуть при действии на организм некоторых физических и химических факторов. Прежде всего это действие высокой температуры окружающей среды (жаркий климат, горячие цеха). В этих условиях после истощения компенсаторных возможностей температура тела начинает повышаться, возникает гипертермия, которая не имеет ничего общего с лихорадкой. При лихорадке терморегуляция активно направлена на повышение температуры, при перегревании же организм сопротивляется этому. Лихорадка создается самим организмом, гипертермия – вопреки ему. Гипертермию вызывают некоторые лекарственные средства (кофеин, фенамин, адреналин, стрихнин и др.), которые влияют на процессы образования тепла или теплоотдачу. Перегревание может наступить при химических, механических и других воздействиях на ЦНС. Центрогенное повышение температуры может быть при травме головного мозга, при лечении электрошоком. Вероятно, при этом нарушается функция центра терморегуляции и повышение температуры возникает без воздействия пирогенов.
Перегревание (гипертермия) – временное повышение температуры тела, возникающее в результате нарушения механизма терморегуляции и несоответствия процессов теплоотдачи и теплообразования.
В условиях повышения температуры и влажности воздуха отдача тепла из организма в окружающую среду затруднена и может совершаться только при напряжении механизмов физической терморегуляции (расширение периферических сосудов, усиление потоотделения). При повышении температуры воздуха до 33С (что равно температуре кожи) отдача тепла путем проведения и излучения становиться неэффективной и совершается только путем испарения, а при повышении влажности воздуха затрудняется и этот путь отдачи тепла. При таких обстоятельствах нарушается равновесие между образованием тепла в организме и его отдачей во внешнюю среду, что приводит к задержке тепла и перегревании. Тот период перегревания, который характеризуется сохранением нормальной температуры тела, называется стадией компенсации. Перенапряжение терморегуляции приводит к ее истощению, а наступающее вслед за этим повышение температуры тела свидетельствует о наступлении второго периода – стадии декомпенсации. Повышение температуры тела сопровождается резким возбуждением ЦНС, дыхания и кровообращения, усилением обмена веществ. Дальнейшее повышение температуры тела и перевозбуждение нервных центров могут закончиться их истощением, нарушением дыхания, функции сердца и снижением АД. Развивается гипоксия.
Обильное потоотделение имеет и отрицательные последствия – обезвоживание, нарушение электролитного обмена (потеря хлоридов). Сгущение крови и повышение ее вязкости создают дополнительную нагрузку на аппарат кровообращения и способствуют развитию недостаточности сердца. На фоне нарастающих явлений кислородного голодания появляются судороги, наступает смерть. Острое перегревание с быстрым повышением температуры тела носит название теплового удара.
Солнечный удар по клинической картине напоминает тепловой удар: повышение температуры тела, возбуждение нервной системы, преходящее в ее угнетение, нарушения кровообращения и дыхания. Однако этиология и патогенез их отличается. При солнечном ударе этиологическим фактором являются тепловые солнечные лучи, действующие на непокрытую голову. Дополнительным фактором является высокая температура воздуха, способствующая перегреванию. Несмотря на то что кожа и кости черепа задерживают большое количество солнечных лучей, некоторая их часть (инфракрасные лучи) могут проникать внутрь и оказывать повреждающее действие на мозговые оболочки и нервную ткань. Определенное значение имеет и действие ультрафиолетовых лучей солнечного спектра, которые освобождают из клеток биологически активные амины, способствуют расщеплению белка и образованию полипептидов, а последние рефлекторным или гуморальным путем также могут стать фактором, повреждающим мозговые оболочки и нервную ткань.
Гипотермия (общее охлаждение организма) представляет собой нарушение теплового баланса в организме, приводящее к понижению температуры тела. Гипотермия возникает в случаях, когда вследствие внешнего охлаждения усиливается отдача тепла выше обычных пределов при нормальной теплопродукции, либо когда резко понижается теплопродукция или при сочетании обоих этих факторов. В развитии гипотермии различают две стадии. Сначала, несмотря на низкую температуру окружающей среды, температура тела не снижается, а поддерживается на исходном уровне благодаря включению компенсаторных реакций, обусловливающих перестройку терморегуляции. Этот период охлаждения называется стадией компенсации. Из большого разнообразия терморегуляторных приспособлений в первую очередь включаются механизмы физической терморегуляции, направленные на ограничение теплоотдачи. Отдача тепла в окружающую среду совершается путем излучения, конвекции, проведения и испарения. В условиях холода теплоотдача ограничивается благодаря спазму сосудов кожи и уменьшению потоотделения. Этих реакций, неправленых на уменьшение отдачи тепла, может быть достаточно для сохранения температуры тела.
При более интенсивном и продолжительном действии холода включаются механизмы химической терморегуляции, направленные на увеличение теплопродукции. Появляются мышечная дрожь, усиливается обмен веществ, увеличивается распад гликогена в печени и мышцах, повышается содержание глюкоз в крови. Потребление кислорода увеличивается, усиленно функционируют системы, обеспечивающие доставку кислорода к тканям. Обмен веществ не только повышается, но и перестраивается. Дополнительный выход энергии в виде тепла обеспечивается как за счет усиления окислительных процессов, так и за счет разобщения окисления и сопряженного с ним фосфорилирования. Этот механизм способствует экстренному согреванию, однако, как известно, связан с уменьшением количества макроэргов, необходимых для осуществления функций. Следовательно, разобщение окисления и фосфорилирования не может обеспечить длительную адаптацию к холоду и тем более активную деятельность в условиях холода. Последнее может быть достигнуто путем увеличения мощности митохондральной системы. Биогенез этих органелл связан с активацией генетического аппарата клетки, увеличением синтеза нуклеиновых кислот и белка.
Сложная перестройка в организме, обеспечивающая постоянство температуры тела в условиях холода, происходит при участии нейрогуморальных регуляторных механизмов, которые схематически можно представить следующим образом. Терморецепторы кожи воспринимают холодовое раздражение и по чувствительным путям посылают импульсы в гипоталамус, где расположен центр терморегуляции, и в высшие отделы ЦНС. Отсюда в обратном направлении поступают сигналы к различным органам и системам, принимающим участие в поддержании температуры тела. По двигательным нервам импульсы поступают к мышцам, в которых развивается терморегуляторный тонус и дрожь. По симпатическим нервам возбуждение достигает мозгового вещества надпочечников, где усиливается секреция адреналина. Адреналин способствует сужению периферических сосудов и стимулирует распад гликогена в печени и в мышцах. Важным фактором является включение в терморегуляцию гипофиза, а через его тропные гормоны – щитовидной железы и коры надпочечников. Гормон щитовидной железы повышает обмен веществ, разобщает процессы окисления и фосфорилирования, а также активизирует биогенез митохондрий. Гликокортикоиды стимулируют образование углеводов из белков.
В условиях длительного или интенсивного действия холода возможно перенапряжение и истощение механизмов терморегуляции, после чего температура тела снижается и наступает вторая стадия охлаждения – стадия декомпенсация, или собственно гипотермия. В этом периоде кроме снижения температуры тела отмечается снижение обменных процессов и потребления кислорода; жизненно важные функции угнетены. Нарушение дыхания и кровообращения приводит к кислородному голоданию, угнетению функций ЦНС, снижению иммунологической реактивности. В тяжелых случаях возможны необратимые изменения в тканях, влекущие за собой смерть. Во второй стадии гипотермии тесно переплетены явления патологические и приспособительные. Более того, одни и те же сдвиги, являясь, с одной стороны, патологическими, с другой стороны могут быть оценены как приспособительными. Например, угнетение функций ЦНС можно назвать охранительными, так как понижается чувствительность нервных клеток к недостатку кислорода и дальнейшему снижению температуры тела. Снижение обмена в свою очередь уменьшает потребность организма в кислороде. В состоянии гипотермии организм становится менее чувствительным к самым разнообразным неблагоприятным воздействием внешней среды – недостатку кислорода и пищи, интоксикации, инфекции, поражающему действию электрического тока, перегрузкам и т.д.
Искусственная гипотермия (гибернация) – контролируемое снижение температуры тела до заданных величин, необходимое для проведения сложных операций на жизненно важных органах (мозг, сердце, легкие). Данное состояние создается при помощи физического охлаждения на фоне применения фармакологических препаратов, блокирующих проведение нервных импульсов.
Тема 5. Экстремальные и терминальные состояния
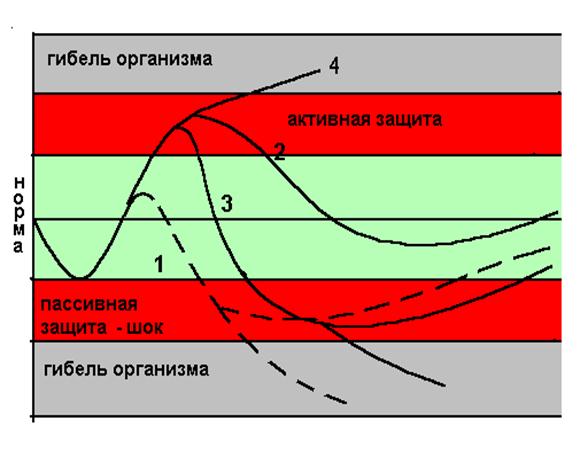
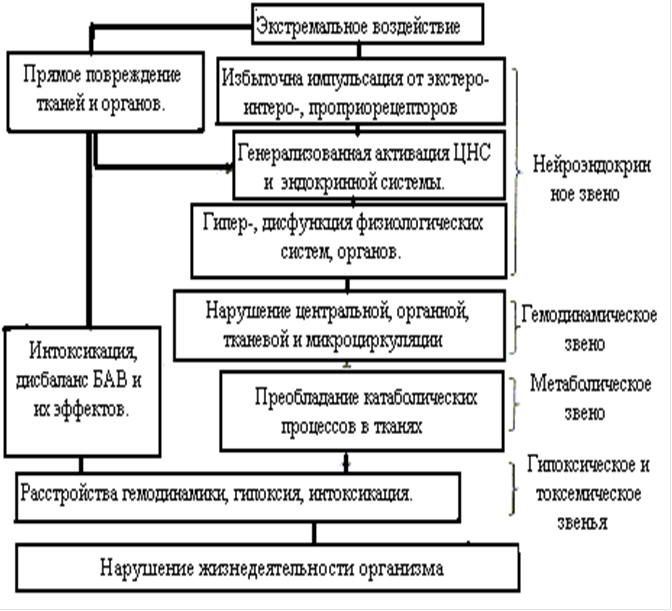
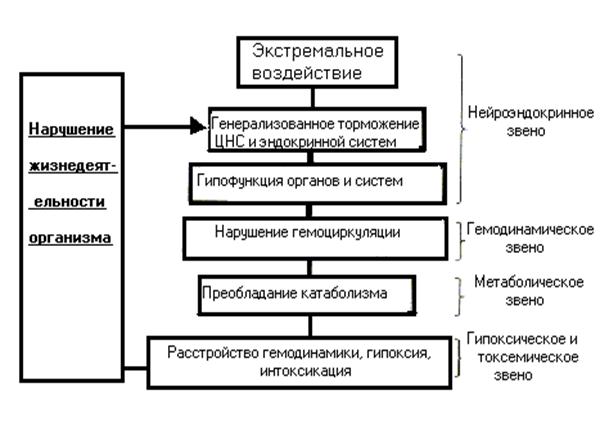
Под экстремальными (лат. extremus – крайний, предельный) состояниями организма понимают такие состояния, которые возникают под влиянием сильных (чрезвычайных) патогенных воздействий и характеризуются предельным напряжением защитных реакций организма. Такие состояния могут возникать вследствие внешних воздействий и при неблагоприятном течении различных заболевания. К наиболее часто встречающимся экстремальным состояниям относятся стресс, кома и шок. Для патогенеза экстремальных состояний характерно развитие цепных патологических реакций, усугубляющих возникшие в организме расстройства («порочных кругов»). Экстремальные состояния, в принципе, самостоятельно обратимы. Организм обладает приспособительными механизмами, препятствующими включению «порочных кругов» или вызывающими их «обрыв», тем самым, предупреждая самоуглубления повреждений. Однако они, как правило, требуют неотложных и эффективных лечебных мероприятий.
Стресс представляет собой неспецифический компонент адаптации, который играет мобилизирующую роль и обуславливает привлечение энергетических и пластических ресурсов для специфической адаптационной перестройки различных систем организма.
Основоположник учения о стрессе Ганс Селье (1907 – 1983) – врач по образованию, биолог с мировым именем, директор Института экспериментальной медицины (с 1976г. Международный институт стресса) в Монреале – на протяжении почти пятидесяти лет разрабатывал проблемы общего адаптационного синдрома и стресса.
Селье экспериментально доказал, что при введении неочищенных и токсичных вытяжек из желез возникал стереотипный набор одновременных изменений в органах. Этот синдром включал:
1) увеличение и повышенную активность коры надпочечников;
2) сморщивание или атрофию вилочковой железы и лимфатических узлов;
3) появление язвочек желудочно-кишечного тракта.
В дальнейшем весь этот комплекс изменений в организме получил название классической триадой Г. Селье.
Развитие стресса во времени Селье разделил на три стадии:
1) реакцию тревоги, для которой характерно уменьшение размеров тимуса, селезенки и лимфатических узлов, количества жировой ткани, появление язв желудка и кишечника, исчезновение эозинофилов в крови и гранул липидов в надпочечниках. Под действием очень сильных стрессоров (тяжелые ожоги, крайне высокие или крайне низкие температуры) организм может погибнуть уже на этой стадии.
2) стадию резистентности, возникающей, если действие стрессора совместимо с возможностями адаптации, которая характеризуется практически полным исчезновением признаков реакции тревоги; уровень сопротивляемости организма значительно выше обычного.
3) стадию истощения.
Если стрессор слабый или же прекратил свое действие, то стадия резистентности продолжается длительное время или организм приспосабливается, приобретая новые свойства. Если стрессорный фактор является чрезвычайно сильным или же действует длительно, то развивается стадия истощения. Вновь появляются признаки реакции тревоги, но теперь они необратимы, что приводит к гибели организма.
По мнению Селье, важную роль в реакциях стресса играли гормоны. Экстренное выделение адреналина – это лишь одна сторона острой фазы первоначальной реакции тревоги в ответ на действие стрессора. Для поддержания гомеостаза столь же важна ось гипоталамус – гипофиз – кора надпочечников, представляющей собой координированную систему, которая состоит из гипоталамуса, который связан с гипофизом, регулирующим активность коры надпочечников. Стрессор возбуждает гипоталамус, продуцируется вещество, дающее сигнал гипофизу выделять в кровь адренокортикотропный гормон (АКТГ). Под влиянием АКТГ корковый слой надпочечников выделяет кортикоиды. Это приводит к сморщиванию вилочковой железы и многим другим сопутствующим изменениям – атрофии лимфатических узлов, торможению воспалительных реакций и продуцированию глюкозы (легкодоступный источник энергии). Другая типичная черта стрессорной реакции – образование язвочек в желудочно-кишечном тракте. Их возникновению способствует высокое содержание кортикоидов в крови, но и автономная нервная система также играет роль в их появлении.
Стрессорная реакция у человека возникает благодаря сложному взаимодействию нейроэндокринной системы. Сигнал о каком-то воздействии мгновенно поступает в кору головного мозга, оттуда информация передается в гипоталамус. Именно в гипоталамусе расположены высшие координирующие и регулирующие центры вегетативной и эндокринной систем; здесь чутко улавливаются малейшие нарушения, возникающие в организме. Под гипоталамусом находится гипофиз, который относится к эндокринной системе. Гипофиз синтезирует целый ряд гормонов, некоторые из которых влияют на деятельность других эндокринных желез. К тропным гормонам относятся АКТГ, который воздействует на кору надпочечников; тиреотропный гормон, который регулирует функцию щитовидной железы, и гонадотропные гормоны, которые стимулируют функцию половых желез. Кроме того, гипофиз синтезирует гормоны, которые непосредственно воздействуют на организм, например, гормон роста (соматотропный гормон) и пролактин. Синтез и отдача гормонов гипофиза регулируются гормонами гипоталамуса, которые попадают в гипофиз через особые, соединяющие эти отделы кровеносные сосуды. Оказалось, что в гипоталамусе существуют особые клетки, выделяющие сложные химические соединения, так называемые рилизинг-факторы (реализующие факторы).
Стресс-реакция может проявляться в виде двух синдромов:
1) генерализованного адаптационного синдрома – ГАС (общий адаптационный синдром – ОАС);
2) местного адаптационного синдрома – МАС.
Генерализованный адаптационный синдром.
Стрессор, действуя на организм, помимо специфических изменений запускает начальную реакцию, которая состоит в выработке неспецифического стимула. Это может быть нервный импульс, химическое вещество или недостаток незаменимого метаболического фактора. Этот первый медиатор, в конечном счете, действует на гипоталамус и, в частности, на срединное возвышение. Это действие регулируется посредством нервных стимулов, поступающих от коры головного мозга, ретикулярной формации и лимбической системы (в частности, гипокампа и миндалевидного комплекса). Клетки гипоталамуса действуют как «преобразователи», трансформирующие нервные импульсы в гуморальный передатчик – кортикотропин-релизинг-фактор – КРФ. КРФ достигает передней доли гипофиза и стимулирует секрецию кортикостероидов, главным образом, таких как кортизол или кортикостерон. С этими гормонами связаны следующие эффекты:
Похожие работы
... новые возможности, которые возникали с появлением новых методов исследования, позволяли делать открытия, радикально менявшие взгляды на патологию, начинать качественно новые этапы её развития. Патологическая анатомия использует три основных метода исследования — вскрытие трупов людей, умерших от болезней (1); микроскопические методы изучения тканей (2); эксперимент, позволяющий моделировать на ...
... , а не просто отсутствие болезни или физических дефектов. Здоровье- оптимум функционирования организма как целостной системы. Определение ключевых понятий общей патологии: Нозология - учение о болезни. Болезнь - качественно новое по отношению к здоровью состояние организма, возникающее при нарушении генетической программы или действии болезнетворных факторов среды, характеризующееся нарушением ...
... и Sadov четко и ясно обозначили имеющееся противоречие во взглядах на исследуемые экстремальные состояния, в мире так и не существует единой позиции по этому вопросу. Например, российские ученые склонны считать острую массивную кровопотерю геморрагическим шоком, а не коллапсом, в то время как за рубежом понятия «шок» и «коллапс» не разграничиваются. Этому способствует и тот факт, что в настоящее ...
... что и пневмосклероз, и приобретенные бронхоэктазы развиваются вследствие дискретного (разового, однократного) патологического процесса, не противоречит тому, что больные с хронической бронхолегочной патологией предрасположены к такому течению. Закономерной стадийности нет. Осложнения. Вздутие легких - следствие обструктивного процесса в мелких бронхах. Самыми характерными признаками хронической ...

0 комментариев