Навигация
Кислотно-основное равновесие
Министерство образования Российской Федерации
Пензенский Государственный Университет
Медицинский Институт
Кафедра Терапии
Реферат
на тему:
«Кислотно-основное равновесие»
Выполнила: студентка V курса
Проверил: к.м.н., доцент
Пенза
2008
ПЛАН
Введение
1. Механизмы поддержания КОС
2. Методика забора крови для исследования КОС и характеризующие его показатели
3. Нарушения КОС, их профилактика и коррекция
Литература
ВВЕДЕНИЕ
Кислотно-основное состояние (КОС) крови и других биологических жидкостей - один из важных компонентов гомеостаза организма, характеризующийся концентрацией водородных ионов [H+], которая зависят от соотношения между водородными и гидроксильными ионам, между кислотами и основаниями. Оно определяет стабильность протекания основных физиологических процессов в организме. Основные биохимические реакции в клетках и в их окружении достигают максимума при определенных значениях активной реакции среды. Концентрация иона Н+ [H+] поддерживается в очень узком диапазоне (36-43 нМоль/л, в среднем 40 нМоль/л или 0,00004 ммоль Н+/л). При выходе за пределы ниже 10 и выше 100 нМоль/л происходит необратимая денатурация белковых структур ферментов. Внутриклеточная концентрация [H+] в 4 раза выше внеклеточной. Концентрацию водородных ионов характеризует рН крови, который колеблется в пределах 7,35-7,45.
1. МЕХАНИЗМЫ ПОДДЕРЖАНИЯ КОС
В процессе метаболизма образуются кислые продукты: 1) летучие – СО2 около 15000 ммоль/сут (0,13 ммоль/кг * мин-1); 2) нелетучие - Н+ около 30-80 ммоль (1 ммоль/кг* сут-1); 3) молочная и пировиноградная (при окислении углеводов), серная, фосфорная, мочевая кислоты, аминокислоты (при окислении белков), β-оксимасляная, ацетоуксусная, жирные кислоты, кетокислоты (при окислении жиров).
Для своей защиты от них и поддержания постоянства КОС, организм использует системы быстрого реагирования – буферные системы и системы медленного реагирования - физиологические системы, связанные с дезинтоксикацией промежуточных и выделением конечных продуктов обмена.
Основными буферными системами крови являются: 1) гемоглобиновая – KHb / HHb (35-76% буферной емкости); 2) карбонатная – NaHCO3 / H2CO3 (13-35% буферной емкости); 3) белковая – Вбелок / Нбелок (7-10% буферной емкости); 4) фосфатная – NaHPO4 / NaH2PO4 (1-5% буферной емкости).
Они представлены в виде слабой кислоты и солью этой кислоты. Основными буферными системами являются: в клетках – белковая и фосфатная, во внеклеточном пространстве – карбонатная. Гемоглобиновая буферная система активна как в клеточном, так и во внеклеточном пространстве.
Буферные системы крови, представляя только 1/5 общей буферной емкости организма, при дистрессе не могут поддерживать КОС на нормальном уровне. Поэтому при истощении буферных систем для поддержания КОС начинают активизироваться физиологические системы медленного реагирования: 1) легкие (удаление или задержка СО2); 2) почки (выделение Н+ или НСО3- , реабсорбция НСО3-); 3) печень (нейтрализация окислением); 4) желудочно-кишечный тракт – ЖКТ (выделение Н+, НСО3-) и др.
В историческом аспекте оценку КОС осуществляли различными способами в зависимости от применяемых технических средств, технологий и концепций.
Сначала ее проводили с помощью уравнения Гендерсона-Гессельбаха (Henderson-Hasselbalch):
рН = logКа + log [Н2 СО3] / [НСО3-] = 6,1 + log 25,0/1,25.= 6,1 + 1,3 = 7,4
где: logКа - логарифм константы диссоциации угольной кислоты при 380С.
Затем датский ученый О. Зигаард-Андерсон (Sigaard-Andersen) сформулировал оперативный метод контроля КОС циркулирующей крови на основании определения рН в пробах крови, насыщенных двумя кислородно-углекислыми смесями (обычно с концентрацией СО2 около 4% и 8%) и актуального значения рН данного образца крови.
К концу 50-х годов прошедшего столетия глава центральной больничной лаборатории в Копенгагене Пол Аструп (Paul Astrup) ввел в практику быстродействующие рН-метры фирмы Radiometer, получившие название Astrup MicroEguipment (микрометод Аструпа). Определив три величины рН в одной пробе и построив график на специальной номограмме Зигаарда-Андерсена, можно получить истинную концентрацию аниона гидрокарбоната (АВ) в плазме крови и производные показатели: сумму буферных оснований (ВВ), избыток оснований (ВЕ), стандартный бикарбонат (SB).
В 1954 г. американский физиолог Ричард Сноу (R. Snow) сообщил о создании полярографического электрода для прямого измерения РСО2, который был усовершенствован в 1958 г. американским анестезиологом и инженером Джоном Северингхаусом (J. Severinghause). О. Зигаард-Андерсен разработал другую линейную номограмму, с помощью которой, проведя прямое определение рН и РСО2, можно определить показатели КОС. В дальнейшем, используя компьютерную технику, можно было получить показатели КОС, исключив не только эквилибрирование крови эталонными газовыми смесями, но и номограммы.
В 1956 г. американский биохимик и физиолог Л.С. Кларк (L. Clark) разработал полярографический электрод для определения РО2. К 1960 г. появились первые приборы для клинического мониторинга газов крови и КОС.
В 70-е годы внедрены в практику оптодные технологии измерения и регистрации рН, РСО2 и РО2. Высокая точность измерения и небольшой диаметр датчика позволяла вводить его в сосудистое русло и получать непрерывную информацию о КОС.
В начале 80-х годов Питер Стюарт (P.A. Stewart) опубликовал новую концепцию КОС с изложением физико-химического подхода к его физиологии. Она предпочтительна в современной клинической физиологии, так как ни избыток оснований, ни концентрация бикарбоната в плазме крови, в том числе и стандартного, не всегда могут объяснить природу нарушений КОС у больного. Концепция Стюарта позволяет выявить причины многих расстройств КОС и более рационально подойти к их устранению. Согласно этой концепции, все водные растворы в организме человека представляют собой неистощаемый источник Н+. В этих растворах [Н+] определяется диссоциацией воды на Н+ и ОН- ионы. Данный процесс происходит в соответствии с законами физической химии: электронейтральностью (сумма всех положительно заряженных ионов равна сумме отрицательно заряженных ионов) и сохранению масс (количество вещества в данном растворе остается постоянным, если оно не добавляется или производится, не удаляется или разрушается).
В норме в плазме существует равновесие между катионами (Na+, K+, Ca++, Mg++) и анионами (Cl -, НСО3-, белки, остаточные анионы). Оно равно 153 ммоль/л и представлено в диаграмме Гэмбла. При истощении бикарбонатных буферных оснований их место занимают органические кислоты, в результате чего создается несоответствие между концентрацией Na+ и суммой НСО3- и Cl-. Появляется так называемый анионный интервал (АИ). В норме он составляет 12.4 ммоль/л.
Сущность подхода Стюарта заключается в том, что в плазме величина концентрации ионов водорода (формирование КОС) зависит от 3-х переменных величин: а) РСИ -разницы концентрации сильных ионов (между суммой концентрации Na+, K+, Ca++, Mg++ с одной стороны, и Cl- + лактат, с другой); б) РаСО2; в) Аобщ – общей концентрации недиссоциированных (АН+). и диссоциированных (А-) слабых кислот.
Содержание Н+ и НСО3- меняется лишь при изменении одного из этих трех показателей. Поэтому для того чтобы узнать, как организм регулирует рН, необходимо представлять, чем обусловлен их сдвиг.
Например, у больного со стенозом привратника вследствие потери с желудочным содержимым соляной кислоты (HCl) развивается гипохлоремический метаболический алкалоз иногда с выраженной клинической симптоматикой. Увеличение РСИ происходит вследствие потери такого сильного аниона как Cl-, без значимой потери сильного катиона. Когда ион водорода теряется как вода (НОН), а не как HCl-, изменений в РСИ не будет, и поэтому не измениться [H+]. Для коррекции алкалоза предпочтительно введение хлористо-водородной кислоты в растворе. На фоне алкалоза большое количество калия переходит в клетки, оставляя значительную часть Cl- в плазме крови, что приводит к значительному снижению РСИ. Раствор Рингер-лактата более физиологичен, чем 0,9% NaCl, так как РСИ их соответственно равны 28 и 0 мэкв/л.
Похожие работы
... солевой формы белка при этом незначительно увеличивается, а "белка – кислоты" – эквивалентно уменьшается. И поэтому рН практически не изменится. Таким образом, рассмотренные системы показывают, что буферное действие раствора обусловлено смещением кислотно-основного равновесия за счет связывания добавляемых в раствор ионов Н+ и ОН- в результате реакции этих ионов и компонентов буферной системы с ...
... с водорастворимым полимером порфирин приобретает растворимость в водной среде, что позволяет избежать модификации его молекулы ионогенными группами. Н2ТЛФП марки х.ч. использовали без дополнительной очистки. Химически связанный с полиметакриловой кислотой Н2ТАФП (И2ТАФП — ПМАК) получали реакцией взаимодействия порфирина с ПМАК, содержащей ~1% хлорангидридных групп [8]. Введение цетильных групп в ...
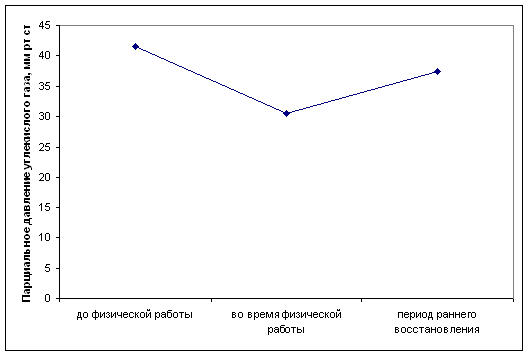
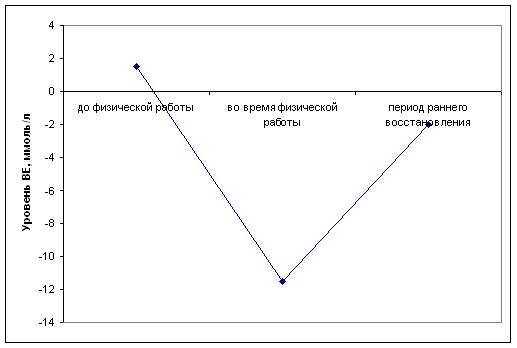
... определенной физической нагрузки связано с состоянием тренированности спортсмена. Накопление молочной кислоты в крови при выполнении физической работы ведет к развитию метаболического ацидоза, который клинически характеризуется снижением рН. В спортивной практике важно определять показатели КОС при стандартной и предельной физической работе с целью оценки адаптивных возможностей организма ...
... Н+ - это протон, т.е. атом водорода без своего орбитального электрона; Н+ в водном растворе присутствует как гидроксид-ион или Н3О +. Присоединение и отдача Н+ лежит в основе кислотно-щелочной химии. На сегодняшний день принята теория кислотно-щелочного отношения Бренстеда. Кислоты - вещества, которые в растворах отдают ионы водорода, т.е. являются донорами Н+. ( NH4+ - Н+ + NH3). Основания - ...





0 комментариев