Навигация
Рентгенография органов грудной клетки, обзорная в 3х проекциях - измерение размеров различных отделов сердца;
2. Рентгенография органов грудной клетки, обзорная в 3х проекциях - измерение размеров различных отделов сердца;
3. Функциональные исследования органов:
- Электрокардиография- оценка состояния коронарного кровообращения, выявление ишемии сердца;
- ЭХОдопплерокардиография - с определением объема полостей сердца, ударного и минутного объемов;
- Велоэргометрия - показания: определение толерантности больного к физической нагрузке (определение функционального класса);
- Дуплекс БЦС - состояние сосудов бронхиального дерева;
- УЗИ внутренних органов;
- УЗИ щитовидной железы;
Результаты лабораторных исследований· Общий анализ крови от 28.10.2008:
Гемоглобин 140 г/л
Эритроциты 4,5x10¹²/л
Цветной показатель 0,94
СОЭ 7 мм/ч
Тромбоциты 270х10 /л
Лейкоциты 4,4х10 /л
Ретикулоциты 0,9%
| Эозинофилы | Базофилы | Миелоциты | Метамиелоциты | Палочкоядерные | Сегментоядерные | лимфоциты | моноциты |
| 2 | - | 0 | 0 | 1 | 57 | 32 | 8 |
Вывод: в общем анализе крови патологических отклонений не наблюдается
· Общий анализ крови от 5.11.2008:
Гемоглобин 139 г/л
Эритроциты 4,5x10¹²/л
Цветной показатель 0,9
СОЭ 5 мм/ч
Тромбоциты 270х10 /л
Лейкоциты 5,5х10 /л
Ретикулоциты 0,8 %
Эозинофилы | Базофилы | миелоциты | Метамиелоциты | Палочкоядерные | Сегментоядерные | лимфоциты | Моноциты |
| 4 | 1 | 0 | 0 | 5 | 61 | 25 | 4 |
Вывод: в общем анализе крови патологических отклонений не наблюдается
· Общий клинический анализ мочи от 28.10.2008:
Количество: 90 мл
Плотность: 1012 мг/л
Цвет: соломенно-желтый
Прозрачность: полная
Реакция: кислая
Белок: отрицательно
Лейкоциты: 2-3 кл. в поле зрения
Эритроциты: 0 кл. в поле зрения
Эпителиальные клетки: 2-4 кл. в поле зрения
Слизь: -
Соли: оксалаты
Вывод: в обшем клиническом анализе мочи патологических отклонений не выявлено
· Биохимический анализ крови от 28.10.2008:
Билирубин общий: 13,4 мкмоль/л (N до 20,5 мкмоль/л)
Натрий сыворотки: 137 ммоль/л
Калий сыворотки: 4,0 ммоль/л
Мочевина: 8.1 ммоль/л
К- 3,7
Na- 136
Тимоловая проба: 2,5 Ед
Формоловая проба: отр
АлАТ: 0,19 мкмоль/л
АсАТ: 0,19 мкмоль/л
Вывод: В биохимическом анализе крови отмечается незначительное повышение концентрации мочевины, что может быть связано с нарушение фильтрационной способности почек.
· Анализ крови на сахар от 28.10.2008: 4,5 ммоль/л
Вывод: патологических отклонений не выявлено.
· Липидограмма от 28.10.2008:
Общий холестерин: 6,0 ммоль/л
ЛПВП: 0.70 ммоль/л
ЛПНП: 4,44 ммоль/л
ЛПОНП: о,45 ммоль/л
Вывод: В анализе крови на липиды видим повышение холестерина, ЛПНП, сниженное количество ЛПВП, все это свидетельствует об атеросклероза.
· Исследование крови на RW:
RW - отр.
· Исследование крови на группу и резус фактор:
группа крови: А(II). Rh --
· Рентгенограмма органов грудной клетки28.10.2008:
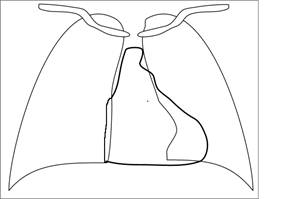
Описание: На обзорной рентгенограмме грудной клетки в прямой проекции определяется следующее. Трахея расположена по центру. Ключицы расположены симметрично. Ребра имеют косое направление, позвоночник без деформаций. Правый купол диафрагмы на 2 см выше левого. Ткань легких нормальной рентгенологической плотности. Легочной рисунок усилен в центральных отделах. Определяется незначительное расширение корней легких. Тени сосудов верхних долей по диаметру меньше таковых нижних долей. Косто-диафрагмальные синусы свободные. Значительно расширена дуга левого желудочка и достигает точки среднеключичной линии, помимо этого определяется расширение дуг легочного ствола и левого предсердия. Правый желудочек не увеличен, его тень достигает правой парастернальной линии. Сердце аортальной конфигурации.
Вывод: со строны органов дыхания патологических изменений не выявлено, определяется гипертрофия левых отделов сердца - сердце аортальной конфигурации
Функциональные методы исследования
· ЭКГ от 28.10.2008:
Описание: Синусовый ритм, ЧСС 60 в’, R1>R2>R3- левограмма, депрессия сегмента ST на 1-2 мм в I, II, AVL, V2 –V4 , высокий и широкий Т.
Вывод: Ритм нормальный, нормокардия, признаки гипертрофии левого желудочка, ишемия переднебоковых отделов миокарда, трофические нарушения в миокарде.
· Ультразвуковое исследование органов брюшной полости от 28.10.2008:
Печень: нормальных размеров, эхогенность не изменена
Желчный пузырь: нормальных размеров, эхогенность не изменена
Общий печеночный проток: не изменен
Печеночные вены: не изменены
Воротная вена: не изменена
Селезенка: не увеличена, не изменена, однородна
Поджелудочная железа: не изменена, эхогенность диффузно повышена
Почка:
Слева: нормальной локализации и эхогенности, расширения ЧЛС нет.
Справа: нормальной локализации и эхогенности, расширения ЧЛС нет.
Конкременты в обеих почках, небольшое количество.
Вывод: Отмечаются изменения в стенке желчного пузыря, конкременты в его просвете, диффузные изменения поджелудочной железы. Конкременты в обеих почках.
· ЭХО Доплеро кардиографическое исследование от 30.10.2008:
ЛП: 45 ммц
КСР: 32 мм
КСО: 37 мл
КДР: 51 мм
КДО: 124 мл
ЧО: 62 мл
ФВ: 62% по Тейхольцу
Масса миокарда: 654 г
Митральный клапан: неизменен
Створки изменены умеренно, подвижность ограничена, подклапанные сращения нет, кальциноз 3.
Отверстие: округлое, площадь 5 см²
Градиент давления: 5 мм рт ст.
Умеренная регургитация
Артальный клапан: изменен, кальциноз 3-4
Открытие: ограниченно, 14 мм
Градиент давления: 36 мм рт ст
Регургитация небольшая
Аорта в основании: 41 мм, уплотнена
ПП: не увеличено
ПЖ: 22 мм
Легочной клапан: не изменен, физиологическая регургитация
Легочная артерия: не расширена
Трехстворчатый клапан: не изменен, створки не изменены, открытие N, градиент давления 3,5 мм рт ст, небольшая регургитация
МЖП:20,6 мм
ЗСЛЖ:19,4 мм
Перикардиального выпота нет
Заключение: Из данных ЭХО кардиографии видно: небольшой стеноз и недостаточность аортального клапана. Выраженный кальциноз фиброзного кольца и сворок митрального клапана. Гипертрофия левого желудочка, небольшая делятация левого предсердия. Аорта уплотнена. Сердце до 39 мм.
Вывод: Увеличение левого предсердия (45см). Значительное увеличение массы левого желудочка говорит о его гипертрофии, это можно подтвердить увеличением ЗСЛЖ-19,4 мм, МЖП-20,6 мм. Гипертрофию левых отделов сердца можно обьяснить тем, что пациент в юности занимался спортом.Уплотнение аорты говорит о атерогенном процессе.
· УЗИ щитовидной железы 30.10.2008:
Расположение: обычное.
| Правая доля: дл. | 52 мм. | Толщ. | 17 мм. | Ширина: | 22.2 мм. | V: | 9.40 см | V: | 17.0 см |
| Левая доля: дл. | 51 мм. | Толщ. | 15.5 мм. | Ширина: | 20 мм. | V: | 7.60 см | ||
| Перешеек: | 2 мм. |
Контуры: четкие ровные.
Эхогенность: не изменена.
Эхоструктура: однородная.
При ЦДК васкуляризация ткани: обычная.
Лимфоузлы: не лоцируются.
Заклучение: без структурных изменений.
Клинический диагноз
На основании проведенных дополнительных лабораторных и инструментальных методов исследования предворительный диагноз подтверждается:
На ЭКГ от 28.10.2008. Ритм нормальный, нормокардия, признаки гипертрофии левого желудочка, ишемия переднебоковых отделов миокарда, трофические нарушения в миокарде. Эти результаты подтверждают предварительный диагноз: ИБС, стенокардия.
На ренгенограмме: со строны органов дыхания патологических изменений не выявлено, определяется гипертрофия левых отделов сердца - сердце аортальной конфигурации, что говорит о развитии вышеуказанного осложнения заболевания у больного.
На основании жалоб больной на боли в коленных суставах, усиливающиеся при физических нагрузках, периодически возникающую припухлость, нарушение подвижности, артроз коленного сустава в анамнезе, можно поставить диагноз: двухсторонний деформирующий гонартроз, медленно прогрессирующее течение.
Т.о. основываясь на вышеперечисленном, можно поставить следующий клинический диагноз:
ИБС: стенокардия напряжения II ФК, ХСН IIA, II ФК. Хронический гастрит, ремиссия. Двухсторонний деформирующий гонартроз, медленно прогрессирующее течение.
Дифференциальный диагноз
Ведущим симптомом при стенокардии являются боли различного характера с иррадиацией, чувство тяжести, дискомфорта, поэтому следует проводит дифференцировать с:
1. С вегетативным кардионеврозом: У таких больных часто имеются другие вегетативные нарушения, иногда достаточно выраженные. Около половины больных жалуются на боли в перикардиальной зоне. У них часто возникает неадекватная лабильность, драматическое преувеличение своих ощущений. Боль усиливается после психоэмоционального и физического перенапряжения, но не проходит в покое, после приема нитроглицерина.
2. Ревматизм: Жалобы на пребои в работе сердца, одышку, постоянную потливость. Возраст поражаемых молодой- 7-15 лет. Частые ОРЗ в анамнезе, возникает после перенесенной ОРЗ через 2-3 недели. После которого резко повышается температура тела. Так же диагностическими признаками ревматизма считаются симметрическое поражение крупных суставов, что не характерно для стенокардии. Лабораторные данные: нейтрофилия, фибриногенемия. Изменения в иммунограмме.
3. Дистрофия, воспаление, поражение левого плечевого сустава или дополнительное шейное ребро, а так же синдром передней лестничной мышцы (остеохондроз шейного отдела): Боль усиливается при движении в левом плечевом суставе, возникают парастезии с по левой руке. Эти симптомы сочетаются с поражением (сдавлением артерий и вен).
4. Воспаление реберных хрящей: Болезненная припухлость в области хрящей ребер, в месте прикрепления 3-4 ребра слева. Припухлость не распространяется на сочленение ребер с хрящом. Боль иррадиирует по ходу ребра, иногда в шею, плечо, усиливается при нагрузке.Определяется при непосредственной пальпации. На R-грамме обнаруживается пятнистость неправильной формы, кальцификации хряща.
Этиология
Этиология ИБС - это, в первую очередь, этиология атеросклероза. В образовании и развитии атеросклеротической бляшки участвуют три основных фактора: стенка артерии, липиды сыворотки и свертывающая система крови.
Для понимания механизма образования бляшки необходимо представить нормальное строение и функционирование артерии. Артерия состоит из трех четко различающихся слоев. Внутренняя оболочка (tunica intima)- тонкий непрерывный пласт эндотелия, толщиной в одну клетку, выстилающий просвет артерии на всем ее протяжении. При рождении интима содержит единичные гладкомышечные клетки (ГМК), количество которых с возрастом увеличивается. Эндотелиальные клетки находятся на основной - "базальной"- мембране, включающей коллагеновые волокна с особым типом протеогликановых молекул. С возрастом в мембране увеличивается количество коллагена, эластических волокон и интимальных ГМК. В норме плоские эндотелиальные клетки создают барьер, препятствующий попаданию различных веществ из крови в артериальную стенку. Необходимые вещества проникают в клетки посредством специфических транспортных систем. Неповрежденный эндотелий коронарных артерий препятствует образованию сгустков крови за счет выделения ряда простагландинов (простациклин), окиси азота, подавляющих функцию тромбоцитов, способствуя тем самым нормальному кровотоку. Средняя оболочка (tunica media) ограничена внутренней ("базальной") и наружной мембраной, которые состоят из фенестрированных элластических волокон, с большим количеством довольно широких каналов, которые позволяют проникать различным веществам в любом направлении. Состоит средняя оболочка из клеток одного типа - спиралеобразных ГМК, прилегающих друг к другу. Каждая из них окружена мембраной, вкраплениями коллагеновых волокон и протеогликанов. ГМК обладают способностью вырабатывать в большом количестве коллаген, эластические волокна, растворимый и нерастворимый эластин, протеогликаны и являются основным источником соединительной ткани в артериальной стенке. Здесь происходит множество анаболических и катаболических процессов. ГМК способны метаболизировать глюкозу посредством как аэробного, так и анаэробного гликолиза. В них содержатся разнообразные катаболические ферменты, включая фибринолизины, оксиданты со смешанными функциями, лизосомные гидролазы. Питание tunica media получает из мелких кровеносных сосудов (vasa vasorum) наружной оболочки, а внутренние слои - непосредственно из просвета сосуда. Наружная оболочка (tunica adventitia) - поверхностный слой артериальной стенки. Со стороны просвета сосуда она ограничена внешней (наружной) эластической мембраной.
Адвентиция является коллагеновой структурой, состоящей, из огромного количества коллагеновых фибрилл, собранных в пучки, элластических волокон и большого количества фибробластов вместе с ГМК. Это высоко васкуляризированная ткань, в том числе, несущая в себе много нервных волокон.
Наряду с указанными процессами, следует учитывать возможности таких физиологических факторов, как процессы переноса через эндотелиальный слой, поступление кислорода и различных субстратов как из просвета сосуда, так и со стороны наружной оболочки, а также обратный ток продуктов метаболизма. Определяемые в сыворотке крови общие липиды состоят из целого ряда отдельных липидов (липоидов). К ним относятся нейтральные жиры (триглицериды), холестерин и фосфолипиды (фосфаты). К классу общих липидов принадлежат жирные кислоты и сфигмомиелин. ХС и ТГ являются основными, циркулирующими в крови липидами. ХС используется в клеточном синтезе и репарации, а также для продукции стероидных гормонов. ТГ используются мышечными клетками в качестве источника энергии и накапливаются в виде жира в жировой ткани. Клетки артериальной стенки способны синтезировать жирные кислоты, холестерин, фосфолипиды и триглицериды, необходимые для удовлетворения своих структурных потребностей (восстановление мембран), используя для этого эндогенные субстраты. Липиды обладают гидрофобными свойствами, нерастворимы в воде и существуют в сыворотке крови только в комплексе с белками. Нерастворимые в воде неэстерифицированные жирные кислоты связаны с альбуминами и этот комплекс растворим в плазме крови. ХС, ТГ, фосфолипиды также связаны с отдельными белковыми компонентами и глобулинов крови и образуют липопротеидные комплексы - липопротеиды (ЛП). Комплексируясь с белковыми молекулами, липиды солюбилизируются и в таком виде транспортируются в кровотоке. В несколько упрощенном виде ЛП можно представить себе как некую сферическую структуру с наружной солюбилизированной оболочкой, состоящей из белка и фосфолипидов с внутренним гидрофобным ядром, сформированным из ТГ и ХС. Белок и фосфолипиды дают липидам растворимость. Связь между находящимся внутри липидом и белковой оболочкой осуществляется за счет слабых водородных связей и является довольно рыхлой. Это позволяет обеспечивать свободный обмен липидов между сывороточными и тканевыми липопротеидами и тем самым осуществлять транспорт липидов в ткани- мишени. Выделено 4 класса основных ЛП: хиломикроны, ЛП низкой плотности (ЛПНП), липопротеиды очень низкой плотности (ЛПОНП) и ЛП высокой плотности (ЛПВП). Такая классификация основана на различиях в поведении ЛП при ультрацентрифугировании и соответствует отдельным фракциям, выявляемым при электрофоретическом анализе. ЛП транспортируют липиды в крови от одного места к другому. Хиломикроны транспортируют ТГ пищи из кишечника к мышцам и жировой ткани. ЛПОНП - транспортируют ТГ, синтезируемые в печени, из печени к мышцам и к жировой ткани. ЛПНП - транспортируют холестерин из печени к периферическим тканям. ЛПВП транспортируют ХС от периферических тканей к печени, причем на этом пути происходит деэстерификация части захваченного из ткани холестерина. Белковая часть носителей липидов обозначается как апопротеины.
В плазме крови содержится около десятка различных апопротеинов, идентифицированных с помощью иммунохимических методов. Каждый из них обозначен латинской буквой (А, В, С, D, Е), а подвид- добавочным цифровым выражением (апо-С-1, апо-А-2 и т.д.). Общим для всех ЛП является включение в их состав всех основных липидов, количество которых и размер частиц у отдельных ЛП значительно варьируют. Апо-липопротеины обеспечивают растворимость липидов. Они располагаются на поверхности липопротеидов. Апопротеины обычно функционируют как лиганды для связывания с рецепторами или в качестве кофакторов для ферментов. Апо-С-II - кофактор для липопротеиновой липазы, которая удаляет триглицериды из хиломикронов и ЛПОНП, оставляя фрагменты частиц. Апо-Е - связывается с рецепторами печени, предназначенными для оставшихся частиц. Апо-В - связывается с периферическими и печеночными рецепторами, предназначенными для ЛПНП. Апо-А - связывается с периферическими рецепторами, предназначенными для ЛПВП. Так разумно и рационально функционирует система, обеспечивающая стабильность липидного обмена в норме.
Эндотелиальные клетки обладают уникальными свойствами. Особенности строения их мембран и целый ряд выделяемых ими веществ (простациклин, NO и др.) препятствуют активации свертывающей системы крови, происходящей на любой другой поверхности. Кровь циркулирует в жидком состоянии до тех пор, пока сохраняется целостность эндотелия, покрывающего внутреннюю поверхность сосуда. В эндотелии синтезируются вещества, необходимые для адгезии тромбоцитов, стимуляторы и ингибиторы фибринолиза и вещества, играющие важнейшую роль в регуляции тонуса сосуда.
Если клетки эндотелия повреждаются, то обнажается субэндотелий: базальная мембрана, коллагеновые и эластичные волокна, фибробласты, гладкомышечные клетки. Контакт с поврежденными эндотелиальными клетками, активирует свертывающую систему крови сразу в нескольких направлениях - стимулируется тромбоцитарный гемостаз, внутренний и внешний пути плазменного гемостаза. Тромбоциты первыми реагируют на любое повреждение эндотелия, поэтому образование тромбоцитарного тромба называется первичным гемостазом. В начале тромбоциты адгезируются к субэндотелию. Для этой реакции необходим фактор Виллебранда - крупномолекулярный белок, вырабатываемый эндотелием и содержащийся в субэндотелии плазмы и тромбоцитов. Тромбоциты прикрепляются к поврежденному эндотелию. В процессе активации тромбоциты выделяют гранулы с активными веществами, такими как АДФ, адреналин, тромбоксан А2, тромбоцитарный фактор роста и др. Эти вещества вызывают сразу две реакции: провоцируют спазм сосуда и стимулируют агрегацию тромбоцитов. Агрегаты тромбоцитов соединяются между собой, образуя единую сеть актомиозиновых волокон, которые позднее сокращаются, обеспечивая уплотнение всего тромба (ретракция кровяного сгустка). Агрегация тромбоцитов обычно происходит локально и ограничивается местом повреждения эндотелия. Этому способствует то, что в здоровых участках эндотелия вырабатывается простациклин, который вызывает дилатацию сосудов и является мощным дезагрегантом. Одновременно с тромбоцитарным активируется и плазменный гемостаз. Его конечным этапом является образование плотных нерастворимых нитей фибрина, укрепляющих тромбоцитарный тромб. Конечный этап свертывания запускается двумя путями: внешним и внутренним. При небольших повреждения активируется прежде всего внутренний путь свертывания. Он запускается контактом с XII фактором. Большинство факторов свертывания, включая XII, в активном состоянии являются протеазами, отщепляющими часть молекулы от следующего фактора, переводя его из неактивного состояния в активное. При этом каждый раз в реакцию вовлекается все большее число молекул (так называемый принцип каскада). XII фактор активирует, таким образом, XI, а тот в свою очередь, IX. Активный IX фактор при участии фосфолипидов, VIII фактора свертывания и кальция, отщепляет часть молекулы от X фактора, переводит его тоже в активное состояние. На этом этапе заканчивается разделение внутреннего и внешнего путей свертывания и начинается его конечный этап. Повреждение клеток сопровождается выделением тканевого тромбопластина. Тромбопластин, связываясь с VII фактором свертывания, переводит его в активное состояние. Активированный VIII фактор напрямую вызвает активацию X фактора. На этом заканчивается внешний путь свертывания. Активированный VII фактор способен активировать X фактор не только напрямую, но и опосредованно через активацию IX фактора, что образует "мостик" между внешним и внутренним путями свертывания. Таким образом, и внутренний, и внешний путь свертывания заканчивается на одном и том же - на образовании активного X фактора. Далее начинается конечный этап свертывания, общий для двух путей. Он состоит из двух основных реакций. Первая- образование тромбина и его неактивного предшественника- протромбина. Активный X фактор свертывания (сериновая протеаза) при участии V фактора и фосфолипидов, расщепляет протромбин на два фрагмента, одним из которых является тромбин. Вторая реакция- тромбин, также являющийся протеазой, отщепляет небольшие фрагменты от молекулы фибриногена. Остатки этой молекулы, называемые фибринмономерами, начинают полимеризоваться, образуя длинные сети фибрина, в которые вовлекаются эритроциты. Одновременно тромбин активирует еще XIII фактор (фибринстабилизирующий), который в нескольких местах сшивает между собой различные нити фибрина, делая тромб более устойчивым. На этом заканчивается плазменный гемостаз. Разделение на плазменный и тромбоцитарный гемостаз является достаточно условным. Реакции, участвующие в образовании фибрина, протекают, главным образом, на мембранах тромбоцитов и эндотелиальных клеток. Фосфолипиды мембран катализируют многие реакции плазменного гемостаза. В случае повреждения эндотелиального слоя тромбоциты адгезируются на его поверхности, продуцируя простагландины другого клана, тромбоксаны, и формируют кровяной сгусток. При этом эндотелиальные клетки участвуют и в процессе образования сгустка, вырабатывая необходимые для этого вещества, включая фактор VIII. В развитии патологии гемостаза и, в частности внутрисосудистого микросвертывания крови, ведущим фактором является нарушение равновесия между свертывающей и противосвертывающей системами крови, их активаторами и ингибиторами. На ограничение чрезмерного роста фибринового тромба направлено действие антитромбина-III, активации протеина С вместе с протеином S, фибринолитической системы, которая не только ограничивает рост фибринового тромба, но и обеспечивает удаление тромботических масс из сосудистого русла после того, как фибриновый тромб выполнил свою гемостатическую функцию. АТ-III - ингибитор плазмы крови, главным субстратом которого является тромбин. Основная физиологическая функция АТ-III заключается в удалении тромбина из кровотока. Особенно это важно после остановки тромбином кровотечения, когда основная роль его уже выполнена, а последующее пребывание в кровяном русле опасно. По современным представлениям инактивация тромбина в организме осуществляется несколькими путями: за счет взаимодействия фермента с плазменными ингибиторами - в первую очередь с АТ-III и путем активации противосвертывающей системы, приводящей к секреции из тучных клеток гепарина, катализирующего инактивацию АТ-III. АТ-III образует с тромбином стабильный комплекс в соотношении 1:1. Высокой активностью АТ-III не отличается, инактивация тромбина резко ускоряется в присутствии гепарина, катализирующего взаимодействие реактивного участка АТ-III с серином активного центра тромбина. Уровень его в плазме крови может быть высоко информативным наряду с другими показателями состояния больного. Основным местом синтеза АТ-III являются клетки паренхимы печени, поэтому заболевания, сопровождающиеся снижением белково-синтетической функции печени или транскапиллярного тока, приводят к снижению уровня АТ-III. Другой естественный антикоагулянт протеин С синтезируется в печени и представляет собой витамин К-зависимый протеин плазмы крови. В систему протеина С входят кофактор протеина С - белок S, который также синтезируется клетками печени при участии витамина К, и содержащийся в мембране эндотелиальных клеток сосудов гликопротеин - тромбомодулин. Физиологическими активаторами протеина С являются тромбин и фактор Ха. Тромбин, присоединяясь к тромбомодулину, на поверхности эндотелиальных клеток в присутствии ионов кальция активирует протеин С. Активированный протеин С обладает антикоагулянтными свойствами, индуцирует фибринолиз, препятствует агрегации тромбоцитов. Тромбин, связанный с тромбомодулином не активирует тромбоциты и не свертывает фибриноген, т.е. он теряет свои прокоагулянтные свойства и приобретает антикоагулянтные. Сниженный уровень протеина С является фактором риска возникновения тромбоза. Уровень протеина С и его активность у больных с ХИБС повышены или соответствуют норме. Развитие ИМ приводит к понижению уровня протеина С до нормальных цифр. Отмечено, что перед манифестацией ИМ уровень протеина С значительно повышается, а его резкое падение на фоне развившегося ИМ указывает на неблагоприятный для жизни прогноз. Основную роль в регуляции фибринолитической активности играет сосудистая стенка. Сосудистый эндотелий секретирует тканевой активатор плазминогена (ТАП). ТАП и плазминоген имеют сродство к фибрину, поэтому активация плазминогена происходит на поверхности фибрина. Снижение фибринолитической активности является прогностическим фактором заболевания коронарных сосудов у молодых людей; увеличение концентрации антигена ТАП предсказывает развитие острого инфаркта миокарда у здоровых людей и при нестабильной стенокардии. Выявлены маркеры изменений состояния фибринолитической системы: повышение активности и содержания антигена ИАП-1, увеличение уровня антигена ТАП, уменьшение концентрации комплекса плазмин-альфа2-антиплазмин, повышение содержания растворимого фибрина, конечных продуктов деградации фибриногена (ПДФ), Д-димером. Существенный вклад в нарушения микроциркуляции, тканевого кровотока и тромбообразования вносят ухудшения реологических свойств крови. Цельная кровь как суспензия форменных элементов в растворе белков и электролитов представляет собой жидкость, изменяющую свою вязкость в зависимости от "скорости сдвига". Последняя является параметром, зависящим от концентрации фибриногена в плазме, от количественного содержания в ней форменных элементов, прежде всего, эритроцитов, их агрегационно-дезагрегационных свойств и способности к деформации. Это, в свою очередь, определяется состоянием и химическим составом мембраны эритроцитов, осмотической резистентностью и т.д. Тромбоциты, являющиеся более крупной и секреторно-активной клеткой, играют существенную роль в тромбообразовании, но так как их на порядок меньше, чем эритроцитов, их роль в гемореологии более скромная - влияние на тонус и морфологию сосудов, взаимодействие с эндотелием и воздействие на эритроциты. Их агрегация определяется двумя факторами - индукторами агрегации и антиагрегационными механизмами. Лейкоцитов меньше, чем эритроцитов на три порядка, и они могут оказывать воздействие только при своей активации, активируя другие форменные элементы крови и незначительно оттесняя эритроциты. Плазменный фактор представляет собой концентрацию в плазме веществ, способных усиливать агрегационную функция форменных элементов крови (прежде всего это крупномолекулярные белки - фибриноген и продукты его деградации, иммуноглобулин М, альфа-макроглобулин) и высокомолекулярных веществ, непосредственно повышающих вязкостные характеристики крови (холестерин липопротеидов низкой и очень низкой плотности, фибриноген и его дериваты, а также другие крупные белковые молекулы и их комплексы). Фибриноген и его дериваты, концентрация которых в плазме велика, играют существенную роль в гемореологии. Фибриноген относится к фракции гамма-глобулинов. Обладая большим молекулярным весом, выраженной пространственной асимметрией и электрическим зарядом, фибриноген взаимодействует с сосудистой стенкой, мембранами форменных элементов крови, регулирует процессы адгезии, агрегации и деформации форменных клеток в кровяном потоке. Фибриноген (фибриноген А) повышается при любом воспалительном процессе в организме.
Таким образом, в обычной жизни существует равновесие в системе гемостаза. Каскад свертывания запускается только при возникновении какого-то момента, когда появляется патологический субстрат, либо под влиянием внешнего воздействия наступает непредсказуемая мобилизация факторов свертывания.
Патогенез ишемической болезни сердца
По своей патофизиологической сущности все проявления ИБС обусловлены нарушением баланса между потребностью миокарда в кислороде и его доставкой. Потребление кислорода сердцем тесно связано с физическим усилием, которое оно совершает в процессе сокращения. Зависит оно от трёх основных факторов: растяжения, развиваемого сердечной мышцей, сократительного инотропного состояния сердечной мышцы, частоты сердечных сокращений. Когда эти показатели остаются постоянными, увеличение объёма крови вызывает реакцию эфферентного типа, что приводит к увеличению сердечного выброса и артериального давления. Поток крови через коронарные артерии прямо пропорционален градиенту давления между аортой и левым желудочком во время систолы и диастолы. Наполнение и кровоток происходит в основном во время диастолы, когда нет сопротивления из-за систолического сжатия миокарда. Практически доставка к миокарду кислорода может быть увеличена повышением коронарного кровотока и повышением экстракции кислорода. Однако особенность этого процесса в состоит в том, что уже в обычных условиях экстракция кислорода близка к своему максимуму. Физический или эмоциональный стресс в норме через несколько секунд увеличивает коронарный кровоток в три-четыре раза. Этим компенсируется доставка кислорода к миокарду.
При нарушении одного из звеньев доставки кислорода, наступает дефицит кровоснабжения с соответствующими проявлениями. Когда коронарная артерия сужена более 70%, внутримиокардиальные артериолы для поддержания кровоснабжения мышцы сердца расширяются. Однако на этом их резерв исчерпывается. При таких обстоятельствах увеличение частоты сердечных сокращений (ЧСС), артериального давления (АД), объёма и конечно-диастолического давления левого желудочка приводят к ишемии и приступу стенокардии.
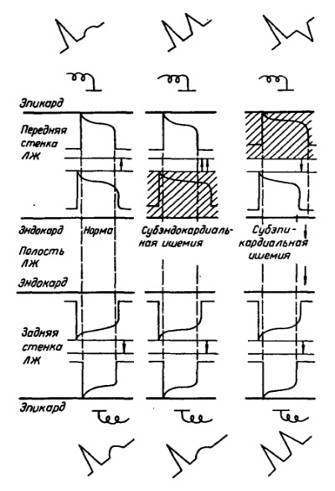
Уменьшение притока артериальногй крови к тканям, прежде всего отражается на энергетическом обмене в клетках. Недостаточное поступление кислорода и питательных веществ, ослабляет биологическое окисление и вызывает дефицит энергии в виде макроэргических соединений креатинфосфата (КФ), адензинтрифосфата (АТФ). Компенсаторно в клетках усиливается безкислородный путь получения энергии - анаэробный гликолиз. При ишемии развиваются нарушения сократимости миокарда. Чем быстрее развивается ишемия и чем она продолжительнее, тем более значительны нарушения. Зона субэндокарда более подвержена ишемии в связи с выраженным воздействием на неё внутриполостного давления.
Клинические проявления возникают последовательно и схематически представляются в виде "ишемического каскада"- дисфункция левого желудочка, ЭКГ изменения и завершение - приступ стенокардии. Механизм возникновения боли, характерной для стенокардии полностью не асшифрован.
Предполагается, что дискомфорт за грудиной начинается от чувствительных окончаний внутрисердечных симпатических нервов. Сигнал идет по афферентным волокнам, которые соединяются с пятью верхними симпатическими ганглиями и пятью дистальными грудными позвоночными хордами. Импульсы передаются от позвоночной хорды в таламус и в корковую структуру мозга. Внутри позвоночной хорды афферентные сердечные симпатические импульсы могут сталкиваться с импульсами из соматических структур (грудных), что может служить основой для формирования сердечной боли. Вклад вагусных афферентных импульсов в сердечную боль не ясен. Использование позитронной эмиссионной томографии для оценки изменения регионального мозгового кровотока показало, что он ассоциирован со стенокардией. Было сделано заключение, что кортикальная активация, необходимая для проявления боли, и таламус могут служить воротами для афферентных болевых сигналов. Специфические вещества - триггеры, которые стимулируют чувствительные нервные окончания и способствуют формированию приступа стенокардии, еще не идентифицированы. Внимание обращено на разные субстанции, включая пептиды, которые выделяются из клеток в результате преходящей ишемии. К этим пептидам относятся аденозин, брадикинин, гистамин, серотонин. В одном из исследовании внутривенное введение аденозина воспроизвело симптомы стенокардии более, чем у 90% пациентов, страдающих ИБС. Вторая гипотеза: причиной боли может быть механическое растяжение коронарной артерии. Таким образом, связь между ишемическими процессами на тканевом уровне и проявлениями боли остается предметом дальнейших исследований. В более редких случаях может быть безболевая ишемия - у пациентов с наличием атеросклеротических повреждений коронарных артерий никогда не возникает чувство боли, даже при развитии инфаркта миокарда, только изменения на ЭКГ. В этом варианте предполагается дефект "системы оповещения". В одном из исследование приводятся данные о развитии безболевого Q-инфаркта у четверти всех наблюдавшихся больных с таким инфарктом.
Существует группа пациентов, у которых лишь некоторые приступы ишемии сопровождаются дискомфортом за грудиной, а подавляющее большинство эпизодов ишемии обнаруживаются на ЭКГ. Высказывается мнение, что это может быть результатом комбинации повышения порога чувствительности к болевым стимулам и коронарной микроваскулярной дисфункции. Отмечено, что у больных диабетом имеется зависимость безболевой ишемии и вегетативной нейропатии. У таких пациентов выявлялась невосприимчивость к боли, вызываемой электрическим током и ишемии мочки уха. Еще одно предположение о развитии безболевой ишемии - большая концентрация эндогенных опиатов (эндорфинов), которые повышают болевой порог. В зависимости от патогенетического механизма выделено несколько типов стенокардии. Стенокардия за счет повышенной потребности в кислороде - "стенокардия потребления" ("demand angina"). "Стенокардия потребления" обусловлена несоответствием между поступлением крови и повышенной потребностью миокарда в энергетических субстратах и кислороде, на фоне фиксированной ограниченной доставки кислорода. Повышение потребности происходит за счёт высвобождения адреналина адренергическими нервными окончаниями в результате физиологического ответа на напряжение или стресс. При этом важное значение имеет степень увеличения потребности в кислороде. Поспешность, влияние эмоций, душевное волнение, психический и умственный стресс, гнев на фоне имеющегося сужения коронарных артерий, могут путем включения различных сложных механизмов приводить к приступу стенокардии. Увеличение потребности в кислороде у пациентов с обструктивными изменениями коронарных артерий возникает после еды, при повышении метаболических потребностей вследствие лихорадочного состояния, тиреотоксикоза, тахикардии любого генеза, гипогликемии. Особенно важно повышение числа сердечных сокращений (ЧСС). У этих пациентов, в отличие от пациентов с нестабильной стенокардией, ишемическим эпизодам предшествует значительное увеличение ЧСС. Вероятность развития ишемии при этом пропорциональна величине и продолжительности учащения ЧСС.
Стенокардия за счет преходящего уменьшения обеспечения миокарда кислородом - "стенокардия снабжения" или "стенокардия доставки" (suppli angina). Стенокардия снабжения возникает вследствие нарушения функционирования регуляторных механизмов, что приводит к появлению эпизодов, сопровождающихся нарушением кровотока в стенозированной артерии. Накапливается все больше сведений о том, что не только нестабильная стенокардия, но и хроническая стабильная стенокардия может развиться из-за преходящего уменьшения доставки кислорода, являющегося следствием коронарной вазоконстрикции. Русло коронарных артерий хорошо иннервируется и разнообразные стимулы могут изменить тонус коронарных артерий. Пациенты могут иметь стенозирование коронарных артерий разной степени тяжести и разной степени динамику изменений их тонуса. У типичного пациента со стабильной стенокардией обычно степень обструкции коронарной артерии достаточна для неадекватного коронарного кровотока и увеличения потребности миокарда в кислороде при напряжении. Эпизоды преходящей вазокострикции приводят к дополнительному ограничению коронарного кровотока. У пациентов без органических повреждений сама по себе тяжелая динамическая обструкция, хоть и редко, может привести к ишемии миокарда и стенокардии (стенокардия Принцметала). При выраженном стенозе коронарных артерий даже незначительная дополнительная динамическая обструкция может снизить коронарный кровоток ниже критического уровня. "Непостоянно-пороговая стенокардия" (НПС). У пациентов с хронической стенокардией имеется широкая вариабельность порога стенокардии. При фиксированном пороге стенокардии, вызванной повышенной потребностью миокарда в кислороде с несколькими вазоконстрикторными компонентами, уровень физической активности, необходимой для развития стенокардии, является относительно постоянным. Эти пациенты могут четко определить степень физической нагрузки, при которой у них разовьётся приступ. Большинство пациентов с НПС имеет сужение коронарных артерий, но вызываемая вазоконстрикцией обструкция играет важную роль в развитии ишемии миокарда. У этих пациентов имеются "хорошие дни", когда они способны выполнить значительную нагрузку, и "плохие дни", когда минимальная физическая нагрузка приводит к клиническим и ЭКГ проявлениям. Часто в течение дня они могут выполнить значительную физическую нагрузку один раз, в то время как минимальная активность в другой раз приводит к стенокардии. Пациенты с НПС указывают на вариабельность стенокардии, которая чаще бывает утром. Стенокардию могут провоцировать холод, эмоции или психический стресс. Холод увеличивает периферическое сопротивление и может индуцировать коронарную вазоконстрикцию. Увеличение АД ведет к нарастанию потребности миокарда в кислороде и снижению порога стенокардии. Ухудшение толерантности к физической нагрузке после еды - может быть результатом быстрого нарастания потребности миокарда в кислороде и включается также вазоконстрикторный компонент. На практике у многих больных диагностируется "смешанная стенокардия", которая занимает промежуточное место между стенокардией с определенным порогом и непостоянно-пороговой стенокардией и сочетает элементы "стенокардии потребности" и "стенокардии снабжения". Независимо от того, какой патогенетических механизм стенокардии преобладает, изменения в миокарде имеют одинаковый характер.
Вследствие недостаточного поступления кислорода происходят изменения энергетического механизма миокарда, развитие клеточного ацидоза, нарушение ионного равновесия, уменьшение образования АТФ и нарушение сократительной функции миокарда. Разделение стенокардии на эти формы имеет значение при назначении медикаментозного лечения. При преобладании "стенокардии потребления" большая вероятность эффективности бетаблокаторов. В случае преобладания "стенокардии доставки", т.е. выраженного вазоспастического компонента, более эффективны нитраты и блокаторы кальциевых каналов. Гибернация и станинг характеризуются сохранным инотропным резервом. При краткосрочной гибернации использование инотропного резерва сопровождается и уменьшением возможности метаболического восстановления; при станинге нет метаболических нарушений. При гибернации при длителной стимуляции может наступть некроз, при станинге некроз не развивается. Гибернация и прерывистый станинг - разные по природе явления, но их клинические характеристики зачастую неразличимы. Прежде всего они проявляются ишемической дисфункцией и могут наблюдаться у одного больного и даже в одной области миокарда. В этих двух процессах играют роль многие сходные моменты: аденозин, факторы роста и пр. При неоднократных кратковременных эпизодах ишемии (безболевой или болевой) и реперфузии развивающийся станинг очень напоминает гибернацию. Гибернация может быть следствием повторных эпизодов станинга - через повторные эпизоды дисбаланса между потребностью и доставкой кислорода. "Оглушенный" миокард (станинг). Это обратимое изменение миокарда, наступающее после кратковременной ишемии, которое не приводит к потере кардиомиоцитов, но сопровождается замедленным восстановлением сердечной функции (от часов до дней) после восстановления кровотока. Это - постишемическая дисфункция миокарда, которая существует после реперфузии, несмотря на отсутствие необратимого повреждения и восстановления кровотока до нормального или близкого к норме. "Оглушенный" миокард (станинг) представляет собой клиническую проблему в следующих случаях.
1. Когда выраженность и распространенность дисфункции левого желудочка ассоциируется с синдромом малого сердечного выброса.
2. У пациентов высокго риска - низкая исходно ФВ ЛЖ, длительный период ИК, повторное или экстренное коронарное шунтирование, нестабильная стенокардия, поражение ствола ЛКА, сопутствующая операция замены клапана.
3. После операции на сердце, когда постишемическая дисфункция миокарда может затрагивать как левый так и правый желудочек и более серьезно влиять на выживаемость.
4. При трансплантации сердца.
5. После тромболизиса у больных с инфарктом миокарда.
Станинг наблюдается при транслюминальной балонной ангиопластике, нестабильной стенокардии и ее наивысшей стадии - стенокардии покоя, вариантной стенокардии Принцметала, после инфаркта миокарда с ранней реперфузией. Как правило, этот процесс обратим в течение 24-48 часов. В эксперименте после окклюзии ПМЖВ на 15 минут имеется парадоксальное истончение в систолу всех слоев миокарда. При реперфузии восстановление сократимости более медленное в субэндокарде. К 24 часам восстанавливается сократимость в наружном и среднем слоях. Только к 48 часам наступает восстановление сократимости внутреннего слоя. Гибернированный миокард ("спящий") - это ишемизированный миокард, кровоснабжаемый суженными коронарными артериями, в котором клетки остаются жизнеспособными, но их сократительная способность хронически снижена. В эксперименте показано, что 5-15 минутная окклюзия коронарной артерии с последующей реперфузией не сопровождается некрозом, но сопровождается преходящей сократительной дисфункцией миокарда как в систолу, так и в диастолу. Гибернация - это хроническая ишемия миокарда, при которой кровоснабжение его не столь мало, чтобы вызвать некроз ткани, но достаточно для развития хронической региональной левожелудочковой дисфункции. То есть, гибернация это хроническая ишемическая дисфункция. Это дисфункция левого желудочка в покое, вызванная его длительной гипоперфузией, и частично или полностью исчезающая после улучшения коронарного кровотока или снижения потребности миокарда в кислороде. Патофизиология и патогенез гибернации еще полностью не раскрыт. Этот термин может описывать разные явления. Определение его может быть таково - продолженная (по крайней мере несколько часов) сократительная дисфункция миокарда, сохранившего жизнеспособность, которая связана с редуцированным коронарным кровотоком. Этот феномен обеспечивает адаптацию сердца к низкому коронарному кровотоку, когда он восстанавливается и функция нормализуется. Гибернация после корригирования её коронарной реваскуляризацией при отсутствии стенокардии диагностируется по наличию редуцированной перфузии. Гибернация может продолжаться месяцы и годы. Хроническая асинергия может сниматься введением нитроглицерна, адреналина, индукцией упражнений, постэкстрасистолическим потенциированием, коронарной реваскуляризацией. Гибернированный миокард идентифицируется по гипо- или акинетической зоне миокарда, в которой сниженный кровоток регистрируется сканированием при помощи позитронно-эмиссионной томографии. Стресс-проба с добутамином также во многих случаях дает возможность в клинической практике подтвердить гибернацию миокарда, что особенно важно при отборе пациентов на реваскуляризацию миокарда. Некоторые авторы говорят о большей диагностической ценности пробы с радиоактивным талием, чем добутаминовый тест. Клиническое значение гибернированного , "спящего" миокарда, определяющее активное лечение сводится к следующим положениям.
1. Высокая частота выявления гибернации при всех формах ИБС.
2. Отрицательное влияние на прогноз больных ИБС с дисфункцией левого желудочка.
3. Хотя гибернация и считается приспособительной реакцией, предохроняющей миокард от дальнейшего повреждения, она не является стабильным состоянием и, при неблагоприятных условиях (ухудшение перфузии миокарда, повышение потребности в кислороде) возможно усугубление ишемии вплоть до развития некроза.
Похожие работы
... тромболитической терапии. Практически значимыми маркерами гибели миоцитов являются активности энзимов - АСТ, КФК, ЛДГ. Таблица 4 Некоторые показатели липидного спектра сыворотки крови мужчин г. Катайска, больных артериальной гипертонией I, II степени и ишемической болезнью сердца, M±m Показатели Группы Общий холестерин, N – 5,2-6,5 ммоль/л Триглицериды, N – 0,51-1,86 ммоль/л ...
... симптомов болезни связано с разрывом атеросклеротической бляшки, образованием тромба в коронарной артерии, быстрым развитием выраженного стеноза или окклюзии. Диагностика ишемической болезни сердца К основным инструментальным методам диагностики стабильной стенокардии относятся следующие исследования: · электрокардиография, · эхокардиография, · стресс-тесты, · коронарография. ...
... но может наступить и у лиц, в анамнезе которых имеются указания на стенокардию или перенесенный ранее инфаркт миокарда. СТЕНОКАРДИЯ (Stenocardia) Одной из наиболее распространенных клинических форм ишемической болезни сердца является стенокардия (грудная жаба), представляющая собою характерный болевой синдром, обусловленный преходящей ишемией миокарда вследствие острого нарушения венечного ...
... болезнь сердца» является групповым. Оно объединяет как острые, так и хронические патологические состояния. Для применения методики исследования адекватности самооценки для контингента больных с ишемической болезнью сердца необходимо учитывать тяжесть заболевания. Для психологов медицина не является профессией, поэтому приведем необходимый классификационный минимум, в дальнейшем позволяющий нам ...




0 комментариев