Навигация
Перевод вещества в раствор
2.1.1.2 Перевод вещества в раствор
Если предварительные испытания убедят в том, что измельчение исследуемого вещества безопасно, его истирают возможно мельче в фарфоровой, а затем в агатовой ступке. Отдельные небольшие порции измельченного вещества пробуют растворять на холоду, а затем при нагревании последовательно в таких растворителях: вода, 3 М HCl, затем 12 М HCl, 3 М HNO3, затем 16 М HNO3 и, наконец, царская водка [7].
Если растворимость нельзя определить на глаз, ее устанавливают, взяв на часовое стекло каплю растворителя, после его воздействия на вещество, и выпарив затем досуха жидкость. Наличие сухого остатка на стекле и его количество характеризуют растворимость в данном растворителе [7].
К последующему растворителю следует переходить, если установлено, что предыдущий не растворяет исследуемого вещества. Если вещество представляет собою гетерогенную смесь, компоненты которой различаются по растворимости, можно применять несколько растворителей последовательно: например, обработать объект водой, а остаток растворить в 3 М HCl. Полученные два раствора следует смешать и, если при этом не образуется осадок, то таким же образом можно приготовить и весь исходный раствор для анализа [7].
Нерастворяющийся осадок, который остается после смешения таких растворов или применения всех растворителей, чаще всего содержит такие вещества (соединения редких и рассеянных элементов не рассматриваются):
некоторые соли серебра – AgCl, AgBr, AgI, AgCN – белого или желтого цвета;
некоторые сульфаты – BaSO4, SrSO4, CaSO4, PbSO4 – белого цвета;
некоторые фториды – CaF2 и др. – белого цвета;
некоторые окислы – А12O3, SnO2 и др. – белого цвета, Fe2O3 – бурого цвета, Сг2O3 – зеленого цвета;
некоторые силикаты – Al2O3∙2SiO2 и др. цвет может быть любым.
2.1.1.3 Анализ катионов и анионов
После того как испытуемый минерал тем или иным способом переведено в раствор, приступают к исследованию этого раствора на катионы и анионы за кислотно-основной схемой [8].
2.2.2 Общая характеристика фотометрических методов определения мышьяка
В наиболее удачном методе определения мышьяка использована реакция образования желтой мышьяковомолибденовой гетерополикислоты, которую затем восстанавливаю до так напиваемой мышьяковомолибденовой сини. Однако можно проводить определение мышьяка и по оптической плотности желтого комплекса [7].
Спектры поглощения желтого мышьяковомолибденового комплекса и мышьяковомолибденовой сини представлены на рис.1.
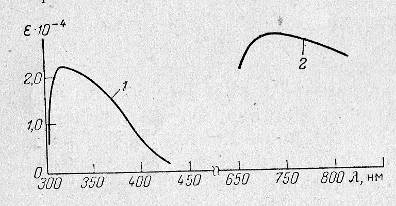
Рисунок 2.1 Спектры поглощения желтого(1) и синего(2) мышьяковомолибденовых комплексов
Из этого рисунка следует, что если проводить измерение оптической плотности желтого комплекса в видимой области при 400 нм, то чувствительность метода примерно в 5 раз меньше по сравнению с чувствительностью метода, основанного на измерении оптической плотности мышьяковомолибденовой сини при 700 – 800 нм. Свойства мышьяковомолибденовых гетерополикислот, как желтой, так и синей, подобны свойствам фосфорномолибденовых гетерополикомплексов. Поэтому основная трудность при определении мышьяка этим методом заключается в отделении мышьяка от фосфора [7].
2.2.2.1 Количественное определение мышьяка в неизвестном минерале
Навеску металла разрушают азотной кислотой, сурьмяную кислоту связывают тартратом и мышьяк выделяют вместе с магний-аммоний фосфатом. После чего отделяют мышьяк в виде арсина и определяют в виде мышьяковомолибденовой сини [7].
Недостатком данного метода является то, что при осаждении мышьяка вместе с магний-аммоний фосфатом содержание мышьяка в холостой пробе оказывается весьма значительным. Даже в случае применения специально очищенных реактивов результат холостого опыта составляет до 0,5 мкг. Таким образом, этим методом можно определить не менее 0,3 мкг мышьяка, хотя чувствительность метода позволяет определять 0,1 мкг мышьяка.
2.2.2.2 Реактивы и приборы
Фосфат калия, однозамещенный, 2%-ный раствор. Растворяют 20 г однозамещенного фосфата калия в воде, разбавляют до 1 л и перемешивают.
Магнезиальная смесь, растворяют 55 г хлорида магния MgCl2∙6H2O и 105 г хлорида аммония NH4Cl в воде, добавляют 350 мл концентрированного раствора аммиака и разбавляют водой до 1 л. Дают раствору отстояться в течение 3 – 4 дней и фильтруют.
Стандартный раствор арсената. Навеску арсенита калия (х. ч.) 2,0853 г растворяют в 23 мл 1 н. раствора щелочи, переносят в мерную колбу емкостью 1 л, подкисляют хлористоводородной кислотой до кислой реакции, прибавляют 0,5 г хлората калия, разбавляют водой до метки и хорошо перемешивают. Такой раствор содержит 1∙10-2 моль мышьяка в 1 мл. Из этого раствора разбавлением готовят стандартные растворы с содержанием мышьяка 0, 1∙10-5, 2∙10-5, 2,5∙10-5, 3∙10-5, 3,5∙10-5 моль/л.
Хлорид олова(II), 0,5%-ный раствор в хлористоводородной кислоте, разбавленной (1 : 1).
Молибдат-гидразиновый реактив. Растворяют 1 г молибдата аммония в 100 мл 5 н. серной кислоты и 0,15 г сернокислого гидразина в 100 мл воды. Разбавляют 10 мл раствора молибдата аммония до 90 мл водой, добавляют 1 мл раствора сернокислого гидразина и водой разбавляют до 100 мл. Эта смесь неустойчива, и поэтому ее готовят ежедневно или в ходе анализа отдельно прибавляют соответствующее количество растворов молибдата аммония и сернокислого гидразина.
Прибор для отгонки хлорида мышьяка(III) (показан на рис. 2.2), спектрофотометр КФК-3, кюветы на 1см, набор колб и пипеток.
Похожие работы
... у поверхности Tmax(K) 270 Tmin(K) 200 Среднее давление у поверхности P (атм.) 6*10-3 Средняя плотность у поверхности r (г/см3) 1,2*10-5 Для атмосферы Марса характерно низкое относительное содержание водяного пара, на уровне сотых и тысячных долей процента. Около 80% количества H2O сосредоточено в ...
... философии - особенно с методологических позиций материалистического понимания истории и материалистической диалектики с учетом социокультурной обусловленности этого процесса. Однако в западной философии и методологии науки XX в. фактически - особенно в годы «триумфального шествия» логического позитивизма (а у него действительно были немалые успехи) - научное знание исследовалось без учета его ...
0 комментариев