Навигация
Термическое разложение нерастворимых в воде оснований
4.4 Термическое разложение нерастворимых в воде оснований.
Многие нерастворимые в воде основания разлагаются при нагревании. Продуктами разложения будут оксиды соответствующих металлов и вода. Температура нагревания зависит от металла, который входит в состав основания и колеблется от 200°С и выше.
Запишем реакции разложения для гидроксидов цинка, меди, алюминия:
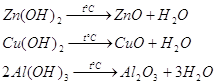
Продукты приведенных реакций вода и оксиды металлов: ![]() ,
, ![]() и
и ![]() .
.
4.5 Взаимодействие с солями металлов.
Эта реакция характерна для щелочей. Гидроксиды калия. натрия. Лития взаимодействуют с солями металлов, в результате в осадок выпадают нерастворимые гидроксиды данных металлов:
![]()
![]()
![]()
С помощью этих реакций получают нерастворимые в воде гидроксиды многих металлов, которые затем используют в химическом синтезе, медицине и т. д.
Глава 5. Использование оснований в химии и промышленности.
Основания широко используются как в лаборатории химии, так и в химической промышленности, находят они свое применение и в быту.
Рассмотрим применение наиболее широко используемых оснований.
В химической лаборатории и в промышленности гидроксид натрия один из наиболее ходовых реактивов.
Гидроксид натрия, ![]() .
.
Используется для получения различных натриевых солей: сульфата, нитрата, нитрита, хромата, силикатов, или растворимого стекла, Флорида, солей органических кислот. Применяется при изготовлении целлюлозы из древесины при сульфатной варке, искусственных волокон, мыла и моющих средств, смачивателей и эмульгаторов, красителей, оксида алюминия из бокситов, фенолов. Входит в состав электролитов для воронения стали, оксидирования металлов, особенно алюминия, для проведения электролитических процессов в технологии олова и цинка.
Гидроксид калия, ![]() .
.
Служит исходным веществом для получения многих солей калия, жидких мыл и некоторых красителей. Используется как электролит, вместе с гидроксидом лития, в никель – кадмиевых аккумуляторах, в виде спиртового раствора для производства ксантогенатов – полупродуктов в производстве флотоагентов.
Гидроксид аммония, ![]() .
.
Его производство в мире составляет около 10 – 12 млн. тонн. Используют его как удобрение, при производстве животных кормов для повишения их пищевой ценности и как консервант, при производстве соды, красителей, в электролитическом производстве соединений марганца, в лабораторной практике.
Гидроксид кальция, ![]() .
.
Гидроксид кальция (гашеная известь) применяется в производстве строительных материалов, из него изготовляют известковый строительный раствор. Из него изготовляют хлорную известь ( смесь ![]()
![]()
![]() ) и другие соединения кальция, известковые удобрения, защитные средства для растений. При помощи гидроксида кальция смягчают воду, дубят кожи, нейтрализуют сточные воды, выделяют соли органических кислот из растительных соков.
) и другие соединения кальция, известковые удобрения, защитные средства для растений. При помощи гидроксида кальция смягчают воду, дубят кожи, нейтрализуют сточные воды, выделяют соли органических кислот из растительных соков.
Гидроксид лития, ![]() .
.
Применяется для наполнения щелочных аккумуляторов, что увеличивает их строк действия, используется для изготовления эмалей и стекол.
Гидроксид магния, ![]() .
.
Применяют в строительной промышленности, как компонент огнеупорных конструкционных материалов, для изготовления керамической химической посуды. Используется в медицине как мягкое нейтрализующее средство (при повышенной кислотности желудочного сока).
Области применения других, менее распространенных гидроксидов указаны в таблице 3
Таблица 3. Области применения гидроксидов металлов.
| № | Название гидроксида | Химическая формула | Применение |
| 1. | Гидроксид меди |
| Используется в качестве пигмента для стекла, эмалей и глазурей, протравы при крашении тканей, как фунгицид. Стабилизатор нейлона, для приготовления реактива Швейцера. |
| 2. | Гидроксид цинка |
| Наполнитель резин, компонент красок, в ветеринарии как компонент мазей. |
| 3. | Гидроксид кобальта |
| Используют для получения катализаторов, пигментов, |
| 4. | Гидроксид кадмия |
| Применяют для получения соединений кадмия, как аналитический реагент, для изготовления активной массы в кадмиевых источниках тока. |
| 5. | Гидроксид алюминия |
| Применяют для получения соединений алюминия, как антипирен в лакокрасочных материалов и пластмасс, компонент зубных паст, обволакивающее и адсорбирующее средство в медицине. |
| 6. | Гидроксид бериллия |
| Используют для получения огнеупорной керамики. тиглей, компонент стекол, хорошо пропускающих УФ-лучи. |
| 7. | Гидроксид олова |
| Для травления тканей, особенно шелка. |
| 8. | Гидроксид свинца |
| Для травления тканей, для изготовления стекла, наполнитель аккумуляторов. |
| 9. | Гидроксид висмута |
| Применяют при изготовлении эмалей и керамики, хрусталя и спец. стекол, для изготовления ультразвуковых материалов |
| 10. | Гидроксид хрома |
| Используют в аналитической хими. |
| 11. | Гидроксид марганца |
| Используют для получения соединений марганца. |
| 12. | Гидроксид железа |
| Основа для изготовления металлического железа, красящих пигментов |
Заключение.
Основания – один из классов неорганических веществ, который наряду с кислотами, оксидами и солями составляет основу неорганической химии. Они широко используются в разных областях химии и химической промышленности. С их помощью получают удобрения, строительные материалы, цветное стекло. Без них мы бы лишились легких и экономичных щелочных аккумуляторов, многих медицинских препаратов.
Заданием этой работы была систематизация знаний о таком классе неорганических химических веществ как основы, нужно было свести воедино их химические и физические свойства, их получение и использование в промышленности.
В работе особое внимание было уделено освещению понятия оснований, как одного из классов неорганических веществ на основе современных кислотно – основных теорий Бренстеда, Льюиса, Измайлова. Усановича. Также были рассмотрены промышленные методы получения щелочей на примере гидроксида натрия [ 3, ст. 36 – 42 ]. Большое внимание уделено способам применения оснований как в быту так и в химической, медицинской, строительной промышленности, где они находят свое применение. Главные области применения конкретных веществ вынесены в специальную справочную таблицу для удобства пользования.
Изучение свойств оснований имеет большое значение при изучении химии, а также для развития научного мировоззрения.
Список использованной литературы.
1. Глинка Н. Л. Общая химия. – Л.: Химия, 1988. – 702 с.
2. Крешков А. П., Ярославцев А. А. Курс аналитической химии. – М.: Химия, 1964. – 430 с.
3. Подобаев Н. И. Электролиз. – М.: Просвещение, 1989, 100 с.
4. Полеес М. Э. Аналитическая химия. – М.: Медицина, 1981. – 286 с.
5. Рабинович В. А., Хавин З. Я. Краткий химический справочник. – Л.: Химия, 1978. – 331 с.
6. Химия: Справочное издание/ под ред. В. Шретер, К.-Х, Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. – М.: Химия, 1989.– 648 с.
7. Химическая энциклопедия в 5 т. / под ред. И. Л. Кнунянца. – М.: Советская энциклопедия, 1990.
8. Щукарев С. А. Неорганическая химия. – М.: Высшая школа, 1970. – 437 с.
Похожие работы
... в Нидерландах, куда обе страны сбывали шерсть, и где англичане помогали гёзам, которые восстали против испанского ига. В этих условиях при тогдашнем быстром развитии в Англии буржуазных отношений Новый Свет — тыл Испании, богатейшая сокровищница и широчайший рынок — стал мишенью и приманкой для английских искателей приключений, для оборотистых английских купцов и джентльменов. Пиратство в водах ...
... дерева. Нет смысла искусственно раздувать противоречия между эко- и биоцентризмом. Гораздо целесообразнее говорить о том, что их объединяет, что у них общего, что может послужить основанием для общей платформы экологической этики. Это – следующие важные моменты: 1) все, и индивиды, и виды живых существ, и экосистемы обладают собственным благом, правами, своей внутренней ценностью, ибо ценны ...
... , на свои 1,5% населения. Поэтому я от вопроса о том, что такое сильное и что такое слабое гражданское общество, органически перехожу к четвертому вопросу в моем распорядке – про гражданское общество и экономический рост. Тот же, уже упоминавшийся мною, автор теории коллективных действий Мансур Олсон задал очень интересный вопрос – про нашу страну, между прочим. Лицом к лицу лица не увидать. Нам ...
... изучения геологии и почвоведения, то приходится принять, что задачей геоморфологии является изучение только геометрических, но не вещественных свойств земной поверхности. В математической формулировке это означает, что объектом изучения геоморфологии следует считать не саму границу множества L, а ее отображение в пространство P, т.е. поверхность в трехмерном евклидовом пространстве, прообразом ...
0 комментариев