Навигация
Окислительно-восстановительные реакции
9. Окислительно-восстановительные реакции.
9.1. Дайте оценку восстановительных свойств Zn и окислительно-восстановительных свойств его ионов в зависимости от его рН среды (используйте справочные характеристики).
Решение.
Цинк – сильный восстановитель. На реакции цинка и ионами меди основана работа химического элемента Даниеля. Нормальный электродный потенциал цинка - 0.7618 В. как восстановитель цинк используют в многих химических процессах, например, он используется при восстановлении органических веществ, и т.п.
Восстановительная активность цинка проявляется особенно активно при РН<7, в кислых растворах. Он восстанавливает водород из кислот, например разбавленной серной или соляной.
![]()

Также цинк может восстанавливать металлы менее активные чем он сам в нейтральной среде. Он восстанавливает металлы от хрома (-0,74 В) до серебра (0,79 В). Это его свойство часто используют для изготовления гальванических элементов.
![]()
В щелочной среде цинк окисляется до иона ![]() , он также может восстанавливать водород из воды, восстанавливает многие неорганические соли, кислородные соединения.
, он также может восстанавливать водород из воды, восстанавливает многие неорганические соли, кислородные соединения.
Нормальный электродный потенциал электрода равен для реакции: ![]() -1,216 В, это значит, что цинк может восстанавливать в щелочной среде все соединения с более положительным потенциалом, это будут кислородные соединения хрома, марганца, олова, свинца и т.п.
-1,216 В, это значит, что цинк может восстанавливать в щелочной среде все соединения с более положительным потенциалом, это будут кислородные соединения хрома, марганца, олова, свинца и т.п.
![]()
Приведенное выше уравнение будет примеров взаимодействия цинка в щелочной среде.
9.2. Составьте уравнения 3-х окислительно-восстановительных реакций ( с использованием вещества содержащего ионы данного металла) при рН>7, рН=7, рН<7. 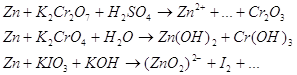
Предварительно рассчитайте Е0 химической реакции, используя метод электронно-ионного баланса.
Решение.
Для указанных уравнений запишем окислительно-восстановительные уравнения реакций. Сначала рассмотрим эти уравнения и решим их с помощью электронного баланса.

Запишем уравнения электронно-ионного баланса.

Суммируем уравнения.
![]()
Запишем полученное уравнение в молекулярном виде:
![]()
Рассчитаем Е0 химической реакции.

![]()
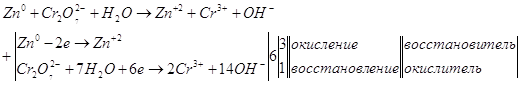
Суммируем уравнения.
![]()
Запишем полученное уравнение в молекулярном виде:
![]()
Рассчитаем Е0 химической реакции.

![]()
Составим уравнения ионно-электронного баланса.

Просуммируем полученные полу реакции.

Запишем уравнение в молекулярном виде.
![]()
Рассчитаем Е0 химической реакции.
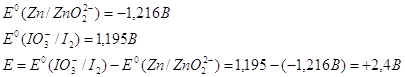
10.3. Составьте и опишите схему гальванического элемента из металлического электрода данного металла и электродной системы С, ![]()
Решение.
Гальванический элемент состоит из катода и анода. Одним из электродов в нашем случае будет цинковый электрод, другим электродом будет инертный угольный электрод.
Запишем схему электрода.
![]()
Гальванический элемент состоит из цинковой пластины опущенной в раствор соли, что содержит ионы V3+ и H+ . поскольку РН <7. угольный электрод опущен в раствор, что содержит ионы ![]() . Между электродами расположена диафрагма, которая пропускает ионы, но не дает смешиваться электродным растворам. Если электрическая цепь разеденена. То в при электродных пространствах быстро наступает равновесие.
. Между электродами расположена диафрагма, которая пропускает ионы, но не дает смешиваться электродным растворам. Если электрическая цепь разеденена. То в при электродных пространствах быстро наступает равновесие.
Цинковая пластинка в гальваническом элементе легко отдает свои катионы в раствор, тогда она будет окислятся.
![]()
Каждый ион цинка, переходя в раствор, оставляет на пластинке два электрона. Из-за этого пластинка получит отрицательный заряд. На угольном электроде будут проходить процессы восстановления:
![]()
Если цепь замкнуть, то в гальваническом элементе возникнет электрический ток. Электроны из места, где плотность отрицательного заряда высока, будут переходить в место с меньшей плотностью отрицательного заряда.
В целом химическую реакцию. Которая происходит в гальваническом элементе можно записать так: ![]() . В молекулярном виде уравнение будет иметь такой вид:
. В молекулярном виде уравнение будет иметь такой вид: ![]() .
.
Важной характеристикой любого гальванического элемента будет его ЭРС. Она равна: ![]() , если округлить полученное значение ЭРС, то мы получим:
, если округлить полученное значение ЭРС, то мы получим: ![]() . При вычислении ЭРС мы не учитывали влияния концентрации ионов на величину потенциала, а приведенные значения точны только для ситуации, когда концентрации веществ равны нулю. Поэтому значение ЭРС в реальных гальванических элементах будет несколько другим. Также надо отметить, что чаще используется медно-цинковые гальванические элементы, которые более дешевы чем элементы с использованием ванадия.
. При вычислении ЭРС мы не учитывали влияния концентрации ионов на величину потенциала, а приведенные значения точны только для ситуации, когда концентрации веществ равны нулю. Поэтому значение ЭРС в реальных гальванических элементах будет несколько другим. Также надо отметить, что чаще используется медно-цинковые гальванические элементы, которые более дешевы чем элементы с использованием ванадия.
Похожие работы
... а и b очень близки. В отражённом свете хлорофилл, кажется вишнёво-красным, так как он излучает поглощённый свет с изменением длины его волны. Это свойство хлорофилла называется флюоресценцией. Биосинтез хлорофилла Исходными для синтеза хлорофилла субстратами являются очень простые органические соединения – ацетат и глицин. Процесс синтеза хлорофилла принято подразделять на три этапа. ...
... ртутью он дает амальгаму, которая при небольшом содержании свинца жидкая. 2.Химические свойства По химическим свойствам свинец – малоактивный металл: в электрохимическом ряду напряжений он стоит непосредственно перед водородом. Поэтому свинец легко вытесняется другими металлами из растворов его солей. Если опустить в подкисленный раствор ацетата свинца цинковую палочку, свинец выделяется на ...
... 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий. Основной способ получения цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ...
... из цинка. Значительна роль этого элемента в полиграфии. Из цинка делают клише, позволяющие воспроизвести в печати рисунки и фотографии. Специально приготовленный и обработанный типографский цинк воспринимает фотоизображение. Это изображение в нужных местах защищают краской, и будущее клише протравливают кислотой. Изображение приобретает рельефность, опытные граверы подчищают его, делают ...

0 комментариев