Навигация
Тонкослойная хроматография
3.3. Тонкослойная хроматография
Тонкослойная хроматография (ТСХ) является одним из наиболее простых и эффективных экспресс-методов разделения и анализа веществ в пищевых продуктах, биологических жидкостях и других объектах, не требующих сложного оборудования. В то же время метод обладает высокой избирательностью и чувствительностью (низким пределом обнаружения). Этим методом можно определить 10-20 мкг вещества с точностью до 5-7%.
В зависимости от природы НФ тонкослойная хроматография может быть адсорбционной и распределительной. Наиболее широко применим в ТСХ первый вариант разделения.
Неподвижная твердая фаза (оксид алюминия, силикагель и др.) тонким слоем наносится на стеклянную, металлическую (алюминиевая фольга) или пластмассовую пластинку, закрепляется слой с помощью крахмала или гипса (иногда используют пластинки с незакрепленным слоем). Для хроматографирования могут использоваться готовые пластинки, выпускаемые промышленностью, размером 5х15 или 20х20 см.
На расстоянии 2 см от края пластинки на стартовую линию с помощью микропипетки или микрошприца наносят пробы анализируемого раствора (диаметр пятен 3-5 мм). После испарения растворителя край пластинки помещают в стеклянную камеру, на дно которой налит растворитель (ПФ) в количестве, достаточном для образования слоя глубиной 0,5 см. Камеру закрывают крышкой.
Выбор растворителя (ПФ) зависит от природы сорбента и свойств анализируемых соединений. Например, разделение хлорорганических пестицидов на пластинке с силикагелем проводят в среде гексана. Часто применяют смеси растворителей из двух или трех компонентов. Так, при хроматографировании аминокислот используют смесь Н-бутанола с уксусной кислотой и водой, при анализе неорганических ионов - водные буферные растворы, создающие постоянное значение рН.
При хроматографировании растворитель движется снизу вверх (восходящий вариант) вдоль слоя сорбента и с разной скоростью переносит компоненты смеси, что приводит к их пространственному разделению. После окончания хроматографического процесса пластинку вынимают из камеры, отмечают линию фронта растворителя (обычно около 10 см) и высушивают.
Если компоненты смеси окрашены, то они четко видны на пластине после разделения. Неокрашенные соединения обнаруживают различными способами. Если пластину поместить в камеру с парами йода, то четко проявляются коричневые пятна для органических соединений с непредельными связями. Хроматограмму можно проявить, опрыскивая ее каким-либо реагентом, дающим с компонентами пробы окрашенные соединения. В состав нанесенного слоя в готовые пластины часто вводят люминофор. При облучении такой пластины ультрафиолетовым (УФ) светом она флуоресцирует, а разделенные компоненты пробы видны в виде темных пятен. Вещества, имеющие собственную флуоресценцию, также обнаруживают в УФ - свете (например, пестициды).
Идентификацию веществ на хроматограмме осуществляют по характеру окраски пятен, параметру удерживания Rf и с помощью стандартных веществ (свидетелей).
Величина Rf рассчитывается из экспериментальных данных по уравнению
l
Rf=__ , (3.3.1)
L
где l - расстояние от стартовой линии до центра пятна, L - расстояние, пройденное за это же время растворителем (рис. 3.3.1).
 Рис. 3.3.1. Хроматограмма двухкомпонентной смеси
Рис. 3.3.1. Хроматограмма двухкомпонентной смеси
а - а: линия старта, в - в : линия фронта растворителя
При стандартных условиях величина Rf является постоянной величиной, характерной для данного соединения. Но практика показывает, насколько трудно создавать постоянство всех факторов, от которых зависит воспроизводимость значений Rf. На величину Rf влияет качество и активность сорбента, его влажность, толщина слоя, качество растворителей и другие факторы, не всегда поддающиеся достаточному контролю.
Рис. 3.3.2. Хроматограмма жира. I - полимеризованные и сильнополярные жиры; II - фосфолипиды, III – триглицериды 1 - говяжье мясо; 2 - свинина; 3 - свинина с 29% печени; 4 - свинина с 4% печени; 5 - свинина с 50% печени; 6 - свиная печень
Поэтому наряду с величиной Rf идентификацию проводят по “свидетелю”. Стандартное вещество (свидетель), наличие которого предполагают в анализируемой смеси, наносят на линию стандарта рядом с исследуемой пробой. Таким образом, стандартное вещество хроматографируется в тех же условиях. После хроматографирования и детекции пятен сравнивают величины Rf определяемого вещества и “свидетеля”.
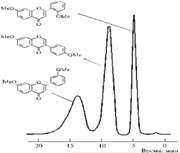
Качественный анализ после разделения компонентов смеси методом ТСХ часто используют для определения состава пищевых продуктов. Так, на рис. 3.3.2 представлена хроматограмма жира, выделенного из мясного фарша различного состава. Хроматографирование проводили на пластинках с силикагелем в системе гександиэтиловый эфир (в соотношении 3:1), пятна детектировали 10% раствором фосфорно-молибденовой кислоты, идентифицировали по голубому цвету зон на желтом фоне пластинки. Как видно из хроматограммы, при данных условиях произошло разделение фосфолипидов и триглицеридов. По характерному составу компонентов мяса и печени можно сделать вывод о натуральности мясного фарша в пробах 1-2, и добавках к нему печени в пробах 3-5.
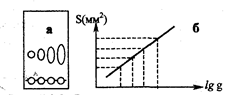
Количественное определение в ТХС может быть проведено непосредственно на пластинке, иди после удаления веществ с пластинки. При непосредственном определении на пластинке измеряют тем или иным способом площадь пятна (например, с помощью миллиметровой кальки) и по заранее построенному градуировочному графику находят количество вещества. Зависимость между массой вещества q и площадью S на хроматограммах носит нелинейный характер и является логарифмической:
 S=a lg q + в,
(3.3.2)
S=a lg q + в,
(3.3.2)
где а и в эмпирические константы. Эта зависимость линейна для количеств вещества от 1 до 80-100 мкг.
Рис. 3.3.3. Зависимость площади пятен на хроматограмме от количества вещества: а - хроматограмма, б – калибровочный график
Для построения градуировочного графика на пластинку наносят растворы, содержащие разные количества стандартного вещества, хроматографируют, проявляют зоны и измеряют их площади (рис. 3.3.3).
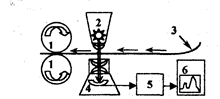
Более точен денситометрический метод определения веществ на хроматограммах (ошибка - 1-2%). В методе денситометрии производят измерение оптического поглощения проявленной хроматограммы сканирующим лучом в проходящем или отраженном свете на специальных приборах-денситометрах (рис.3.3.4.).
Рис. 3.3.4. Схема денситометра. 1 – протяжный механизм; 2 – источник света; 3 – хроматограмма, 4 – фотоэлектрический преобразователь, 5 – усилитель, 6 – самописец.
 На денситограмме получают пики, площадь которых пропорциональна содержанию вещества в пятне. Построив с помощью стандартов калибровочный график, измеряют площадь пика компонента и по графику определяют его массу в пробе. Получают развитие также спектрофотоденситометрическое и флуориметрическое определение веществ на хроматограммах.
На денситограмме получают пики, площадь которых пропорциональна содержанию вещества в пятне. Построив с помощью стандартов калибровочный график, измеряют площадь пика компонента и по графику определяют его массу в пробе. Получают развитие также спектрофотоденситометрическое и флуориметрическое определение веществ на хроматограммах.
В первом случае используют специальные спектрофотоденситометры, измеряющие поглощение вещества в монохроматическом свете, во втором измеряют флюоресценцию пятна при облучении хроматограммы УФ светом. Широкое распространение получил способ экстрагирования компонентов из зон подходящим растворителем. При применении этого способа на хроматограмму наносят стандартный раствор и раствор пробы. После получения хроматограммы производят ее обработку, детектируя зону стандарта, вырезают часть хроматограммы с зоной компонента пробы и производят его экстрагирование подходящим растворителем. Полученный раствор анализируют инструментальным методом, имеющим высокую чувствительность. Чаще всего применяют спектрофотометрические и фотоколориметрические методы. Если вещество не имеет цвета или не обладает поглощением в УФ-области, с экстрактом проводят фотометрическую реакцию, позволяющую получить интенсивно поглощающее производное вещества.
Тонкослойная хроматография находит применение при исследовании некоторых видов пищевых продуктов на безопасность. Например, для определения токсинов (афлатоксинов, микотоксинов, патулина и др.) в арахисе, в зерновых, овощах, фруктах, напитках; для определения пестицидов (ДДТ и др.) в растительных и животных продуктах, определения гистамина как показателя порчи рыбы. Кроме того, ТСХ часто сочетают с газовой хроматографией, электрофорезом и другими методами.
Похожие работы
... найти эту точку, продифференцируем данное уравнение и приравняем производную к нулю: , откуда = 2, а подставив в исходное уравнение, получим +2. Таким образом, кинетическая теория дает основу для оптимизации хроматографического процесса. Виды хроматографии Рассмотрим особенности наиболее широко применяемых видов хроматографии. Газовая хроматография - это метод, ПФ в которой является ...
... эфиров, получаемых путем реакции с бис-триметилсилилацетамидом, бис-триметилсилилтрифторацетамидом или с другими подобными реагентами. Азотосодержащие соединения Детальное рассмотрение методов хроматографического анализа азотсодержащих соединений, главным образом содержащих аминные группы, дано в монографии. При анализе азотсодержащих соединений следует обращать особое внимание на ...
... как результаты аппроксимации будут неудовлетворительными. Об этом свидетельствуют различные параметры на вышеупомянутых графиках, тогда как они должны быть одинаковыми, поскольку форма моделируемых хроматографических пиков одинакова. Различные же параметры говорят о том, что аппроксимация проводилась в разных диапазонах Cf/C. Прочитав этот материал, проницательный читатель сразу скажет: "А как ...
... . Комбинированные методы дают дополняющую друг друга информацию, позволяющую произвести правильную идентификации веществ, которые не могут быть опознаны с помощью какого- либо одного метода.[11-12] Глава 3. Примеры применения хроматографии в анализе объектов окружающей среды Анализ состояния водной среды с помощью метода газовой хроматографии[13-15] Метод газовой хроматографии для анализа ...


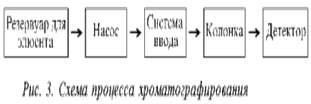


0 комментариев