Навигация
Составьте молекулярные и ионно-молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями
194. Составьте молекулярные и ионно-молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями
Fе(ОН)з + 3 Н+ = Ре3+ + 3 Н2О
Сd2+ + 2 ОН- = Сd(ОН)2
Н+ + NO2- =HNO2
Fе(ОН)3 (т)+ 3 НСl = FеС13 + 3 Н2О
Fе(ОН)3 (т) + 3 Н+ + 3 Сl- = Fе3+ + ЗСl- + 3 Н2О
Fе(ОН)3 (т) + 3 Н+ = Fе3+ + 3 Н2О
Сd(NOз)2+ 2 КОН = Сd(ОН)2 (т)+ 2 КNО3
Cd2+ + 2NO3 +2К+ +2OH- = Сd(ОН)2 (т)+ 2 К+ + 2 NО3-
Сd2 + 2 ОН- = Сd(ОН)2 (т)
НС1 + NaNО2 = НNО2 + NaС1
Н+ + Сl- + Nа+ + NO2- = НNО2 + Nа+ + Сl-
H+ +NО2 - =HNO2
214. При смешивании А12(SО4)з и Nа2СОз каждая из взятых солей гидролизуется необратимо с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями
А12(SО4)з + 3 Nа2СО3 + 3 Н2О → 2 А1(ОН)3(т) + 3 Nа2SО4 + ЗСО2(г)
2 А13+ + 3 SО42- + 6 Nа+ + ЗСО32- + 3 Н2О → 2 Fе(ОН)3 (т) + 6 Nа+ + 3 SО42- + ЗСО2(г)
2 А13+ + ЗСО32- + 3 Н2О → 2 А1(ОН)3 (т) + ЗСО2(г)
254. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов на аноде и катоде.
(-)Fе |Н2S04| |Н2S04|Аg(+)
На аноде (железо) протекает процесс Fе-2 ё = Fе2+, электроны по проводнику переходят на серебряную пластину и на поверхности серебра катоде протекает процесс
2 Н+ + 2 ё = Н2 Т ↑.
Железная пластина будет растворяться, а на серебряной пластине будет наблюдаться выделение водорода.
274. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора КВr. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1 ч 35 мин при силе тока 15 А? Ответ: 0,886г; 70,79г
При электролизе водного раствора бромида калия с инертными (графитовыми) электродами на катоде протекает процесс восстановления молекул воды и выделяется водород:
2Н2О+2ё =Н2↑ +2О1H-
На аноде протекает процесс окисления бромид-ионов и выделяется бром: 2Вг- - 2ё =Вг2 Молярная масса эквивалента водорода равна 1 г/моль, а молярная масса эквивалента брома равна 79,904 г/моль.
Тогда по законам Фарадея можно найти массу водорода и брома, которые выделяются соответственно на катоде и на аноде.
![]()
![]()
294. Какой металл целесообразнее выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Каков состав продуктов коррозии?
При протекторной защите протектор - более активный металл, чем металл защищаемой конструкции служит анодом и разрушается тем самым предохраняет от разрушения конструкцию. Поэтому, чем более отрицательный будет потенциал металла-протектора, тем эффективнее будет протекторная защита. Наиболее низкий потенциал будет у магния -2,37В, (у цинка - 0,763 В; у хрома - 0,74 В)
Так как оболочка кабеля сделана из свинца, то гальваническая пара магний - свинец будет иметь наибольшую разность потенциалов. И магний будет служить наилучшей протекторной защитой.
При атмосферной коррозии на поверхности магниевого протектора протекает процесс:
2Mg – 4ё = 2Mg2+
Электроны по проводнику переходят на свинцовый кабель и на поверхности свинца происходит кислородная деполяризация:
О2 + 2 Н2О + 4ё = 4 ОН-
Продуктом атмосферной коррозии будет гидроксид магния
2 Мg2+ + 4 ОН- = 2 Мg(ОН)2
314. Напишите выражения для констант нестойкости следующих комплексных ионов: [Аg(СN)2]-; [Аg(NН3)2]+; [Аg(SСМ)2]-. Зная, что они соответственно равны 1,0*10-21, 6,8*10-8, 2,1*10-11, укажите в каком растворе, содержащем эти ионы, при равной молярной концентрации ионов Аg+ больше?
Запишем выражения константы нестойкости для данных комплексных ионов:
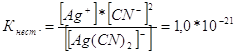
![]()
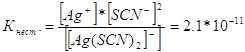
При данной температуре величина константы нестойкости есть величина постоянная. Чем меньше константа нестойкости, тем устойчивее комплекс, поэтому наибольшая концентрация ионов серебра будет в растворе, содержащем комплексный ион [Аg(NНз)2]+.
Литература
1. Ахметов Н.С. Общая и неорганическая химия. М, 2002.
2. Карапетьянц М.Х., Дракин С. И. Общая и неорганическая химия. М. 1994.
3. Глинка Л. И. Общая химия. М. 1984.
Похожие работы
... - + H3O+, внутрисферные превращения лимандов, например, координированных нитрилов R-CЇN (R - органический радикал) в амидины [Pt(R-CЇN)2Cl2] + 2NH3 [Pt()2Cl2] и другие превращения. Многие комплексные соединения являются катализаторами различных процессов гомогенного и гетерогенного катализа. Часто при получении лекарственных препаратов на основе фармакологически активных комплексных ...
... сопряжения с системами иных функциональных назначений, смежных с используемой (если таковые имеются) [3]. ОБЗОР ИСПОЛЬЗУЕМЫХ И ПРОЕКТИРУЕМЫХ СИСТЕМ Наибольшее распространение системы химического мониторинга получили в химической технологии при моделировании технологических процессов. Так, производства нитроглицерина, тротила, аммиачной селитры, фосфатов и других крупнотоннажных продуктов ...
... ) суммарное содержание всех ингредиентов, указанных в примере, равняется 100%). [7, п.3.2.4.5.] 4. Особенности определения патентоспособности В патентоведческой литературе существуют такие понятия, как прямая и абсолютная защита химических соединений. Прямая защита означает, что формула изобретения защищает непосредственно структуру или наименование химического соединения по общепринятой ...
... Просвещение, 1976. 35. Третьяков Ю.Д., Зайцев О.С. Программное пособие по общей и неорганической химии. М.: Юнити, 2005. 36. Фаязов Д.Ф. Формирование умений учащихся пользоваться химическим языком // Химия в школе. 1983. № 2. 37. Фигуровский Н.А. Открытие элементов и происхождение их названий. М.: Наука, 1970. 38. Цветков Л.А. Преподавание органической химии в средней ...

0 комментариев