Навигация
Ацилирование и алкилирование аминов
2. Ацилирование и алкилирование аминов
Третичные амины отличаются от первичных и вторичных аминов отсутствием способных к замещению атомов водорода, связанных с азотом. Это различие ясно проявляется при действии ацилирующих и алкилирующих средств; из первичных и вторичных аминов при ацилировании обычно получаются замещенные амиды, тогда как третичные амины выделяются в неизмененном состоянии после прибавления воды или водной щелочи. Атомы водорода в аминогруппе первичных и вторичных аминов могут быть замещены в определенных условиях алифатическим или ароматическим радикалом, или же остатками –СONH2, —С1, —Вг и —NO2. Эти реакции вкратце рассматриваются ниже.
АцилированиеСпособы, применяемые для ацилирования, могут быть в основном разделены на следующие группы: нагревание аминов с кислотами, взаимодействие аминов с хлорангидридами, бромангидридами или ангидридами кислот и реакция аминов со сложными эфирами, или даже с амидами кислот, дающая обычно худшие результаты.
Первый из этих способов состоит в нагревании амина с избытком соответствующей карбоновой кислоты.
![]()
Аналогичным путем получаются высшие гомологи ацетанилида. Этот способ часто применяется для идентификации одноосновных кислот. Интересно отметить, что муравьиная кислота значительно легче, чем ее гомологи, превращается в замещенные формамиды по этому способу. Форманилид легко образуется при нагревании 50%-ной водной муравьиной кислоты с анилином.
Для ацетилирования аминов рекомендуется также пользоваться тиоуксусной кислотой. Преимущество этого способа состоит в том, что ацетилирование анилина и его гомологов протекает в этом случае на холоду. Реакция протекает с выделением сероводорода.
![]()
Более удобный и распространенный способ получения ацилированных аминов заключается в применении хлорангидридов или ангидридов кислот. Хлорангидрид кислоты реагирует с избытком амина с образованием ацилированного производного и солянокислой соли амина.
![]()
Отделение солянокислой соли от ацилированного производного амина основано на их различной растворимости. Обычно реакцию ведут в таком растворителе, в котором соль амина нерастворима. Кроме того, если ацилированный амин нерастворим в воде, солянокислую соль легко удалить промыванием реакционной смеси водой
Если хлорангидрид кислоты сравнительно устойчив к действию воды и холодного водного раствора щелочи, введение ацильной группы может быть осуществлено по способу Шоттена и Баумана. Амин суспендируют в приблизительно 10%-ном водном растворе щелочи и обрабатывают хлорангидридом кислоты, взятым в 1,25—1,5-кратном против теории количестве. При этом реакционную смесь перемешивают или взбалтывают, пока большая часть хлорангидрида не прореагирует. Избыток хлорангидрида разлагают слабым нагреванием реакционной смеси. Образовавшееся трудно растворимое ацильное производное отфильтровывают, промывают водой до полного удаления щелочи и перекристаллизовывают из подходящего растворителя. Важно, чтобы в процессе реакции водный раствор-все время обладал щелочной реакцией. Этот метод с успехом применяется для хлорангидридов ароматических кислот, арилсульфоновых кислот и пирослизевой кислоты. Следует отметить, что сульфонильные производные первичных аминов растворимы в щелочах, а сульфонильные производные вторичных аминов нерастворимы. На этом основан способ распознавания и разделения первичных и вторичных аминов.
К другим способам ацилирования относятся действие хлорангидрида кислоты на эфирный раствор амина с суспендированным в нем углекислым калием, а также ацилирование в пиридине.
Для ацетилирования первичных ароматических аминов в лабораторных условиях целесообразно пользоваться уксусным ангидридом. Реакция между уксусным ангидридом и анилином или его гомологами протекает очень легко и обычно осуществляется прибавлением уксусного ангидрида к смеси амина примерно с 5-кратным по объему количеством воды. При реакции происходит выделение тепла и смесь быстро густеет, вследствие выделения ацетильного производного. Если амин обладает сравнительно высоким молекулярным весом, обычно удобнее перед прибавлением уксусного ангидрида смешивать основание с разбавленной уксусной кислотой. Применение спирта в качестве растворителя при ацетилировании аминов уксусным ангидридом на холоду имеет то преимущество, что избыток ангидрида легко можно удалить 1—2-кратным выпариванием со спиртом. Ацетилирование уксусным ангидридом в водной или спиртовой среде не дает удовлетворительных результатов при первичных ароматических аминах, содержащих в ядре отрицательные заместители.
Вышеупомянутый способ ацетилирования обладает тем преимуществом, что при этом не наблюдается образования диацетильных производных, что имеет место при применении неразбавленного уксусного ангидрида, например, в результате нагревания 10 г анилина с 40 г уксусного ангидрида в течение 1 часа продукт реакции представляет собой смесь, содержащую 10 г диацетиланилина и 5,6 г ацетанилида18. Наличие заместителей, например —СНз, —NO2, —С1, —Вг, в о-положении к аминогруппе благоприятствует образованию диацетильных производных. При нагревании о-толуидина с 4-кратным по весу количеством уксусного ангидрида с обратным холодильником получается диацетил-о-толуидин с прекрасным выходом.
Наличие в ядре ароматического амина нитрогруппы и, в меньшей степени, хлора или брома замедляет реакцию ацетилирования при комнатной температуре. Это явление становится особенно заметным при накоплении отрицательных групп в молекуле. При стоянии раствора 2, 4, б-триброманилина в избытке уксусного ангидрида при комнатной температуре в течение 2 недель ацетильное производное не образуется. Присутствие небольшого количества концентрированной серной кислоты очень сильно катализирует процесс ацетилирования, из 1 в 2, 4, 6-триброманилина в 20 г уксусного ангидрида в присутствии двух капель концентрированной серной кислоты при стоянии в течение 10 мин. при комнатной температуре получается чистый 2, 4, 6-трибромацетанилид. Для выделения продукта реакционную смесь выливают в воду.
Наилучший способ получения ацетильных производных низших алкнланилинов состоит в перегонке смеси равных объемов амина и уксусного ангидрида; выше 200° перегоняется ацетильное производное в довольно чистом состоянии. Многие из этих соединений кристаллизуются при охлаждении.
Третичные амины, благодаря своему строению, не способны к образованию амидов при взаимодействии с хлорангидридами или ангидридами кислот. Однако они могут давать с хлорангидридами продукты присоединения, которые обычно разлагаются при действии воды с образованием исходного амина. Например, продукт присоединения 1 моля пиридина к 1 молю хлористого ацетила при действии спирта превращается в солянокислый пиридин и уксусноэтиловый эфир. Хлористый диаллил также образует продукт присоединения к пиридину. Кроме того, описаны соединения, образующиеся при взаимодействии хлористого бензоила и хлористого ацетила с триэтиламином, пиридином, диметиланилином и некоторыми другими третичными аминами. Продукты присоединения триметиламина к арилсульфохлоридам сравнительно стойки к действию воды и дают хлороплатинаты и хлораураты.
Образование производных мочевиныСоли первичных и вторичных аминов с циановой кислотой более или менее легко изомеризуются с образованием замещенных производных мочевины
RNH2 HCNO -—> RNHCONH2
Эта реакция аналогична превращению циановокислого аммония в мочевину. Следующие примеры иллюстрируют применение этого способа. Первичные и вторичные амины легко реагируют с эфирами изоциановой кислоты с образованием производных мочевины. Обычно для этой цели применяют фенилизоцианат, который нагревают с эквимолекулярным количеством амина в каком-либо не содержащем гидроксила растворителе, например в петролейном эфире.
![]()
Совершенно необходимо предохранять реакционную смесь от доступа влаги и применять лишь тщательно обезвоженные растворитель и амин, так как фенилизоцианат реагирует с водой с образованием дифенилмочевины. α-Нафтилизоцианат более удобен в этом отношении, чем фенилизоцианат, так как он менее чувствителен к действию воды и поэтому при реакции образуется меньшее количество нежелательных побочных продуктов.
Фенилизотиоцианат (фенилгорчичное масло) реагирует с аминами аналогичным образом с образованием соответственных производных тиомочевины. Реакция эта осуществляется в тех же условиях, как и с фенилизоцианатом.
Алкилирование первичных и вторичных аминов
Последовательное замещение алкильными группами атомов водорода, находящихся у азота в первичных аминах, ведет к образованию вторичных и третичных аминов. Введение алкильных групп легко достигается действием на амин соответственного галоидного алкила или алкилсульфата. Состав конечного продукта реакции зависит в значительной степени от относительных количеств взятых в реакцию компонентов, а также и от условий опыта, и обычно очень трудно получить при алкилировании только одно из возможных производных амина и поэтому продукт реакции, как правило, представляет собой смесь вторичного и третичного аминов наряду с значительным количеством непрореагировавшего первичного амина, а часто с примесью некоторого количества соли четвертичного аммониевого основания. Получение сложной смеси при применении галоидного алкила является результатом образования при реакции галоидоводорода, который дает соли с находящимися в реакционной смеси аминами. Распределение галоидоводорода между аминами зависит от их относительной основности, их сравнительного количества, а также от растворимости солей аминов в реакционной смеси. При алкилировании ароматических аминов выделяющийся осадок обычно содержит значительное количество соли исходного амина, а в растворе остается алкилированный амин, который вступает в дальнейшую реакцию с галоидным алкилом. Такие затруднения могут быть преодолены, по крайней мере, до известной степени проведением алкилирования в присутствии веществ, способных связывать образующийся галоидозодород, например, углекислой или двууглекислой соли щелочного металла. Для выделения вторичных аминов, наряду с вышеупомянутыми способами, обычно, за исключением некоторых особых случаев, пользуются способностью вторичных аминов образовывать нитрозамины. При восстановлении нитрозаминов оловом с соляной кислотой или при нагревании их с минеральными кислотами получаются чистые вторичные амины. Другой способ, по которому удается получать вторичные амины с значительно лучшими выходами, основан на способности металлических производных многих замещенных амидов типа RCONHR реагировать с галоидными алкилами. Из продукта алкилирования при гидролизе получается вторичный амин
![]()
Для этой цели удобно пользоваться ацетанилидом и его гомологами. Кроме того, применялись и формильные производные первичных ароматических аминов, а также арилсульфонильные производные первичных аминов.
Другой способ получения гомологов метиланилина заключается в нагревании галоидного алкила с большим избытком ароматического амина. По окончании реакции избыток ароматического амина осаждают прибавлением водного раствора хлористого цинка. Этот способ применялся для получения многих алкиланилинов с вполне удовлетворительными результатами. Таким же путем могут быть получены алкиланилины, содержащие третичную алкильную группу. Для алкилирования аминов также можно пользоваться ди-алкилсульфатами. Впрочем, обычно, этот способ ограничивается применением имеющегося в продаже диметилсульфата. Алкилирование по этому способу проводится в индиферентном растворителе или в присутствии водной щелочи, причем последняя модификация имеет более широкое применение. Вместо диалкилсульфатов можно1 применять эфиры арилсульфоновых кислот. Спирты вступают в реакцию с солями первичных ароматических аминов, примерно, при 200° с образованием моно- и диалкилариламинов. Эта реакция имеет применение в промышленности; для получения метиланилина нагревают при 180° смесь 55 частей солянокислого анилина и 16 частей метилового спирта. Для получения диметиланилина смесь 80 частей анилина, 78 частей метилового спирта и 8 частей серной кислоты нагревают в автоклаве до 235°. В лабораторных условиях можно вместо серной кислоты пользоваться другим катализатором, например йодом. Еще более активным катализатором в этой реакции является смесь порошкообразной меди с бромистым натрием или смесь галоидных солей меди и натрия Вторичные амины могут быть также получены восстановлением. Эта реакция может быть осуществлена электролитическим путем, действием цинковой пыли и водной щелочи натрия в спиртовой среде или муравьиной кислоте.
Новый способ получения метальных производных α- и β-нафтиламинов предложен Родионовым и Введенским. Для получения моно- и диметильных производных применяется действие метилового эфира р-толуолсульфоновой кислоты на соответствующий амин.
Другой интересный способ получения вторичных аминов основан на взаимодействии азометинов с йодистыми алкилами, причем образуются соединения, которые по прибавлении воды или спирта расщепляются на вторичный амин и альдегид.
![]()
Введение в аминогруппу ароматического остатка обычно сопряжено с некоторыми затруднениями, вследствие малой реакционноспособности галоида в ароматических соединениях. Например, хлорбензол и бромбензол не вступают в реакцию с анилином в условиях, аналогичных применяемым для получения этиланилина. Впрочем, в присутствии медной бронзы или йодистой меди эта реакция протекает более гладко.
При взаимодействии третичных аминов с йодистыми алкилами образуются соли четвертичных аммониевых оснований. Общий способ получения таких соединений состоит в смешении обоих компонентов, иногда в каком-либо подходящем растворителе. Реакция протекает при комнатной температуре или при нагревании по схеме.
R'"R"R'N + RHal —> R'"R"R'RNHal
Вместо галоидных алкилов можно пользоваться диалкилсульфатами или алкиловыми эфирами ароматических сульфоновых кислот, причем получаются сернокислые или арилсульфоновокислые соли соответствующих четвертичных аммониевых оснований.
Реакция образования солей четвертичных аммониевых оснований часто применяется для идентификации третичных аминов, причем в качестве реактива наибольшее применение имеет йодистый метил. Рекомендуется также пользоваться для этой цели метиловым эфиром р-толуолсульфоновой кислоты. Ниже приводятся общие условия реакции для получения р-толуол-сульфоновокислых солей четвертичных аммониевых оснований.
При взаимодействии третичных аминов с йодистыми алкилами образуются соли четвертичных аммониевых оснований. Общий способ получения таких соединений состоит в смешении обоих компонентов, иногда в каком-либо подходящем растворителе. Реакция протекает при комнатной температуре или при нагревании по схеме
R'"R"R'N + RHal —> R'"R"R'RNHal
Вместо галоидных алкилов можно пользоваться диалкилсульфатами или алкиловыми эфирами ароматических сульфоновых кислот, причем получаются сернокислые или арилсульфоновокислые соли соответствующих четвертичных аммониевых оснований.
Соли четвертичных аммониевых оснований образуются не только в результате взаимодействия галоидных алкилов или эфиров ароматических сульфоновых кислот с третичными амидами, но и при действии эфиров йодуксусной кислоты на некоторые амины. Легче других вступают в эту реакцию бензилпиперидин, алифатические третичные амины и хинолин. В некоторых случаях для получения четвертичных аммониевых солей.
Легкость образования четвертичных аммониевых солеи сильно зависит от характера исходных соединений.
Наличие заместителей в о-положении к аминогруппе оказывает замедляющее действие на скорость реакции, что ясно видно из сравнения констант, для диметил-о-, -т- и р-толуидина, а также для хинолина и изохинолина. Это явление еще более резко выражено при наличии двух заместителей в о-положении к аминогруппе.
Например, третичные амины (III) и (IV) не реагируют с йодистым метилом при 100°, тогда как изомерные им амины, обладающие другим строением, сравнительно легко образуют четвертичные аммониевые соли
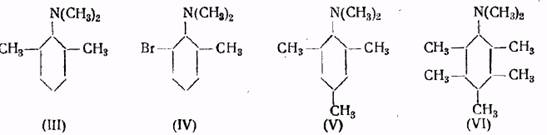
Диметилмезидин (V) и диметиламинопентаметилбензол (VI) также не способны к образованию четвертичных аммониевых соединений
Похожие работы
... 5.Нитрование Ариламинов сопровождается сильным осмолением, вплоть до самовозгорания. Ацилирование аминогруппы снижает реакционную способность кольца и защищает от окисления. 3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ Реакция синтеза бензальанилина относится к виду «присоединение-отщепление N-нуклеофилов»[1,6]. Механизм этой реакции можно показать в 5 стадиях: Стадия 1: Медленное присоединение нуклеофила к ...
... N-метилакридиния), и осадок (5-окси-N-метилакридан) окисляют хромовым ангидридом. Акридон сульфируется и нитруется в положения 3 и 3,7, а при бромировании дает 2,3-дибромпроизводное. Мною апробирован метод получения акридона из фенилантраниловой кислоты. Выбранная реакция принадлежит к реакциям замыкания цикла. ОБЗОР ЛИТЕРАТУРЫ Реакции замыкания цикла. Типы реакций. Реакции замыкания ...
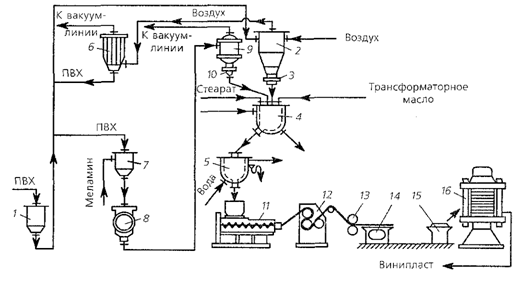
... . Получаемый ПВХ отличается высокой полидисперсностыо и широким молекулярно-массовым распределением. Достоинства полимеризации в массе: высокая чистота полимера, его повышенные электроизоляционные свойства, прозрачность изделий. Производство поливинилхлорида в суспензии Большая часть ПВХ производится суспензионным методом, обеспечивающим высокое качество полимера (со сравнительно узким ...
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...



0 комментариев