Навигация
Основные типы элементарных реакций
15. Основные типы элементарных реакций.
Общие кинетические закономерности протекания элементарных реакций не зависят от того, какие именно частицы — молекулы, свободные радикалы, ноны или комплексы — принимают участие в элементарном акте, каким образом и сколько связей разрывается или образуется в результате элементарного акта. Все эти факторы, однако, существенным образом определяют значения констант скорости или, точнее, энергий активации и предэкспоненциальных множителей, а также характер влияния среды, в которой происходит реакция, на значение кинетических параметров реакции.
В любой химической реакции происходит разрыв одних и образование других химических связей. Исключением являются лишь некоторые простейшие случаи реакции переноса электрона между частицами, например окислительно-восстановительные превращения ионов металлов:
Me1n+ + Me2m+→Me1(n-1)+ + Me2(m+1)+ (6.1)
Формально не сопровождается разрывом химических связей взаимопревращение пространственных изомеров, например цистрансизомеризация замещенных этил снов. Фактически же при этом в ходе элементарного акта должен произойти разрыв π-связи между атомами, образующими кратную связь, чтобы обеспечить возможность поворота вокруг сохраняющейся σ-связн.
Разрыв и образование двухэлектронных связей может осуществляться по двум различным механизмам—с разрывом и без разрыва электронных пар.
Химические процессы, сопровождающиеся разрывом некоторых из существующих или образованием новых электронных пар, называются гомолитическими. Примером может служить реакция атома водорода с молекулой хлора
Ĥ + С1:С1→Н:С1 + С1 (6.2)
Химические процессы, в которых образование и (или) разрушение двухэлектронных связей идет без образования и разрыва электронных пар, называются гетеролитическими.
В качестве иллюстрации можно привести гидролиз йодистого метила:
СН3:I + :ОН- → СH3:ОН + I- (6.3)
В этом случае электронная пара, с участием которой была образована разрываемая связь С—I, остается у атома иода, превращающегося в ион I-, а новая связь С—О образуется с участием неподеленной пары электронов атома О, входящего в состав иона ОН-.
Общим для гомолитических и гетеролитических реакции является взаимопревращение атомных и молекулярных орбиталей. В реакции атома водорода с молекулой хлора молекулярная σ-орбиталь, образованная Зр-орбиталями атомов CI, и атомная ls-орбиталь атома Н превращаются в молекулярную σ-орбиталь молекулы HCI и атомную Зр-орбиталь атома CI. В реакции гидролиза йодистого метила атомная орбиталь, на которой находится неподеленная пара электронов в ионе ОН- и молекулярная σ-орбиталь, образованная из р-орбитали атома I и одной из sp3-гибридных орбиталей атома С, превращаются в атомную орбиталь иона I- с неподеленной парой электронов и новую σ-орбиталь, образующую связь С—О. Фактически эти реакции классифицированы соответственно как гомолитическая и гетеролитическая потому, что в первом случае на атомной орбитали, участвующей во взаимопревращениях орбиталей, находился неспаренный электрон, а во втором — неподеленная пара электронов.
Наряду с этим возможны реакции, в которых происходит синхронное превращение нескольких молекулярных орбиталей в несколько новых молекулярных орбиталей. Такие реакции получили название согласованных реакций.
Примером такой реакции может служить распад бромистого этила на этилен и бромистый водород:
CH5Br → CH4 + HBr (6.4)
В ходе этой реакции молекулярные орбитали, образовывавшие σ-связн С—Н и С -Вr в исходном бромистом этиле, переходят в новые молекулярные орбитали — π-орбиталь этилена и σ- орбиталь молекулы НВr. В этом случае четыре электрона переходят со старых орбиталей на новые, но нет никаких оснований говорить ни о разрыве, ни о сохранении электронных пар и тем самым классифицировать процесс как гомолитический или гетеролитический.
При образовании активированного комплекса в той или иной мере затрагивается большое число атомов и химических связей в реагирующих частицах, а в случае реакций в растворах — и окружающих молекул растворителя. Например, в реакции гидролиза йодистого метила разрывается связь С—I и образуется связь С—О. Однако, помимо этого, при образовании активированного комплекса изменяется тип гибридизации молекулярных орбиталей связей С—Н, изменяется полярность связи О—Н и, существенной перестройке подвергаются сольватные оболочки вокруг реагирующих частиц. Тем не менее основными участниками химического превращения в этой реакции являются атомы С, I и О, и совокупность этих атомов можно рассматривать как реакционный центр активированного комплекса (можно изобразить этот реакционный центр в виде I***C***O. Реакционные центры различаются по числу формирующих их атомов. В зависимости от этого активированный комплекс называют двухцентровым, трехцентровьш и т. п. Связи между атомами в реакционном центре могут образовывать незамкнутую или замкнутую линию. В зависимости от этого активированный комплекс называют линейным или циклическим. В рассмотренном выше примере реакция гидролиза йодистого метила идет через линейный трехцентровый активированный комплекс.
В реакции распада бромистого этила на этилен и бромистый водород основными участниками химического превращения являются атомы С, один из атомов Н и атом Вг, и реакционный центр активированного комплекса можно изобразить в виде

Это пример четырехцентрового циклического активированного комплекса.
Реакциями, идущими через активированный комплекс с двухатомным реакционным центром, являются реакция диссоциации частицы на две или обратная ей реакция рекомбинации частиц. Общая схема такой реакции может быть записана в виде
А—В↔А…B↔A + B (6.5)
Простейшим типом реакций, идущих через трехцентровый линейный активированный комплекс, являются реакции типа
А—В + С↔А – В…С↔А + В—С (6.6)
Такие реакции обычно называют реакциями замещения при соответствующем атоме во фрагменте В. Примером такой реакции является реакция гидролиза йодистого метила, которая представляет собой реакцию замещения при углеродном атоме радикала СН3. В случае если В является атомом, а не радикалом, то обычно говорят о реакции отрыва атома. Например, реакция
СН4 + С1→СН3 + НС1 (6.7)
является реакцией отрыва атома Н от молекулы метана атомом CL К этому же типу реакций относятся реакции переноса протона
В + НА → ВН+ +А- (6.8)
лежащие в основе всех кислотно-основных равновесий.
Если в (6.6) связь между А и В кратная, то образуются не две, а одна частица:
А=В +С ↔ А — В…С↔А—В—С (6.9)
В этом случае говорят о присоединении частицы С по двойной связи А=В. Обратную реакцию — отщепление С от ABC с образованием π-связи — называют элиминированием.
В реакционном центре линейного активированного комплекса может принимать участие и большее число атомов. Так, через четырехцентровый активированный комплекс идут реакции образования свободных радикалов при взаимодействии двух валентно-насыщенных молекул по общей схеме
А—В+С—D↔A...В...С…D→ A + B-C+D' (6.10)
или в случае, когда одна из разрываемых связен двойная, по схеме
A—B + C=D↔A…В…С…D↔A+B—С—D (6.11)
По схеме, обратной (6.11), идут реакции диспропорционирования свободных радикалов, например:
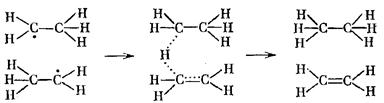
В циклическом активированном комплексе может также участвовать большое число атомов. Например, в комплексе глюкозы с α-оксипиридином
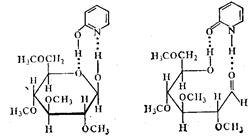
при переходе глюкозы из пиранозной формы в нециклическую синхронно разрываются четыре связи и образуются четыре новые связи. В результате этой реакции проходит мутаротация глюкозы, г. е. обращение конфигурации у первого углеродного атома. Этим объясняется сильное каталитическое действие α-оксипиридина в реакции.
Активированный комплекс одного и того же типа может реализоваться в случае как гомолитического, так и гетеролитического процесса. Например, реакции (6.3) и (6.7) идут через линейный трехцентровый активированный комплекс по типу (6.6). Однако первый процесс является гетеролитическим - связь С—I разрывается с переходом пары электрона на атом I, а новая связь С—О завязывается с участием неподеленной пары электронов ОН-. Второй процесс, наоборот, является гомолитическим — двухэлектронная связь Н—С1 образуется с участием неспаренного электрона атома Сl и одного из 1S-электронов атома Н, участвующего в образовании связи С—Н. Электронная пара, образующая эту связь, при этом разрывается и второй электрон остаётся в виде неспаренного электрона на атоме С свободного метила.
16. Окислительно - восстановительные реакции
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление — один из важнейших процессов природы.
Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд других химических процессов в основе своей являются окислительно-восстановительными реакциями. Сжигание топлива в топках паровых котлов и двигателях внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумуляторах, включают реакции окисления-восстановления.
Получение элементарных веществ (железа, хрома, марганца, золота, серебра, серы, хлора, йода и т.д.) и ценных химических продуктов (аммиака, щёлочей, азотной, серной и других кислот) основана на окислительно-восстановительных реакциях.
Инертные газы лишь в исключительных случаях способны вступать в окислительно-восстановительные реакции.
Все окислительно-восстановительные реакции можно разделить на следующие типы:
1.Реакции межатомного и межмолекулярного окисления-восстановления -обмен электронами происходит между различными атомами, молекулами или ионами. Например, простейшие реакции соединения и замещения:
2Ca+O2 = 2CaO 2Hl+Br2 = 2HBr + I2 2Al + 3CuSO4 =Al2( SO4)3 +3Cu2. Реакции диспропорционирования (самоокисления-самовосстановления ) харакктерны для соединений или простых веществ, отвечающих одному из промежуточных значений степени окисления данного элемента, например:
Cl2+2NaOH ----- NaCl +NaClOP + H2 ----- PH3 + H3PO3
3. Реакции внутримолекулярного окисления-восстановления. В этих реакциях одна составная часть молекулы выполняет функцию окислителя, а другая восстановителя. Простейшими примерами таких реакций могут служить процессы термического разложения сложного вещества на более простые составные части, например
2NO2 ----- NO2 + O2 4KСlO3 ----- KСlO4 + KCl
2KСlO3 ------ 3O2 + 2KCl 2AgNO3 ----- 2Ag + 2No2 + O2
Вывод
Российскими и зарубежными учёными успешно разрабатываются и многие другие актуальные проблемы химической кинетики например, применение квантовой механики к анализу элементарного акта реакции; установление связей между строением веществ и кинетическими параметрами, характеризующими их реакционную способность; изучение кинетики и механизма конкретных сложных химических реакций с применением новейших физических экспериментальных методов и современной вычислительной техники; использование кинетических констант в инженерных расчётах в химической и нефтехимической промышленности.
Литература
1. Эмануэль Н.М., Кнорре Д.Г. Курс химической кинетики: Учебник для хим. фак. тов. —4-е изд., перераб. и доп. —М.: Высш. шк., 1984 463 с, ил.Стромберг А.Г., Семченко Д.П.
2. Стромберг А.Г., Семченко Д.П. Физическая химия: Учеб. для хим. спец. вузов/Под ред. А.Г.Стром-берга. - 4-е изд., испр. - М.: Высш.шк., 2001. - 527 с: ил.
3. Глесстон С, Лейдлер К.» Эйринг Г. Теория абсолютных скоростей реакций — М.: ИЛ, 1948, 576 с.
4. Бенсон С. Основы химической кинетики. — М.; Мир» 1964, 603 с.
5. Воеводский В. В. Физика и химия элементарных химических процессов — М.: Наука, 1969, 414 с.
6. Кондратьев В. Н. Константы скорости газофазных реакций. — М: Наука 1970, 351 с.
7. Денисов Е. Т. Константы скорости гомолитических жидкофазных реакций — М.: Наука, 1971, 711 с.
8. Бучаченко А. Л. Химическая поляризация электронов и ядер. — М: Наука 1974, 244 с.
9. Дженкс В. П. Катализ в химии и энзимологии. — М.: Мир, 1972, 467 с. Ашмор П. Катализ и ингибирование химических реакций, — М.: Мир, 1966 507 с.
Похожие работы
... датчика и осциллографа. Экспериментальные кривые зависимости времени τ горения частиц от давления p, соответствуют теоретической зависимости. Представляют интерес экспериментальные исследования процесса горения отдельной угольной частицы, движущейся в потоке газа. Такого рода опыты проводили Н. И. Сыромятников и 3.И.Леонтьева. После воспламенения частицы наблюдалось замедление скорости ее ...
... реагирующего вещества. 4. Провести практическую часть исследования согласно выбранным методикам. 5. Проанализировать полученный результат и сформировать выводы. Объект исследования: скорость химической реакции. Предмет исследования: влияние катализаторов, температуры, концентрации вещества, площади соприкосновения, природы реагирующего вещества и давления. Методы исследования ...
... подразумевают упорядоченную связь и взаимодействие между элементами системы, благодаря которой и возникают новые целостные свойства. В такой химической системе, как молекула, именно специфический характер взаимодействия составляющих ее атомов определяет свойства молекулы. 3.2 «Триумфальное шествие органического синтеза» Возникновение структурной теории позволило химикам впервые обрести ...
... . Термодинамические функции ΔG, ΔS, ΔH для электрохимических реакций рассчитывают по уравнениям: ΔG = - nEF, (2.20) , (2.21) , (2.22) , (2.23) , (2.24) где n – число электронов, участвующих в реакции; F – число Фарадея, Кл; E – ЭДС, В. 2.2 Задачи с решениями электролит проводимость потенциал кинетика 1. Гальванический элемент состоит из металлического цинка, ...





0 комментариев