Навигация
3.2 Выбор методики
Для анализа была выбрана методика окисления хрома (III) до хрома (VI) персульфатом и титрование полученного бихромата тиосульфатом натрия как наиболее точный и требующий меньших временных затрат.
Экспериментальная часть
3.2.1 Титриметрический метод
Реактивы:
· Na2S2O3, 0,05 М раствор
· AgNO3, 0,01 М раствор
· крахмал
· KI, 20%-й раствор
· H2SO4, 1М
· персульфат аммония
Навеску пробы растворили в 100 мл дистиллированной воды. Отобрали по 10 мл полученного раствора в три термоустойчивые колбы для титрования. В каждую добавили по 10 мл серной кислоты, 5 мл раствора AgNO3 и 1г персульфата аммония, взвешенного на технических весах. Перемешали и нагрели на плитке до кипения. Кипятили 20 мин до появления ярко-жёлтой окраски раствора. Затем остудили, добавили по 5 мл раствора KI. Выделившийся йод оттитровали тиосульфатом натрия с индикатором крахмалом, 5 капель которого добавили в конце титрования. Титровали до исчезновения синей окраски и превращения цвета раствора в молочно-зелёный.
Расчётная формула
![]()

![]()
Обработка результатов
Провели три титрования:
V1 = 11,9 мл
V2 = 11,8 мл Vср = 11,9 мл
V3 = 12,0 мл
![]()
mтеор(Cr) = 0,1027 мг
Ошибка: ε = ![]() *100% = 0,38%
*100% = 0,38%
3.2.2 Электрохимический метод
Потенциометрическое титрование избытка раствора ЭДТА
Реактивы:
· ЭДТА, 0,025 М раствор
· раствор CuSO4
· ацетатный буферный раствор
· NH4SCN, 10%-й раствор
1. Навеску пробы растворили в 100 мл дистиллированной воды.
2. Приготовили рабочий раствор CuSO4. По титру рассчитали концентрацию раствора CuSO4
c(CuSO4)=![]() =
=![]() =0,139 моль/л
=0,139 моль/л
Чтобы приготовить 0,028 М раствор CuSO4 отобрали 20 мл стандартного раствора CuSO4 и разбавили дистиллированной водой в колбе на 100 мл.
c(CuSO4)=![]() =0,0278 моль/л
=0,0278 моль/л
3. В методике предлагается, что в отобранной аликвоте задачи содержалось 5-10 мг Cr3+. Рассчитали, какой объём аликвоты надо отобрать, чтобы в ней содержалось указанное количество Сr3+. Зная теоретическое значение массы полученной задачи, рассчитали концентрацию хрома в растворе:
c(Cr3+)=![]() =1,027 мг/мл
=1,027 мг/мл
4. Отобрали 20 мл раствора Cr(III) и разбавили дистиллированной водой в колбе на 50 мл. Концентрация Cr(III) в данном объёме составляет
c*(Cr3+)=V(Cr3+)* c(Cr3+)=![]() =0,5252 мг/мл
=0,5252 мг/мл
Исходя из полученной концентрации отобрали аликвоту 10 мл полученного раствора (в 10 мл содержится 5,252 мг хрома, что попадает в интервал 5-10 мг).
5. Добавили 20 мл 0,025 раствора ЭДТА, прокипятили до появления фиолетовой окраски. Затем охладили и добавили 5 мл ацетатного буфера и 0,5 мл 10% раствора роданида аммония.
6. Смесь поместили в стакан для титрования, разбавили дистиллированной водой, погрузили в раствор индикаторный платиновый электрод и хлорсеребряный электрод сравнения. Бюретку заполнили приготовленным 0,028 М раствором CuSO4, включили магнитную мешалку. Провели одно ориентировочное и два точных титрования, добавляя титрант по 0,1 мл и измеряя ЭДС после каждой порции титранта. Результаты измерений приведены в таблице.
| Vтитр, мл | ∆V | Е,mV | ∆Е | ∆Е/∆V |
| 0 | 423 | |||
| 0,5 | 0,5 | 430 | 7 | 14 |
| 1,0 | 0,5 | 435 | 5 | 10 |
| 1,5 | 0,5 | 440 | 5 | 10 |
| 2,0 | 0,5 | 448 | 8 | 16 |
| 2,5 | 0,5 | 450 | 2 | 4 |
| 3,0 | 0,5 | 455 | 5 | 10 |
| 3,1 | 0,1 | 457 | 2 | 4 |
| 3,2 | 0,1 | 457 | 0 | 0 |
| 3,3 | 0,1 | 457 | 0 | 0 |
| 3,4 | 0,1 | 457 | 0 | 0 |
| 3,5 | 0,1 | 457 | 0 | 0 |
| 3,6 | 0,1 | 457 | 0 | 0 |
| 3,7 | 0,1 | 460 | 3 | 30 |
| 3,8 | 0,1 | 461 | 1 | 10 |
| 3,9 | 0,1 | 462 | 1 | 10 |
| 4,0 | 0,1 | 468 | 6 | 60 |
| 4,1 | 0,1 | 469 | 1 | 10 |
| 4,2 | 0,1 | 469 | 0 | 0 |
| 4,3 | 0,1 | 469 | 0 | 0 |
| 4,4 | 0,1 | 470 | 1 | 10 |
| 4,5 | 0,1 | 470 | 0 | 0 |
Построили кривую титрования.
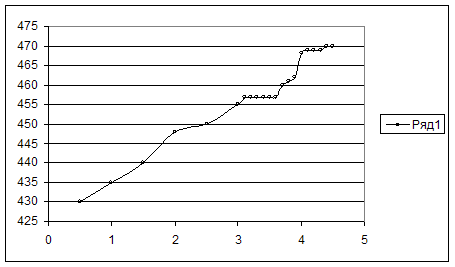
Построили дифференциальную кривую титрования и определили V в точке эквивалентности.
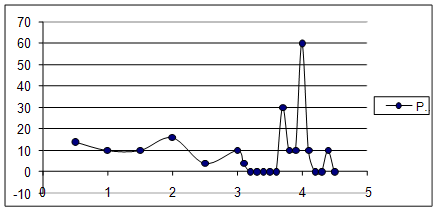
Объём титранта в ТЭ – 3,9 мл
Расчётная формула
m(Cr3+)=![]()
m(Cr3+)=![]() =0,1016 мг
=0,1016 мг
mтеор= 0,1027 мг
Ошибка: ε = ![]() *100% = 1,1%
*100% = 1,1%
Вывод
В ходе данной работы был проведён качественный анализ смеси неизвестного состава и количественный анализ одного из компонентов по двум методикам.
Ошибки определения по титриметрическому и электрохимическому методу составили соответственно 0,38% и 1,1%.
Возможные причины ошибок:
· погрешности приборов;
· потери вещества при отборе аликвот;
· в электрохимическом методе при многократном разбавлении раствора;
· при приготовлении рабочих растворов из стандартных;
В случае присутствия в растворе кроме Cr3+ других обнаруженных ранее ионов, мешающее влияние оказал бы ион Cl-,дающий осадок AgCl при добавлении AgNO3 в качестве катализатора; и ион Al3+, образующий комплекс с ЭДТА.
Список литературы
1. Шарло Г. Методы аналитической химии. Количественный анализ неорганических соединений. Часть вторая.- М.: Химия, 1969.
2. Крешков А.П. Основы аналитической химии. Книга 2.- М.: Химия, 1965.
3. Алексеев В. Н. Количественный анализ. Под ред. д-ра хим. наук П. К. Агасяна. – М.: Химия, 1972.
4. Харитонов Ю.Я. Аналитическая химия (аналитика). Книга 2.- М.: Высшая школа, 2003.
5. Харитонов Ю.Я. Аналитическая химия (аналитика). Книга 1.- М.: Высшая школа, 2003.
Похожие работы
... красного окрашивания раствора не наблюдаем, следовательно анион NO2-действительно в данной смеси отсутствует. Качественные реакции на анионы третьей аналитической группы Подтвердим присутствие в анализируемом веществе аниона NO3-. Проведем следующую реакцию: к нескольким каплям раствора неизвестного вещества прибавим 2-3 капли дефениламина и 5 капель концентрированной серной кислоты. Наблюдается ...
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...
... (II) аммония. Cd2+-+ [Hg(SCN)4]2- -> Cd[Hg(SCN)4] ()бразование бесцветных продолговатых кристаллов тетрароданомеркурата кадмия Аналитически реакции катионов VI аналитической группы по кислотно-основной классификации: Cu2+, Hg2+, Cd2+, Co2+, Ni2+ Групповой реагент – NH4OH в избытке Хотя элементы расположены в разных груупах периодической системы Д.Ию Менделеева, все эти катионы ...
... Глава II. Методики исследования загрязнения окружающей среды и оценки ее качества Для выполнения задач и достижения цели были разработаны нами методики исследования комплексной эколого-геохимической оценки урболандшафтов Волгоградской агломерации, которая заключается в исследовании почв, растительности, оценки выбросов промышленных предприятий и влияния ОС на здоровье человека. 2.1 ...
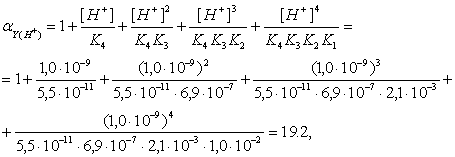

0 комментариев