Навигация
1. Рассмотрим рисунок 3.

Рис. 3 - Фрагменты ИК спектров растворов ионола (а), п-крезола (б), фенола (в) в бензоле
Видно, что полоса поглощения ионола смещена в область высоких частот (3673 см-1), но обладает наименьшей оптической плотностью, пара-крезол находится правее (3559 см-1), но оптическая плотность больше, чем у ионола и фенола еще более смещен в область низких частот: относительно ионола на 82 см-1 , а относительно спектра пара-крезола на 4 см-1 – незначительно.



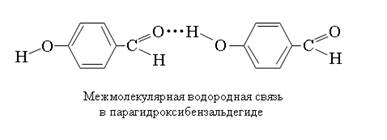
Во всех трех системах идет взаимодействие с π-электронной плотностью бензола. Легче всего образуется водородная связь с фенолом, так как взаимодействие ничем не затруднено из-за отсутствия посторонних заместителей. Видно, что у спектра(в) самая большая оптическая плотность и сдвиг в низкочастотную область, так как в растворе образуется большое количество ассоциатов.
В паракрезоле в параположении находится СН3 – группа, которая увеличивает электронную плотность кольца за счет положительного мезомерного и индуктивного эффектов, что оказывает влияние на реакционную способность ОН-группы. Из рисунка 3 видно, что количество ассоциатов уже меньше и пик сдвинут значительно в область низких частот. Аналогично из спектра ионола видно, что ассоциатов небольшое, так как образование водородной связи затруднено трет-бутильных заместителей.
2. Рассмотрим рисунок 1.

Рис.1 - Фрагменты ИК спектров растворов ионола в четыреххлористом углероде (а), в хлороформе (б) и бензоле (в).
Из рисунка видно влияние природы растворителя на способность к образованию водородной связи с ионолом. В четыреххлористом углероде водородная связь с ионолом не образуется, так как растворитель инертный в силу отсутствия протонов. С хлороформом, благодаря наличию одного протона происходит взаимодействиеполоса поглощения смещена на 6 см-1 в низкочастотную область и наблюдается уширение спектра, что также связано с образованием водородной связи. В растворе бензола также происходит образование водородной связи между растворителем и веществом, и пик еще менее острый и с более низкой оптической плотностью ИК-поглощение свободных ОН-групп, что также говорит об увеличении доли ассоциатов в растворе.
Таблица 1 - Характеристика ИК полос поглощения гидроксильных групп растворов ионола
| Растворитель | ν, см-1 | Оптическая плотность ИК поглощения ОН своб. |
| Четырёххлористый углерод (CCl4) | 3649 | 0,34 |
| Хлороформ (CHCl3) | 3643 | 0,29 |
| Хлористый метилен (СН2Cl2) | 3638 | 0,24 |
| Бензол (C6H6) | 3637 | 0,23 |
| Толуол (C7H8) | 3637 | 0,23 |
| Кумол (C9H12) | 3643 | 0,19 |
| Примечание: ν – частота максимума полосы поглощения в ИК спектрах растворов ионола в области валентных колебаний ОН-группы | ||
Из таблицы 1 видно, что при растворении ионола в бензоле и толуоле частота и оптическая плотность одинаковы. Возможно, это связано с недостаточной чувствительностью прибора, так как СН3-группа влияет на электронную плотность кольца за счет положительных мезомерного и индуктивного эффектов.


3. Рассмотрим рисунок 2.

Рис. 2 – Фрагменты ИК спектров растворов БФ в четыреххлористом углероде (а), в хлороформе (б) и бензоле (в).
Таблица 2 - Характеристика ИК полос поглощения гидроксильных групп растворов БФ
| Растворитель | ν, см-1 | Оптическая плотность в областях спектра ИК поглощения | |||
| ОН (своб.) | ОН… π связь | ОН (внутримол.) | ОН (межмол.) | ||
| Четырёххлористый углерод (CCl4) | 3631, 3508, 3440 | 0.32 | - | 0.69 | 0.31 |
| Хлороформ (CHCl3) | 3622, 3508, 3438 | 0.46 | - | 0.33 | 0.38 |
| Хлористый метилен (СН2Cl2) | 3620, 3508, 3435 | 0.60 | - | 0.42 | 0.54 |
| Бензол (C6H6) | 3612, 3573, 3504, 3427 | 0.39 | 0.26 | 0.59 | 0.44 |
| Толуол (C7H8) | 3612, 3573, 3504, 3437 | 0.35 | 0.29 | 0.58 | 0.40 |
| Кумол (C9H12) | 3610, 3573, 3504, 3437 | 0.31 | 0.27 | 0.63 | 0.39 |
Из рисунка видно, что при растворении БФ в четыреххлористом углероде(а) присутствуют ОН-группы в свободном состоянии(3631 см-1), также видно, что преобладает цис-форма БФ(3508 см-1), то есть образуется внутримолекулярная водородная связь, но есть и небольшая доля транс-БФ(3440 см-1), то есть образуется межмолекулярная водородная связь. Из фрагмента спектра хлороформа (б) видно, что БФ со свободными ОН-группами уже меньше(3622 см-1), а соотношение цис- и транс-БФ примерно 1:1, то есть в хлороформе в равной степени идет образование как внутримолекулярной, так и межмолекулярной водородной связи(3508 см-1 и 3438 см-1 соответственно). В растворе бензола (в) свободные ОН-группы практически отсутствуют, появляется небольшой пик с частотой 3573 см-1 , это говорит о взаимодействии БФ с π-системой бензола и здесь вновь преобладает цис-БФ(внутримолекулярная водородная связь) и в меньшем количестве транс-БФ(межмолекулярная водородная связь). Из таблицы 2 также видно, что при растворении БФ в толуоле и кумоле также преимущественно образуется цис-БФ, в меньшей степени транс-БФ, практически отсутствуют свободные ОН-группы.
Заключение
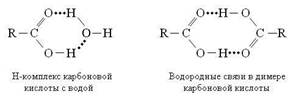
Анализ спектральных характеристик растворов пространственно-затрудненных фенолов показал, что на проявление межмолекулярных взаимодействий влияет тип и полярность растворителя. Так, CCl4 не способствует образованию межмолекулярных водородных связей в растворах фенолов, являясь инертной средой. С повышением полярности хлорсодержащих растворителей наблюдается увеличение интенсивности и сдвиг максимума полос поглощения гидроксильных групп в область низких частот, что объясняется межмолекулярным взаимодействием их с кислыми протонами CHCl3 и CH2Cl2. В ароматических растворителях обнаружено межмолекулярное взаимодействие гидроксильных протонов фенолов с π-электронной системой ароматических углеводородов. Кроме того, использование в качестве растворителей хлорсодержащих и ароматических углеводородов позволило доказать, что в полярных хлорсодержащих и ароматических растворителях БФ содержит смесь соединений с ВМВС и ММВС, находящихся в лабильном динамическом равновесии.
Список использованной литературы
1. А.В. Васильев, Е.В. Гриненко «Инфракрасные спектры органических и природных соединений», Санкт-Петербург, 2007г.,30с.
2. Дж. Робертс, М. Касерио «Основы органической химии», М., Мир, 1978 г, 842 с.
3. Пиментел Дж. Мак Клеллан «Водородная связь», М., Мир, 1964, 462с.
4. Москва В.В. Водородная связь в органической химии // Соросовский образовательный журнал.1999.№2. с.58-64.
Похожие работы
... обнаружено смещение кислотно-основного равновесия молекулярный комплекс ионная пара вправо при повышении полярности растворителя. Кроме указанных фиксируются и другие структурные и спектроскопические особенности водородных связей, которые используются, с одной стороны, для идентификации последних, а с другой – в расшифровке их электронной природы. Так как водородная связь возникает только в том ...
... и природы вещества, участвующего в электрохимической реакции. Электрохимические параметры при этом служат аналитическими сигналами, при условии, что они измерены достаточно точно. Электрохимические методы анализа в практику химического анализа вошли сравнительно давно и занимают в ней важную роль. Впервые потенциометрическое титрование было проведено в 1893 г. в институте Оствальда в Лейпциге, а ...
... геномах растений, вызываемые с помощью ФПУ-трансформированной человеческой речи, которая резонансно взаимодействует с хромосомной ДНК in vivo [25,29]. Этот результат, осмысленный нами с позиций семиотико-волновой составляющей генетического кода, имеет существенное методологическое значение и для анализа таких суперзнаковых объектов, как тексты ДНК, и для генома в целом. Открываются принципиально ...
... (47) Величина, обратная t, характеризует скорость прироста при данной температуре концентрации триплетных молекул акцептора энергии, q = 1/t , и называется константой скорости процесса [161]. Итак, прирост в результате отжига образца числа молекул, участвующих в излучении сенсибилизированной фосфоресценции происходит по экспоненциальному закону. Константа скорости этого ...







0 комментариев