Навигация
Определение изотерм адсорбции из хроматографических данных
1.3.1 Определение изотерм адсорбции из хроматографических данных
Основное уравнение теории равновесной хроматографии связывает линейную скорость uc перемещения вдоль колонки концентрации c вещества в газовой фазе с объемной скоростью газового потока w и c наклоном изотермы распределения dca/dc:
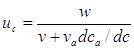 , (10)
, (10)
где v и va – объемы газовой фазы и адсорбционного слоя соответственно на единицу длины колонки; ca – концентрация вещества в адсорбционном слое.
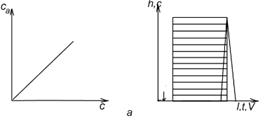
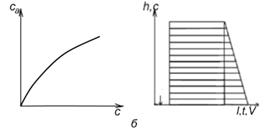
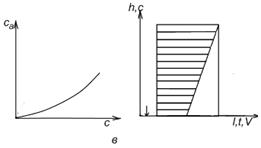
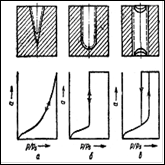
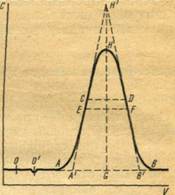
а – линейная изотерма адсорбции, симметричный пик; б – изотерма адсорбции, выпуклая к оси адсорбции, пик с острой передней границей и растянутой задней границей; в – изотерма адсорбции выпуклая к оси концентрации, пик растянутой передней границей и острой задней границей.
Рисунок 2 - Схематическое изображение изотерм адсорбции (слева) и соответствующих им хроматографических пиков и их графическое интегрирование (справа)
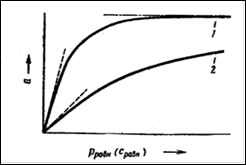
Как видно из уравнения (10), скорость перемещения газа вдоль колонки зависит от формы изотермы распределения. Если изотерма линейна (подчиняется закону Генри), то производная dca/dc постоянна и все концентрации в газовой фазе передвигаются вдоль колонки с одной и той же скорость. Хроматографическая полоса запишется детектором в виде симметричного пика (рис 2а). При отклонении изотермы от закона Генри величина производной dca/dc изменяется с изменением концентрации c. Если изотерма адсорбции обращена выпуклостью к оси адсорбции (рис 2б) производная dca/dc уменьшается при увеличении концентрации c. Тогда, как следует из уравнения (10), большие концентрации перемещаются с большей скоростью, чем малые концентрации, что приводит к обострению передней границы пика и к растягиванию задней границы. Наоборот, если изотерма адсорбции выпукла к оси концентраций (рис 2в), производная dca/dc с ростом c увеличивается. В этом случае малые концентрации будут перемещаться с большей скоростью, что приведет к растягиванию передней границы пика и обострению задней границы.
В теории равновесной хроматографии предполагается соблюдение условий, практически устраняющее диффузионное и кинетическое размывание хроматографической полосы. Поэтому форма хроматографического пика определяется только равновесной изотермой адсорбции.
Из уравнения (10) вытекает следующая связь между исправленным удерживаемым объемом VR и изотермой адсорбции:
![]() (11)
(11)
где Va – объем адсорбционного слоя в колонке. Отсюда следует что
![]() . (12)
. (12)
Переходя от концентрации ca в объеме поверхностного слоя к величине адсорбции a, отнесенной к единице массы адсорбента, получаем
 (13)
(13)
где g – вес адсорбента в колонке. Уравнение (13) позволяет найти величину a для разных значений c, то есть изотерму адсорбции a=φ(c) или a=f(p), где p - парциальное давление вещества в газе-носителе.
Для численного расчета изотермы в это уравнение необходимо ввести значения удерживаемого объема VR и концентрации c, выраженные через величины, записанные на диаграммной ленте в хроматографическом опыте. Поэтому показания детектора надо выразить в единицах концентрации. Для детектора по теплопроводности отклонения самописца h пропорциональны c;
c=K*h, (14)
где K – постоянная величина для данного адсорбата диапозона чувствительности детектора. Величина K может быть определена фронтальным методом из отклонений пера самописца при разных концентрациях c адсорбата в газе-носителе. Этот метод вполне надежен, но требует получения точно известных концентраций. Кроме того, не все хроматографы приспособлены для работы фронтальным методом. Поэтому удобнее определять K из самых проявительных хроматограмм, вводя в колонку точно известную массу адсорбата m.
После выхода адсорбата из колонки
 (15)
(15)
где v – объем протекающего через колонку газа, а пределы интегрирования соответствуют началу v1 и концу v2. Таким образом, учитывая выражения (14)
 (16)
(16)
Обычно на самописце дается не шкала v, а шкала длины диаграммной ленты l в направлении ее движения. Если скорость движения диаграммной ленты равна q, а объемная скорость газа носителя при температуре колонки – w, то
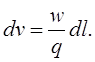 (17)
(17)
Подставляя это выражение в уравнение (16), получаем
 (18)
(18)
где 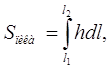 (19)
(19)
представляет площадь под всей кривой проявительной хроматограммы адсорбата, то есть площадь пика. Таким образом, калибровочная константа детектора равна
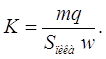 (20)
(20)
Для определения K в колонку вводят калиброванным микрошприцем разные пробы адсорбата, измеряют площади пиков и строят графики зависимости Sпика w от mq. Наклон этой кривой дает константу детектора K. Определение K следует проводить при той же температуре, при которой измеряется изотерма адсорбции. Объемную скорость газа-носителя надо привести к температуре и среднему давлению в колонке.
Для определения величины адсорбции a в формулу (13) подставляют выражения dc=Kdh и VR=w(tc-t0)=w(lh-l0)/q, где tc – время удерживания адсорбата при его концентрации c в газовой фазе; t0 – время удерживания не адсорбирующегося компонента; (lh-l0) – расстояние на диаграммной ленте самописца от момента выхода газа-носителя до момента выхода газа с концентрацией адсорбата c (то есть до соответствующего отклонения пера самописца h). Отсюда следует что,
 . (21)
. (21)
Здесь  (22)
(22)
представляет площадь на диаграммной ленте самописца между осью h при l=l0 и растянутым краем пика адсорбата. На рис. 2 показаны примеры определения этой площади для трех типов пиков: симметричных (а), с растянутым задним краем (б) и с растянутым передним краем (в). Заштрихована площадь Sадс, выражающая интеграл.
Если на изотерме адсорбции есть точки перегиба, то проявительные хроматограммы имеют сложную форму. Подставляя выражение (20) для K в формулу (21), получаем
 (23)
(23)
Величина концентрации адсорбата в газе, равновесная величине адсорбции a, составляет
 (24)
(24)
а его парциальное давление –
 (25)
(25)
Формулы (23) и (25) используют для определения величин a и p из записанной на диаграммной ленте самописца хроматограммы в тех случаях, когда не производилась отдельная калибровка детектора [4, 7, 9].
Похожие работы
... в условиях многоразового использования при температуре до 1000 °С в воздушной среде; матрица — неорганическая (бариевый глиноземистый цемент). [19]. 6. Сырье, используемое в производстве композиционных хемосорбционных волокнистых материалов Поликон К Фенол (ГОСТ 23519-93) – С6Н5ОН (молекулярная масса 94,1) при температуре 25 0C твердое белое кристаллическое вещество (в виде ромбических игл), ...
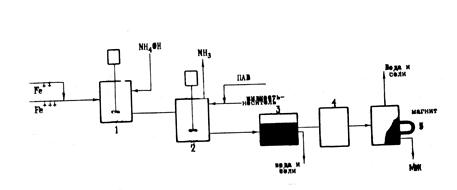
... полученных в ходе выполнения настоящей работы магнитных жидкостей (с магнитными оксидами железа в качестве дисперсионной фазы). Применение магнитных жидкостей позволяет варьировать свойства данных сорбентов в широких пределах. ü Методом электронно-микроскопического исследования показано, что разработанный способ получения магнитных сорбентов обеспечивает равномерное распределение частиц ...
... или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение: {[Fe(OH)3]m n FeO+ · (n–x)Cl–}x+ x Cl– 4.2.2 Агрегативная устойчивость лиофобных коллоидов. Строение коллоидной мицеллы Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения ...
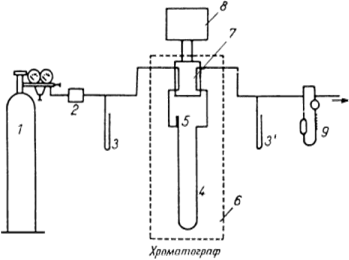
... , газ-носитель поступает в колонку, представляющую собой трубку, заполненную сорбентом или другим хроматографическим материалом, играющим роль неподвижной фазы. Рис.5 Схема работы газового хроматографа: 1 – баллон высокого давления с газом-носителем; 2 – стабилизатор потока; 3 и 3 ' – манометры; 4 – хроматографическая колонка; 5 – устройство для ввода пробы; 6 – термостат; 7 – детектор; ...


0 комментариев