Навигация
Джерела енергії і генератори енергії
Курсова робота
Джерела енергії і генератори енергії
Вступ
Сукупність усіх видів енергетичних ресурсів, підприємств по їхньому видобутку, виробництву, транспортуванню, перетворенню і використанню з метою забезпечення споживачів різними видами енергії складає паливно-енергетичний комплекс країни (ПЕК).
Найважливішими складовими ПЕК є енергетика і паливна промисловість.
Енергетика – галузь народного господарства, що охоплює одержання, перетворення, передачу і використання різних видів енергії й енергетичних ресурсів. Кінцевим результатом функціонування енергетики як галузі промисловості є корисна енергія, тобто енергія, що надходить до споживача і забезпечує корисну роботу промислових, транспортних, сільськогосподарських, будівельних і інших машин, систем, установок, приладів. Темпи розвитку енергетики обумовлюються безупинно зростаючим попитом на енергію у всіх сферах людської діяльності – виробничої, наукової, управлінської, охорони здоров'я, комунально-побутової, культурної й ін. З другої половини XX в., в умовах науково-технічної революції, потреби суспільства в енергії, і насамперед в електричній, ростуть особливо швидко.
Ступінь задоволення виробництва в електричній, механічній і тепловій енергіях визначає енергооснащеність праці – показник, що характеризує зв'язок витрат живої праці з виробничим споживанням енергії.
Підвищення енергооснащеності праці – одне з основних умов прискорення темпів науково-технічного прогресу, росту продуктивності праці. В даний час значення енергетики для економіки нашої країни зросло настільки, що масштаби виробництва і практичного використання енергії й енергетичних ресурсів розглядаються як найважливіші показники економічного потенціалу країни, її виробничих (технологічних) і наукових можливостей. Розвиткові енергетики і насамперед електроенергетики в нашій країні завжди приділялося і приділяється найпильніша увага.
Основні види енергетичних ресурсів – органічне паливо (вугілля, нафта, природний газ), енергія водного потоку (гідроенергетичні ресурси), ядерна енергія, внутрішнє тепло Землі (геотермальні ресурси), енергія вітру і сонячного випромінювання (сонячної радіації).
1. Паливо
1.1 Види палива
Основним джерелом теплоти в промисловості, на транспорті, в сільському органічного походження. господарстві і в побуті є горючі речовини Останнім часом на електричних станціях і в установках спеціального призначення застосовують ядерне паливо. Застосування тієї чи іншої горючої речовини для технічних потреб визначається техніко-економічними і плановими міркуваннями.
Залежно від призначення технологічне і побутове.
Всі види органічного палива можуть бути поділені за агрегатним станом на тверді, рідкі і газоподібні, а за способом добування на природні й штучні.
До природного твердого палива належать: антрацити, кам’яне вугілля, буре вугілля, торф, дрова, горючі сланці, відходи промисловості і сільського господарства – здубиця, лушпиння, костриця.
Штучне тверде паливо: брикети (торф'яні, буро-вугільні, кам'яновугільні), кокс (кам'яновугільний, торф'яний, нафтовий) напівкокс (буро-вугільний, торф'яний); деревне вугілля, пил (вугільний, торф'яний, сланцевий).
Природне рідке паливо: нафта (сира нафта). Штучні рідкого палива: нафтові продукти – бензин, лігроїн, керосин, мазут, спирти, колоїдне паливо (суміш мазуту з вугільним пилом).
Природне газоподібне паливо – природний газ. До штучних видів газоподібного палива належать гази: доменний, коксовий, генераторний, напівкоксовий, крекінг-газ, газ підземної газифікації.
1.2 Загальні характеристики твердого й рідкого палива
Склад палива. Паливо в такому вигляді, в якому воно ходить до споживача, називається робочим паливом. Тверде й рідке робоче паливо складається з вуглецю С, водню Н, кисню О, азоту N, леткої (або горючої) сірки Sл, мінерал (точніше твердих негорючих) домішок А і вологи W.
Тверді негорючі домішки характеризують зольність палива. Тому величину А звичайно називають вмістом золи в паливі, хоча це не зовсім точно, бо шлак і зола – це вогнищеві залишки, що утворюються під час спалювання палива.
Склад твердого й рідкого палива прийнято виражати у вагових процентах. Якщо позначити ваговий процентний вміст компонентів у робочому паливі С![]() , Н
, Н![]() , О
, О![]()
![]() і т.д., то очевидно
і т.д., то очевидно
C![]() +H
+H![]() +O
+O![]() +N
+N![]() +S
+S![]() +A
+A![]() +W
+W![]() = 100% (1)
= 100% (1)
Отже, застосовується елементарний склад робочого палива (термін «елементарний» – умовний, оскільки А і W не хімічні елементи).
Паливо, з якого сушінням повністю видалена волога, називають абсолютно сухим паливом, або абсолютно сухою масою палива. Абсолютно сухе паливо містить шість компонентів, і його склад записується так:
C![]() +H
+H![]() +O
+O![]() +N
+N![]() +S
+S![]() +A
+A![]() =100% (2)
=100% (2)
де С![]() , Н
, Н![]() і т.д. – ваговий процент вуглецю, водню і т.д. в абсолютно сухому паливі.
і т.д. – ваговий процент вуглецю, водню і т.д. в абсолютно сухому паливі.
Якщо припустити, що з абсолютно сухого палива виділені негорючі домішки А, то залишається п'ять компонентів, що становлять так звану горючу масу палива. Її елементарний склад:
C![]() +H
+H![]() +O
+O![]() +N
+N![]() +S
+S![]() =100% (3)
=100% (3)
Сірка в паливі міститься в різних сполуках: сульфатна S![]() входить до складу сульфатів СаSO4, Na2SO4, К2SO4; колчеданна S
входить до складу сульфатів СаSO4, Na2SO4, К2SO4; колчеданна S![]() – у сполуці з металами (звичайно з залізом у вигляді FeS2) і органічна S
– у сполуці з металами (звичайно з залізом у вигляді FeS2) і органічна S![]() – у складі органічних сполук. Сульфатна сірка не горить, і її наявність ураховується в негорючих домішках А. Органічна і колчеданна сірки беруть участь у горінні, і їх сума становить летку (або горючу) сірку палива S
– у складі органічних сполук. Сульфатна сірка не горить, і її наявність ураховується в негорючих домішках А. Органічна і колчеданна сірки беруть участь у горінні, і їх сума становить летку (або горючу) сірку палива S![]() =S
=S![]() +S
+S![]() .
.
Якщо вилучити з горючої маси палива колчеданну сірку, то залишається паливо такого складу:
С° +Н° + O° + N° + S° = 100%. (4)
Такий склад палива називається органічною масою палива. Здебільшого вміст органічної сірки в паливі невеликий (десяті частки процентів). Тому іноді записують склад органічної маси палива спрощено: С° + Н° + O° + N° = 100%.
Види вологи і форми зв'язку її з органічною речовиною різні і досить складні. В теплотехніці прийнята не зовсім точна, але проста й зручна класифікація, за якою волога робочого палива Wр поділяється на два види: повітряну Wр, що видаляється при кімнатній температурі, і гігроскопічну Wр, що видаляється в сушильній шафі при температурі 102–105° С. Отже,
W![]() = W
= W![]() + W
+ W ![]() (5)
(5)
Паливо, з якого видалена повітряна волога, називаєтьcя повітряно-сухим паливом, або аналітичною пробою. Паливо цього складу використовують для проведення технічного аналізу в лабораторіях. Вміст гігроскопічної вологи, виражений у вагових процентах відносно до складу аналітичної проби, позначається Wa, відносно до складу робочого палива W![]() . Оскільки робоче паливо
. Оскільки робоче паливо
відрізняється від аналітичної проби вмістом W![]() , то
, то
W![]() = W
= W![]()
![]() (6)
(6)
Склад аналітичної маси палива:
Cа + Hа + Oа + Nа +S![]() +Aа +Wа=100%. (7)
+Aа +Wа=100%. (7)
Під час проектування і експлуатації котельних установок досить часто доводиться робити перерахунки складу палива. Склад робочого палива може значно змінюватися, бо величини A![]() і W
і W![]() коливаються в широких межах. У той самий час склад горючої маси палива більш-менш стабільний. Це дає можливість за складом горючої маси із задовільною точністю визначати склад робочого палива, не роблячи щоразу повного елементарного аналізу палива. Перерахунки роблять у випадку надходження на склади палива із змінною вологістю, якщо треба підсушити паливо, під час лабораторних аналізів тощо.
коливаються в широких межах. У той самий час склад горючої маси палива більш-менш стабільний. Це дає можливість за складом горючої маси із задовільною точністю визначати склад робочого палива, не роблячи щоразу повного елементарного аналізу палива. Перерахунки роблять у випадку надходження на склади палива із змінною вологістю, якщо треба підсушити паливо, під час лабораторних аналізів тощо.
Під час перерахунків треба визначити, вмістом яких компонентів відрізняється шуканий склад від заданого, і користуватися правилом пропорцій.
Найважливішою характеристикою палива є його горюча маса. Її склад для кожного виду палива дається в таблицях, якими найчастіше користуються під час перерахунків. Якщо відомий склад горючої маси (C![]() , Н
, Н![]() і т.д.), зольність Ар і вологість W
і т.д.), зольність Ар і вологість W![]() робочого палива, то легко знайти елементарний склад робочого палива. Наприклад:
робочого палива, то легко знайти елементарний склад робочого палива. Наприклад:
С![]() = С
= С![]()
![]() (8)
(8)
Користуючись коефіцієнтом перерахунку ![]() , можна визначити решту компонентів у робочому паливі (Н
, можна визначити решту компонентів у робочому паливі (Н![]() , О
, О![]() і т.д.). Аналогічно розв'язуються й інші завдання під час перерахунку складу палива.
і т.д.). Аналогічно розв'язуються й інші завдання під час перерахунку складу палива.
Теплота згоряння. Теплота згоряння (тепловидатність) палива Q кДж/кг–це теплота реакції горіння палива, тобто та кількість теплоти, яка виділяється при повному згорянні 1 кг твердого або рідкого палива і при охолодженні продуктів горіння до початкової температури процесу.
У паливі міститься три горючі компоненти – вуглець, водень і сірка. Внаслідок горіння водню і випаровування вологи палива утворюється водяна пара. Під час охолодження продуктів горіння можливі два випадки: Н2О залишається в димових газах у вигляді водяної пари; водяна пара конденсується. Це залежить від парціального тиску пари і кінцевої температури продуктів горіння. В першому випадку буде реалізована менша кількість теплоти, а в другому – більша, бо виділиться теплота конденсації водяної пари.
Тому розрізняють нижню (меншу) і верхню теплоту згоряння палива.
Для даного палива чисельно найменшою величиною буде нижня теплота згоряння робочого палива Q![]() , а найбільшою – верхня теплота згоряння органічної маси Q
, а найбільшою – верхня теплота згоряння органічної маси Q![]() . У розрахунковій практиці звичайно користуються величиною Q
. У розрахунковій практиці звичайно користуються величиною Q![]() .
.
Залежність між верхньою і нижньою теплотою згоряння робочого палива можна визначити за формулою
Q![]() =Q
=Q![]() – Q
– Q![]() , де
, де
Q![]() = rGn є теплотою конденсації тієї кількості водяної пари Gn, яка утворюється в процесі горіння. Внаслідок горіння водню, відповідно до стехіометричного співвідношення 2Н2 + O2 == 2Н2О, утворюється приблизно 9
= rGn є теплотою конденсації тієї кількості водяної пари Gn, яка утворюється в процесі горіння. Внаслідок горіння водню, відповідно до стехіометричного співвідношення 2Н2 + O2 == 2Н2О, утворюється приблизно 9![]() кг водяної пари. До цього треба також додати ще
кг водяної пари. До цього треба також додати ще ![]() кг водяної пари, що утворилася внаслідок випаровування вологи палива. Отже, G
кг водяної пари, що утворилася внаслідок випаровування вологи палива. Отже, G![]() @
@![]() кг.
кг.
Вважаючи, що r округлено (з урахуванням того, що парціальний тиск водяної пари в продуктах згоряння малий) дорівнює 2500 кДж/кг, дістанемо:
Qn =rGn =25 (9H![]() + W
+ W![]() ) кДж/кг
) кДж/кг
звідси
Q![]() = Q
= Q![]() – 25 (9H
– 25 (9H![]() + W
+ W![]() ) кДж/кг (9)
) кДж/кг (9)
Аналогічно Q![]() =Q
=Q![]() -225 Н°. Такі співвідношення легко здобути для будь-якого складу палива. Паливо можна спалювати або при постійному тиску, або при постійному об'ємі. При цьому теплота згоряння при постійному об'ємі буде трохи більша, ніж при постійному тиску. Проте для переважної більшості палив різниця ця настільки мала, що нею нехтують.
-225 Н°. Такі співвідношення легко здобути для будь-якого складу палива. Паливо можна спалювати або при постійному тиску, або при постійному об'ємі. При цьому теплота згоряння при постійному об'ємі буде трохи більша, ніж при постійному тиску. Проте для переважної більшості палив різниця ця настільки мала, що нею нехтують.
Теплота згоряння палива не залежить від температур, які діють під час процесу, але залежить від початкової і рівної їй кінцевої температур процесу. В технічних розрахунках користуються значеннями теплоти згоряння, здобутими при температурі +20°С.
Визначити теплоту згоряння палива можна по-різному. Наближені значення теплоти згоряння можна дістати з емпіричних формул, що зв'язують теплоту згоряння палива з його елементарним складом. Найкращою формулою цього типу є формула Менделєєва:
Q![]() = 338С
= 338С![]() +1256H
+1256H![]() + 109 (O
+ 109 (O![]() –S
–S![]() ) -25 (9H
) -25 (9H![]() – W
– W![]() ) кДж/кг. (10)
) кДж/кг. (10)
Якщо відома теплота згоряння якогось складу палива (наприклад, горючої маси), то значення Q для іншого складу можна здобути перерахунком. Проте в цьому разі не можна, як і при перерахунку складу палива, обмежитися простим застосуванням правила пропорцій, а треба врахувати вплив на Q того чи іншого компонента. Наприклад, якщо відоме Q![]() і треба знайти Q
і треба знайти Q![]() , то перерахунок робиться за такою формулою:
, то перерахунок робиться за такою формулою:
Q![]() =Q
=Q![]()
![]() 25W
25W![]() (11)
(11)
Тут зольність робочого палива враховується один раз, а волога двічі – як компонент, що знижує кількість горючих речовин у паливі, і компонент, що потребує затрати теплоти для свого випаровування.
Більш надійно теплоту згоряння палива можна визначити в калориметричній установці, схему якої показано на мал. 1.
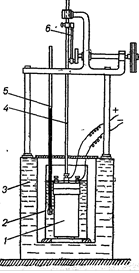
Мал. – 1 калориметрична установка: 1-калориметрична бомба; 2-резервуар калориметра; 3 - двостінний захисний кожух з водою; 4 - мішалка; 5 - термометр; 6 - приводний механізм мішалки
Основним елементом установки є калориметрична бомба 1, в яку вміщують аналітичну пробу палива із встановленою в ній залізною дротинкою. Бомбу заповнюють киснем під тиском 25–30 бар і установлюють у посудину з водою. При вмиканні електричного струму проба палива займається від розжареної дротинки і згоряє, а теплота, що виділяється при цьому, передається воді і деталям калориметра.
За підвищенням температури води (з урахуванням теплоти, переданої деталям калориметра, і поправок) визначають найвищу теплоту згоряння аналітичної проби Q![]() .
.
Нижчу теплоту згоряння робочого палива можна знайти з результатів калориметричного визначення за формулою:
Q![]() =Q
=Q![]()
![]() 25 (9Н
25 (9Н![]() +W
+W![]() ) (12)
) (12)
Для оцінювання запасів палива, його питомих витрат і різних зіставлень користуються поняттям умовного палива, теплота згоряння якого становить 29,3 МДж/кг (7000 ккал/кг).
Баласт. Баластом робочого палива є сірка, зола і волога. Хоч сірка – горючий елемент, її вважають баластом, бо внаслідок її згоряння утворюються шкідливі продукти: сірчаний і (в невеликій кількості) сірчаний ангідриди. Сірчаний газ отруює атмосферу, а сірчаний ангідрид призводить до утворення сірчаної кислоти, яка роз'їдає метал елементів котлоагрегату.
Вміст леткої (органічної і колчеданної сірки) в горючій масі різних видів палива S![]() може бути в межах: у торфі, деревині, малосірчастій нафті – 0,2–0,4%; в антрациті, кам'яному вугіллі, бурому вугіллі – 2–6%; сірчастому сланці – до 15%.
може бути в межах: у торфі, деревині, малосірчастій нафті – 0,2–0,4%; в антрациті, кам'яному вугіллі, бурому вугіллі – 2–6%; сірчастому сланці – до 15%.
Зола палива складається з внутрішньої (первинної) і зовнішньої (прошарки породи, мінеральні речовини, внесені в процесі добування і транспортування палива). Для проектування котельного агрегату треба знати не лише, скільки золи міститься в паливі, а й її плавкість, склад і характер реакції.
Вміст золи в абсолютно сухій масі різних палив А![]() коливається в широких межах: від 0,3% для нафти до 70% для сланців. Зольність кам'яного вугілля Ас становить 5–20%, бурого вугілля-15–35%; торфу (малозольного) – 4–10% і 10–20% (високозольного).
коливається в широких межах: від 0,3% для нафти до 70% для сланців. Зольність кам'яного вугілля Ас становить 5–20%, бурого вугілля-15–35%; торфу (малозольного) – 4–10% і 10–20% (високозольного).
Плавкість золи характеризується температурами початку деформації t1, розм'якшення t2 і рідкоплавкого стану t3. Їх визначають у лабораторній печі. Значення цих температур залежить від складу золи і температури газового середовища, в якому відбувається нагрівання. З них найбільший інтерес для проектування топок становить температура початку розм'якшення t2. Залежно від температури рідкоплавкого стану t3 розрізняють: легкоплавку золу, якщо t3 <1200°С, середньоплавку, якщо t3 = 1200–1400°С, і тугоплавку, якщо t3>1400°С.
Склад мінеральних домішок різних палив дуже різноманітний. Переважними компонентами звичайно є глинозем і кремнезем. Крім того, до складу золи входять сульфати, карбонати (кальцію), луги, хлориди та інші сполуки.
Сумарний характер реакції шлаку (кислий, основний, нейтральний), що утворюється під час спалювання палива, треба враховувати при виборі матеріалу для футеровки топки. Реакція шлаку і футеровки повинна бути одного знаку, бо інакше при різко вираженому характері реакції шлаку інтенсивно руйнуватиметься футеровка.
Вміст вологи в паливі Wр коливається від 2% у нафті до 65% у здубиці. Вологість кам'яного вугілля становить 5–10%, бурого вугілля 30–58%, торфу 35–50%.
Волога палива зменшує в ньому вміст горючих речовин, знижує нижню теплоту згоряння палива як споживач теплоти для свого випаровування; переходячи у вигляді водяної пари в продукти згоряння, збільшує їх сумарну теплоємність. Усе це температуру горіння і нерідко погіршує економічність і стійкість процесу спалювання.
Вихід летких речовин. При нагріванні палива без доступу повітря (суха перегонка) відбувається термічний розклад палива з виділенням так званих летких речовин і твердого нелеткого залишку. Леткі речовини – це суміш газів і пари (пірогенетичної вологи, СО2, пари первинних смол, СО, Н2, СmНn, Н2S). Їх кількість і склад є важливими характеристиками палива.
До складу твердого залишку, що називається коксом, або нелетким залишком, входять вуглець С і зола А. Кокс може мати вигляд порошку, мало зв'язаних крупинок, міцної щільної або ніздрюватої маси.
Вихід летких речовин у вагових процентах на горючу масу коливається від 4% для антрациту до 85% для нафти і сланців. Проміжне положення по значенню Vг посідають: пісне кам'яне вугілля 10–15%, полум'яне кам'яне вугілля 20–45%, буре вугілля 50–60%, торф 70%.
Процес сухої перегонки при температурі 1050–1100° С називається коксуванням і широко застосовується для добування високоякісного металургійного коксу. Рідше застосовується напівкоксування палива (в основному бурого вугілля) – суха перегонка при 500–600° С. Основна мета такого процесу – здобуття цінних рідких і газових продуктів.
Похожие работы
... і знаходиться в людях і тваринах, в каменях і рослинах, у викопному паливі, деревах і повітрі, в річках і озерах, а ми, у свою чергу, розглянемо способи витягання цієї енергії і її перетворення. Розділ 2.Альтернативні джерела енергії. Вітрова енергія. Ми живемо на дні повітряного океану, в світі вітрів. Люди давно це зрозуміли, вони постійно відчували на собі дію вітру, хоча довгий час не ...
... якого разом з можливістю розвернути величезні виробничі потужності за наявності достатньої кількості сировини дали б змогу Україні посісти гідне місце на світовому ринку постачальників компонентів для сонячних електростанцій. Висновки Використання альтернативних джерел енергії є важливим як в національному, так і міжнародному масштабі – з точки зору реакції на глобальні кліматичні зміни та ...
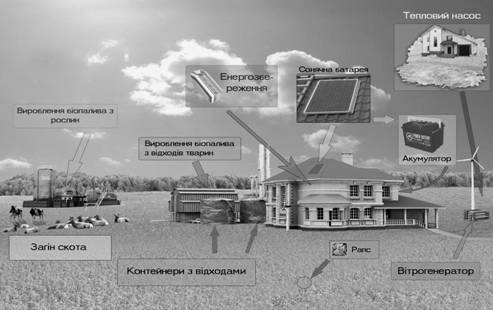
... Одним із шляхів доповнення і часткової заміни традиційних видів палива є використання біогазу. Важливим аргументом на користь даного джерела енергії є необхідність вирішення на сучасному рівні екологічних проблем, що виникають при утилізації відходів у сільському господарстві. Виробництво біогазу з різних видів сільськогосподарських відходів, головним чином гною, є традиційною технологією в ряді ...
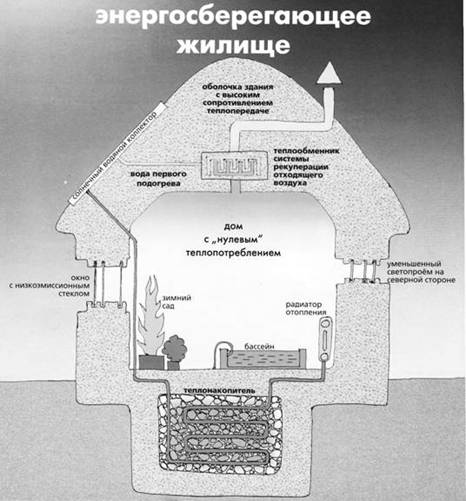
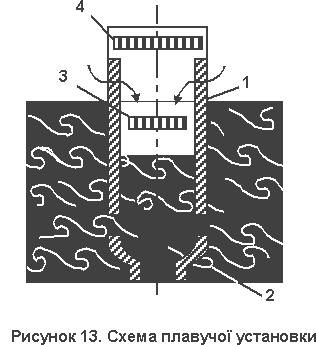
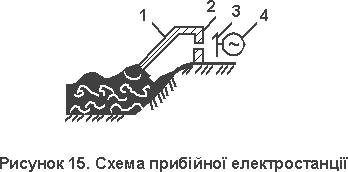
... ККД. На відміну від поширених систем централізованого кондиціонування, вона ґрунтується на циркуляції хладагента за численними розгалуженими каналах, також пронизливий підлоги на всіх поверхах. 2. Використання енергії морських хвиль та припливів Дещо більшим від ресурсів гідроенергії є світовий ресурс енергії морських хвиль та припливів. Найбільш поширеним способом використання енергії ...
0 комментариев