Фенолы
Фенолами называют соединения общей формулы Ar-OH, Они отличаются от спиртов тем, что в них гидроксильная группа непосредственно присоединена к ароматическому кольцу. В зависимости от количества гидроксильных групп фенолы различаются по атомности: одноатомные, двухатомные, трехатомные и т.д., для бензола до шестиатомных. Для метилфенолов принято специальное название - крезолы.




Фенол 4-Метилфенол (п-крезол) a-Нафтол b-Нафтол
Производные фенолов широко распространены в природе. Тимол является антисептиком и используется в парфюмерии. Эвгенол содержится в различных эфирных маслах, в том числе в гвоздичном масле.


2-Изопропил-5-метилфенол 4-Аллил-2-метоксифенол
(тимол) (эвгенол)
Ароматическое ядро, непосредственно связанное с гидроксильной группой оказывает сильное влияние на ее поведение. Это влияние так велико, что фенолы и спирты представляют собой разные классы органических соединений. Они отличаются, прежде всего, по кислотности. Значения рКа большинства спиртов составляет около 18, в то время как фенолов - менее 11. Сравним, например, циклогексанол и фенол:

Циклогексанол Фенол
рКа = 18 рКа = 9.9
Фенолы являются более сильными кислотами, чем вода, в то время как спирты более слабыми, чем вода. В отличие от спиртов фенолы со щелочью дают соли – феноксиды (феноляты), не разрушающиеся водой, но разлагающиеся более сильной угольной кислотой.
![]()
![]()
Приведенные реакции используются для разделения фенолов, спиртов и карбоновых кислот. Фенолы, содержащие электроноакцепторные группы в ядре, имеют большую кислотность, чем сам фенол. Большая кислотность фенолов по сравнению со спиртами может быть объяснена тем, что электронная плотность в них с атома кислорода смещена на бензольное кольцо.
Упр.10. Что происходит при пропускании диоксида углерода через водный раствор фенолята натрия? Напишите уравнение этой реакции.
Арилгалогениды
Соединения, в которых атомы галогенов присоединены к бензольному кольцу называют арилгалогенидами. Галогены в арилгалогенидах более устойчивы к нуклеофильному замещению, чем в алкилгалогенидах. Например, в 2-(3-хлорфенил)-1-хлорэтане при обычной температуре гидролизуется только тот атом хлора, который связан с насыщенным атомом углерода.
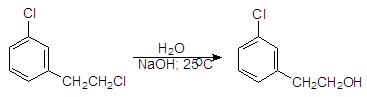
2-(3-Хлорфенил)-1-хлорэтан 2-(3-Хлорфенил)-1-этанол (1)
Арилгалогениды не реагируют по механизму SN1, т.к. арил-катионы крайне неустойчивы и не могут образовываться. Они не могут реагировать и по механиз-му SN2, т.к. бензольное кольцо препятствует тыловой атаке по механизму SN2:

Хлорбензол можно нагревать со щелочью в течение нескольких дней без заметного прохождения реакций замещения:

Хлорбензол
Арилгалогениды, в отличие от алкилгалогенидов, не дают положительной реакции при действии на них нитрата серебра в спирте.
Свободные пары электронов на галогенах в них взаимодействуют с p-системой связей бензольного кольца. Мезомерный эффект (+М-эффект) галогенов не велик, т.к. активность их р-электронов мала. Индуктивный же эффект (-I-эффект, т.е. оттяжка электронной пары связи к галогену) всегда велик, и он наводит положительный заряд на связанный с ним атом углерода и далее на о- и п-атомы углерода бензольного кольца.
Повышенная прочность галогенуглеродной связи в арилгалогенидах обусловлена двумя факторами:
(1) aтом углерода в них sp2 гибридизован, и поэтому электроны на его орбиталях ближе к ядру, чем у sp3 гибридизованного углерода;
(2) электронная пара на атомах галогена сопряжена с бензольным кольцом, и поэтому она частично двойная:

1.1. Нуклеофильное замещение по механизму отщепление-
присоединение (ариновый механизм)
Несмотря на малую реакционную способность арилгалогенидов они довольно широко используются в промышленности для получения различных ароматических соединений. Наиболее легко нуклеофильному замещению подвергается йод. В жестких условиях арилгалогениды (за исключением фторидов) вступают в реакции замещения.
 (2)
(2)
Феноксид натрия
При замещении хлора в пара-хлортолуоле на гидроксильную группу в аналогичных условиях образуется смесь пара- и мета-крезолов.
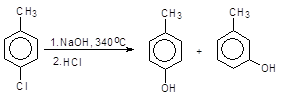 (3)
(3)
п-Хлортолуол п-Крезол м-Крезол
При действии амида калия на о-хлоранизол в жидком аммиаке образуется м-аминоанизол .
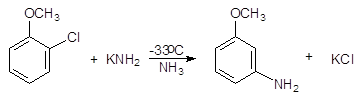 (4)
(4)
о-Хлоранизол м-Аминоанизол
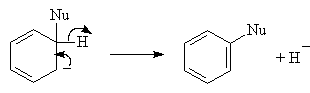
Такой результат можно объяснить с помощью механизма отщепления- присоеди-нения SNAr. На первой стадии нуклеофил действует как основание, отщепляя протон в орто-положении к атому галогена ароматического субстрата. Отщепляется именно орто-протон, самый «кислый» (кислотность убывает в ряду орто-Н > мета-Н > параН >). На второй стадии быстро отщепляется галоген и образуется дегидробензол.
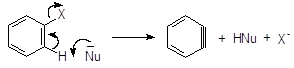
Дегидробензол или бензин
Далее следует стадия присоединения HNu к молекуле дегидробензола:

Дегидробензол очень легко вступает в реакции присоединения с любыми нуклеофилами, например, с растворителем. Атака будет происходить по обоим троесвязанным атомам углерода, что и приводит к образованию смеси продуктов как в случае п-хлортолуола. В о-хлоранизоле атака происходит по одному атому из-за стерических препятствий.
Следует иметь в виду, что орбитали, образующие третью связь в молекуле дегидробензола, не перекрываются с р-орбиталями бензольного кольца и, следовательно, не участвуют в сопряжении. Они находятся в той же плоскости, что и кольцо. Между собой они перекрываются слабо, поэтому третья связь и очень реакционноспособна.

Упр.1. Напишите реакцию п-хлортолуола с амидом натрия и опишите ее механизм.
Упр.2. Напишите реакции хлорбензола при повышенной температуре в присутствии меди с (а) цианидом натрия и (б) с ацетатом натрия.
Ответ.
(а) 
Бензонитрил
При использовании медного катализатора эти реакции проходят легче (Ульман).
Упр.3. При замещении хлора в орто-хлортолуоле на гидроксильную группу при нагревании с 15%-м водным раствором щелочи под давлением образуется смесь двух крезолов. Напишите эту реакцию и опишите е механизм.
1.2. Нуклеофильное замещение по механизму присоединение-
отщепление
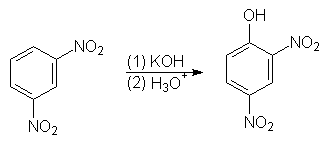
Этот механизм, обозначаемый SNAr, характерен для арилгалогенидов, содержащих активирующие элетроноакцепторные заместители в орто- и пара-положениях кольца.
 (5)
(5)
о-нитрохлорбензол о-нитрофенол
 (6)
(6)
2,4-динитро-N,N-диметиланилин
При наличии электроноакцепторных групп в мета-положении аналогичного активирующего эффекта не наблюдается. Например, м-нитрохлорбензол в аналогичную реакцию не вступает.
Описанные реакции проходят по механизму присоединения-отщепления. Реакция осуществляется в две стадии, из которых лимитирующей обычно является первая. В качестве промежуточного соединения образуется s-комплекс (комплекс Мейзенгеймера), распадающийся далее на продукты реакции. В некоторых случаях комплексы Мейзенгеймера могут быть выделены.
 (М 1)
(М 1)
s-Комплекс
Незамещенный хлорбензол в этих условиях совершенно инертен. Интересно отметить, что фтор в динитрофторбензоле замещается еще легче, чем хлор. Поэтому 2,4-динитрофторбезол широко используется для введения 2,4-динитро-фенильного остатка, например, в концевые аминогруппы белков.

2,4-Динитрофторбензол
Напомним, что в предельных соединениях хлор подвижнее фтора. Это объясняется тем, что хотя фтор и подает связанному с ним атому углерода свободные электроны, но в гораздо меньшей степени, чем хлор.
Упр.4. Опишите механизм реакции:

Ответ:

Упр.5. Напишите реакции и опишите механизм: (а) 2,4,6-тринитрохлорбен-зола с водным раствором бикарбоната натрия с последующим подкислением;
(б) р-нитробензола с метоксидом натрия в метаноле при 100оС: (в) о-нитробензо-ла с этиламином в этаноле при 160оС.
Упр.6. Напишите реакции 2,4-динитрохлорбензола: (а) с анилином в этаноле при 95оС, (б) с гидразином в этаноле при нагревании, (в) с аммиаком в воде при 170оС под давлением.
Похожие работы
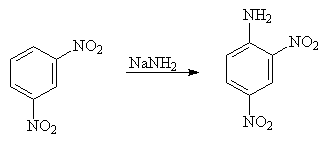
... группы в ядре, имеют большую кислотность, чем сам фенол. Большая кислотность фенолов по сравнению со спиртами может быть объяснена тем, что электронная плотность в них с атома кислорода смещена на бензольное кольцо. 1. Реакции нуклеофильного замещения ароматических соединений Нитрогруппа обладает сильно выраженным электроноакцепторным характером и оказывает значительное влияние на атомы ...
... недостатками метода гомогенного кислотного катализа. В последнее время разработан метод получения некоторых эфиров уксусной кислоты этерификацией уксусной кислоты соответствующими спиртами в присутствии ионообменной смолы КУ-2. Использование ионитов как катализаторов реакции этерификации позволяет применить эквивалентные количества реагирующих веществ, что значительно облегчает очистку готового ...
... (2,2,5,5-тетраметил-3-имидазолин-3-оксид-4-ил)фенилметанолу и 2,2,5,5-тетраметил-4-триэтилгермил-3-имидазолин-3-оксиду. Подобраны условия, позволяющие провести литиирование 5,5-диметилпирролин-1-оксида и последующую реакцию с электрофильными реагентами селективно по альдонитронной группе на фоне активной метиленовой группы. Реакция литиированного производного альдонитрона 1,2,2,5,5-пентаметил ...
... образом, чтобы не возникал избыток нитрозирующего агента. диазотирования – первая стадия синтеза азокрасителей, а также р-ций Зандмейера, Гомберга, Шимана, Гаттермана, Несмеянова, Барта, Меервейна. Диазотирование открыто П. Гриссом в 1858. Нитрование Введение нитрогруппы – NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам; ...




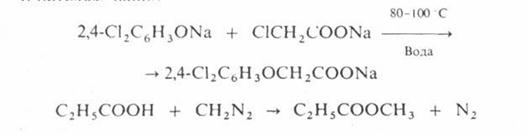
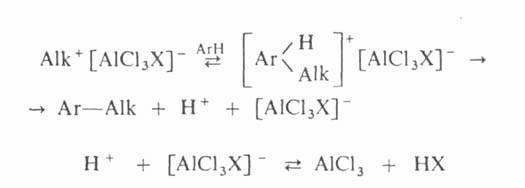
0 комментариев