Г.Н. Чупахина, М.В. Куркина
Исследуется влияние условий освещения на образование триоз в листьях ячменя. Показано стимулирующее действие света и экзогенного субстрата – 1%-ного раствора глюкозы – на накопление триоз в зеленых листьях ячменя , а также светозависимое накопление триоз в альбиносных листьях, снабженных экзогенным субстратом. Благодаря использованию разобщителя дыхания и окислительного фосфорилирования – 2,4-динитрофенола, ингибитора гликолиза – фторида натрия, а также растений с депигментированными листьями установлено наличие связи между светозависимым образованием триоз и дыханием.
Проблема взаимосвязи фотосинтеза и дыхания является одной из основных в физиологии растений, поэтому изучение обмена углеводов для решения вопроса о соотношении двух энергетических процессов имеет важное значение. Одно из центральных мест в обменных реакциях углеводов занимают фосфотриозы – диоксиацетонфосфат (ДОАФ) и фосфоглицериновый альдегид (ФГА). Однако вопрос формирования пула фосфотриоз в растениях практически не изучен. Имеется лишь несколько работ по данной теме. В частности, о влиянии температуры на размеры пулов фосфотриоз кукурузы и ячменя [1] и об увеличении содержания промежуточных продуктов цикла Кальвина, в том числе и ДОАФ в листьях ячменя, зараженных мучнистой росой [2]. В других работах представлены сведения об изменении концентрационного уровня ДОАФ в листьях кукурузы в течение суток [3] и уровня фосфотриоз при прорастании семян, т. е. в период активного глюконеогенеза [4].
Целью данного исследования явилось изучение влияния света на накопление фосфотриоз в листьях ячменя. Поскольку ДОАФ и ФГА в растениях образуются в процессе дыхания, фотосинтеза и глюконеогенеза, то для разграничения данных пулов фосфотриоз нами исследовалось влияние света на уровень этих соединений в зеленых и альбиносных проростках ячменя, а также в условиях ингибирования гликолиза и дыхательного процесса в целом.
МетодикаВ качестве объекта исследования использовали 8 – 13-дневные проростки ячменя (Hordeum vulgare L.) сорта Роланд, выращенные в установке ТКШ-1 «Флора» при постоянном освещении светом люминесцентных ламп белого света ЛБУ-30 интенсивностью 5 Дж/м2×с. Альбиносные проростки получали из семян, обработанных 0,25%-ным раствором стрептомицина. Перед опытом растения выдерживали в темноте в течение 24 часов. В качестве разобщителя дыхания и окислительного фосфорилирования использовали 0,001 М раствор 2,4-динитрофенола, гликолиз затормаживали 0,015 М раствором фторида натрия – ингибитором энолазной реакции. Срезанные листья помещали основаниями в воду и в растворы субстрата или ингибитора и освещали в течение 24 часов светом различной интенсивности. Опыты включали и темновой вариант. Содержание триоз определяли фотоколориметрическим методом [5] и рассчитывали в мкг/г сырого веса, используя калибровочную кривую для диоксиацетона. Опыты проводили в двух биологических повторностях и воспроизводили два – четыре раза. Полученные данные обработаны статистически методом парных сравнений. На рисунках представлены средние арифметические значения.
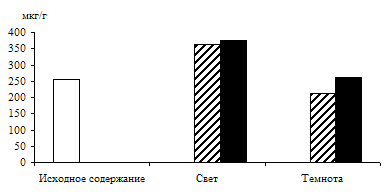
Результаты и обсуждениеДля выяснения условий, определяющих образование фосфотриоз в растениях, изучалось влияние освещения и экзогенного субстрата – 1%-ного раствора глюкозы – на биосинтез ДОАФ и ФГА в зеленых листьях ячменя (рис.1).
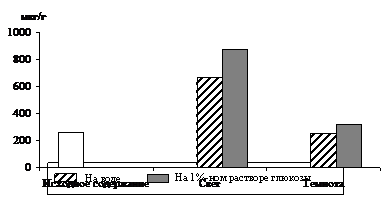 |
Рис. 1. Влияние света (12 Дж/м2×с) на содержание триоз в 10 – 11-дневных зеленых листьях ячменя в присутствии 1%-ного раствора глюкозы. Экспозиция 24 часа
Исследования показали, что содержание моносахаридов триоз в освещенных листьях было в 2,5 раза выше, чем в неосвещенных. Можно предположить, что увеличение уровня фосфотриоз произошло за счет новообразования их в цикле Кальвина в условиях интенсивного фотосинтеза. Присутствие экзогенного субстрата – 1%-ного раствора глюкозы – стимулировало накопление ДОАФ и ФГА на свету, в результате чего уровень фосфотриоз превысил таковой у неосвещенных листьев в 2,8 раза. Накопление ДОАФ и ФГА в неосвещенных листьях на растворе глюкозы также имело место, но уровень их был всегда ниже, чем на свету, так как из-за отсутствия фотосинтеза в темноте накопление фосфотриоз шло только за счет дыхательного процесса.
Таким образом, представленные данные показывают положительное действие экзогенного субстрата – 1%-ного раствора глюкозы – на биосинтез фосфотриоз и стимулирующее действие света на данный процесс. Увеличение уровня фосфотриоз в темноте может быть связано с гликолизом и окислительным пентозофосфатным циклом, которые, вероятно, активируются при наличии глюкозы. Что касается работы этих окислительных процессов на свету, то в научной литературе имеются данные о функционировании гликолиза и окислительного пентозофосфатного цикла в разных зонах растущего листа ячменя [6]. Авторы указанной работы говорят о том, что в клетках меристематической зоны не происходит ингибирования гликолиза и окислительного пентозофосфатного цикла на свету. В зоне растяжения и зрелых клеток листа эти процессы ингибированы на 40 – 50 %. В наших исследованиях отмечено светозависимое увеличение уровня фосфотриоз в присутствии глюкозы – общего субстрата для этих окислительных процессов, поэтому можно предположить, что на свету пул фосфотриоз формируется и за счет дыхания.
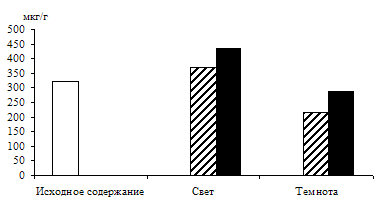
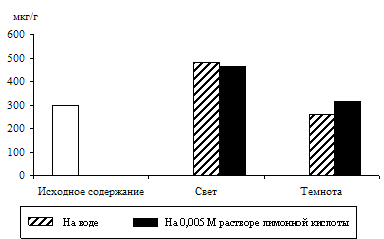
Связь светозависимого накопления фосфотриоз с процессом дыхания проверяли на опытах: дыхательный процесс ингибировали 0,001 М раствором 2,4-динитрофенола – разобщителем дыхания и окислительного фосфорилирования (рис. 2).
Ингибирование в равной степени снизило уровень фосфотриоз в освещенных и неосвещенных листьях по сравнению с контролем. Следовательно, и на свету пул фосфотриоз в зеленых листьях ячменя пополняется ДОАФ и ФГА дыхательного метаболизма.
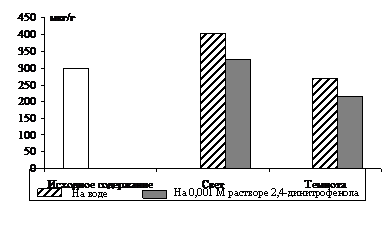 |
Рис. 2. Влияние света (12 Дж/м2×с) на содержание триоз в 10-дневных зеленых листьях ячменя в присутствии 0,001 М раствора 2,4-динитрофенола. Экспозиция 24 часа
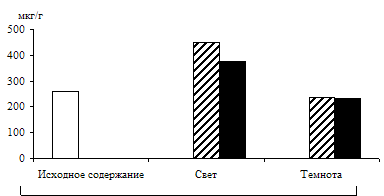
С целью разделения пулов триоз фотосинтетического и дыхательного происхождения в опытах наряду с зелеными проростками использовали и альбиносные (рис. 3). Исследования показали, что альбиносные листья содержали несколько меньше фосфотриоз и их уровень не зависел от освещения, но в присутствии экзогенного субстрата светозависимое накопление наблюдалось и у альбиносов, что подтверждает полученные другими авторами данные [7] о стимулировании светом гликолиза и окислительного пентозофосфатного пути у альбиносов. Таким образом, исследования, проведенные на зеленых и альбиносных растениях, показали, что формирование пула фосфотриоз на свету происходит за счет ДОАФ и ФГА не только фотосинтетического, но и дыхательного происхождения.
Известно, что окисление глюкозы идет по гликолитическому и пентозофосфатному пути, причем эндогенный сахар окисляется преимущественно гликолитическими ферментами с вовлечением образовавшихся продуктов в цикл трикарбоновых кислот, а превращение экзогенной глюкозы в основном связано с работой окислительного пентозофосфатного цикла [8]. Поэтому можно предположить, что увеличение уровня фосфотриоз в листьях на экзогенном субстрате шло за счет их образования в реакциях пентозофосфатного пути.
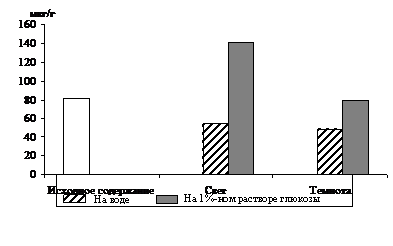 |
Рис. 3. Влияние света (12 Дж/м2×с) на содержание триоз
в 12 – 13-дневных альбиносных листьях ячменя
в присутствии 1%-ного раствора глюкозы. Экспозиция 24 часа
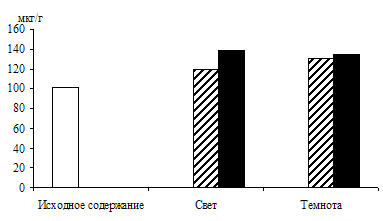
Вклад гликолиза в образование фосфотриоз исследовали в опытах с использованием ингибитора энолазной реакции гликолиза – 0,015 М раствора фторида натрия. Опыты, проведенные с зелеными проростками ячменя (рис. 4), показали, что увеличение уровня ДОАФ и ФГА в освещенных листьях, находящихся на воде (контроль), составило 84 %, а в присутствии ингибитора – 68 % от исходного содержания. Экзогенная 1%-ная глюкоза стимулировала накопление фосфотриоз на 156 %, а при добавлении фторида натрия – на 122 %. Следовательно, в зеленых листьях ячменя накопление фосфотриоз происходит и за счет их образования при окислении глюкозы по гликолитическому пути в условиях освещения.
Что касается альбиносных растений, то данные опыта (рис. 5) показывают, что уровень триоз в освещенных и неосвещенных листьях на воде не изменился по сравнению с исходным содержанием. При стимуляции накопления фосфотриоз 1%-ным раствором глюкозы происходило увеличение уровня ДОАФ и ФГА на свету на 207 %, а в темноте на 88 %. В варианте, где в субстрат был добавлен
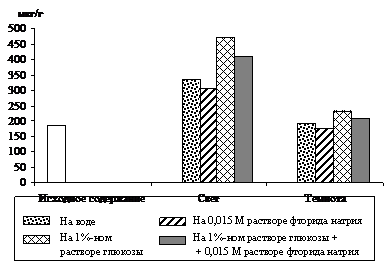 |
Рис. 4. Влияние света (12 Дж/м2×с) на содержание триоз
при ингибировании гликолиза 0,015 М раствором фторида натрия
в 9 – 10-дневных зеленых листьях ячменя, находящихся на воде
и 1%-ном растворе глюкозы. Экспозиция 24 часа
ингибитор гликолиза – фторид натрия, это увеличение составило только 64 % и 24 % соответственно. Следовательно, и в альбиносных листьях ячменя пул фосфотриоз на свету пополняется за счет ДОАФ и ФГА гликолитического происхождения. Следует отметить, что уровень фосфотриоз в освещенных листьях на субстрате и в варианте опыта, где к субстрату был добавлен ингибитор, был всегда выше, чем в неосвещенных. Таким образом, свет оказывал положительное действие на биосинтез фосфотриоз в альбиносных листьях ячменя в присутствии экзогенного субстрата.
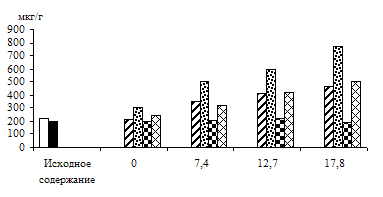
Светозависимое накопление фосфотриоз зависело от интенсивности света (рис. 6). Содержание ДОАФ и ФГА в зеленых листьях на воде и на 1%-ном растворе глюкозы повышалось с увеличением интенсивности света, причем уровень их в листьях на субстрате, как всегда, был выше, чем в его отсутствии. Что касается альбиносных проростков, то уровень фосфотриоз в листьях, находящихся на воде, не
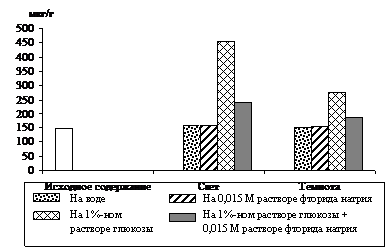 |
Рис. 5. Влияние света (12 Дж/м2×с) на содержание триоз
при ингибировании гликолиза 0,015 М раствором фторида натрия
в 8 – 10-дневных альбиносных листьях ячменя, находящихся на воде
и 1%-ном растворе глюкозы. Экспозиция 24 часа
зависел от интенсивности света, но в присутствии экзогенного субстрата у альбиносов, так же как и в зеленых листьях, наблюдалось с увеличением интенсивности света повышение содержания этих соединений. Следовательно, показана положительная зависимость накопления ДОАФ и ФГА от интенсивности света, что может быть связано с увеличением пула фотосинтетических и дыхательных триоз у зеленых листьев и с повышением уровня триоз дыхательного метаболизма у альбиносных листьев, снабженных субстратом.
Таким образом, исследования условий формирования пула фосфотриоз показали, что в зеленых листьях ячменя накопление ДОАФ и ФГА дыхательного метаболизма может стимулироваться светом и экзогенным субстратом – 1%-ным раствором глюкозы. В отсутствии фотосинтеза у альбиносных проростков светозависимое накопление фосфотриоз имеет место только в присутствии экзогенного субстрата.
| Дж/м2×с |
Рис. 6. Влияние света различной интенсивности на содержание триоз
в 8 – 13-дневных зеленых и альбиносных листьях ячменя, находящихся
на воде и 1%-ном растворе глюкозы. Экспозиция 24 часа
Список литературы
1. Labate C.A., Adcock M.D., Leegood R.C. Effects of temperature on the regulation of photosynthetic carbon assimilation in leaves of maize and barley // Planta. 1990. Vol. 181. № 4. P. 547 – 554.
2. Scholes J.D., Lee P., Horton P., Lewis D.H. The effect of powdery mildew of barley on the concentration of calvin cycle metabolites and on the partioning of carbohydrate // Meet. photosynth. London, 4 – 6 Apr., 1990 / Agr. and food res. counc. London, 1990. P. 20 – 21.
3. Hideaki U., Kalt-Torres W., Kerr P.S., Huber S.C. Diurnal changes in maize leaf photosynthesis. Levels of metabolic intermediates of sucrose synthesis and the regulatory metabolite fructose 2,6-biphosphate // Plant physiol. 1987. Vol. 83. № 2. P. 289 – 293.
4. Kobr M., Beevers H.. Gluconeogenesis in the castor bean endosperm. Changes in glucolytic intermediates // Plant physiol. 1971. Vol. 47. № 1. P. 48 – 52.
5. Чупахина Г.Н., Куркина М.В. Фотоколориметрический метод определения триоз в растительном материале // Физиологические и биохимические методы анализа растений: Практикум / Калинингр. ун-т; Авт.-сост. Г.Н. Чупахина. Калининград, 2000. С. 32 – 34.
6. Филиппова Л.А., Мамушина Н.С., Зубкова Е.К., Мирославов Е.А., Кудинова Л.И. Взаимоотношение фотосинтеза и дыхания у ассимилирующих клеток в разных зонах растущего листа ячменя // Физиология растений. 1986. Т. 33. Вып. 1. С. 66 – 74.
7. Зубкова Е.К., Филиппова Л.А., Мамушина Н.С., Чупахина Г.Н. Действие света на темновое дыхание альбиносных и зеленых участков листа ячменя // Физиология растений. 1988. Т. 35. Вып. 2. С. 254 – 259.
8. Шугаева Н.А., Выскребенцева Э.И. Принципиальные различия окислительного метаболизма экзогенного и эндогенного сахара // Физиология растений. 1985. Т. 32. Вып. 6. С. 1188 – 1190.
Для подготовки данной работы были использованы материалы с сайта http://elib.albertina.ru
Похожие работы
... 0,25%-ным раствором стрептомицина. Перед опытом растения выдерживали в темноте в течение 24 часов. Для выяснения роли органических кислот цикла Кребса в образовании триоз в качестве субстратов использовали 0,005 М растворы яблочной, янтарной, лимонной и фумаровой кислот. Срезанные листья помещали на воду и на растворы органических кислот и освещали светом люминесцентных ламп белого света ЛБУ-30 ...
... использовалась глюкоза, эти цифры были соответственно: 1,2; 1,2 и 1 (рис. 6). Из сравнения действия диоксиацетона, глюкозы и галактозы на биосинтез АК в проростках ячменя, отчетливо видно преимущественное использование трехуглеродного углевода по сравнению с шестиуглеродными, что дает основание поддерживать мнение о том, что биосинтез АК из углеводов предполагает на определенном этапе разрыв ...
... , часть накопленных в процессе фотосинтеза углеводов теряется. Однако все попытки искусственно ингибировать фотодыхание приводили к общему снижению интенсивности фотосинтеза. На современном этапе развития физиологии растений принято считать, что основное значение фотодыхания заключается в его защитной роли. Сбрасывая таким образом избыточную энергию, растение избегает разрушения фотосистем, ...
... у некоторых сельскохозяйственных культур приведен ниже. Культура Транспирационный коэффициент Просо 203 Кукуруза 368 Сахарная свекла 397 Пшеница яровая 513 Ячмень 534 Гречиха 578 Овес 597 Картофель ...

0 комментариев