Навигация
Основы термодинамики неравновестных процессов и открытых систем
Термодинамика — раздел физики, изучающей общие закономерности обмена тепловой энергией между системами, системой и внешней средой и производства работы за счет этой энергии. Важнейшие выводы термодинамики широко используются в других науках, в частности химии.
Понятия энергии и работы были введены в курсе механики, в частности, когда рассматривалась задача о работе, совершаемой при сжатии пружины. Эта работа приводит к возрастанию потенциальной энергии системы. Наоборот, если система совершает работу, то при этом ее потенциальная энергия уменьшается, причем расход потенциальной энергии равен производимой работе.
Изучая механику, мы говорили о двух формах энергии: кинетической и потенциальной. При переходе к изучению состояния газов мы ввели понятие температуры, рассматривая ее как меру энергии хаотического движения молекул. Энергию хаотического движения молекул мы называли внутренней энергией газа.
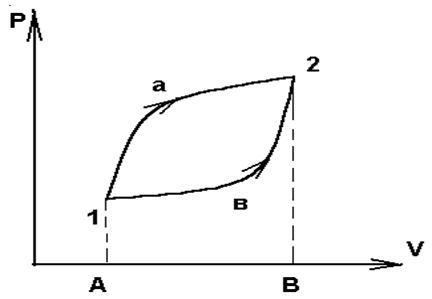
Самая общая термодинамическая модель должна включать три части: внешний источник тепловой энергии, рабочее тело и внешний приемник тепловой энергии, в который можно отводить энергию, накопленную в рабочем теле. Мы не будем конкретизировать ни тип источника или приемника энергии, ни характер связи между ними и рабочим телом. Модель рабочего тела конкретизируем и примем в качестве него цилиндр с подвижным поршнем, внутри которого, находится идеальный газ. Именно анализируя состояние идеального газа, легко ввести целый ряд весьма общих понятий.
Если с помощью внешнего источника тепловой энергии нагреть цилиндр, удерживая поршень неподвижным, то никакая макроскопическая работа совершаться не будет, но частицы газа будут двигаться быстрее, т. е. возрастет запас внутренней энергии рабочего тела. Энергия, переданная системе при ее нагревании, израсходовалась на повышение внутренней энергии газа. Одновременно с увеличением внутренней энергии, т. е. с повышением температуры газа, возрастет и его давление. Если не сдерживать поршень, то в результате он будет подниматься. Таким образом в этом случае все подведенное количество теплоты расходуете двояко: во-первых, нагревается система, увеличивается ее внутренняя энергия и, во-вторых, перемещается поршень, совершаете механическая работа.
Вообще, отвлекаясь от конкретной характеристики внутренне энергии системы, можно в общем случае сформулировать правило: количество теплоты ∆Q, подведенное к системе, расходуется на повышение внутренней энергии ∆Е системы и на работу ∆А, которая производится этой системой. Символически это правил записывается следующим образом:
∆Q=∆E+∆A
и называется первым началом или первым законом термодинамики.
1. Термодинамические системы вдали от равновесия.
Всякий материальный объект, всякое тело, состоящее из большого числа
частиц, называется макроскопической системой. Размеры макроскопических
систем значительно больше размеров атомов и молекул. Все макроскопические признаки, характеризующие такую систему и ее отношение к окружающим телам, называются макроскопическими параметрами. К их числу относятся такие, например, как плотность, объем, упругость, концентрация, поляризованность, намогниченность и т.д. Макроскопические параметры разделяются на внешние и внутренние.
Величины, определяемые положением не входящих в нашу систему внешних
тел, называются внешними параметрами , например напряженность силового
поля ( так как зависят от положения источников поля - зарядов и токов, не
входящих в нашу систему ), объем системы ( так как определяется
расположением внешних тел ) и т.д. Следовательно внешние параметры
являются функциями координат внешних тел. Величины, определяемые совокупным движением и распределением в пространстве входящих в систему частиц, называются внутренними параметрами, например энергия, давление, плотность, намогниченность, поляризованность и т.д. (так как их значения зависят от движения и положения частиц системы и входящих в них зарядов).
Совокупность независимых макроскопических параметров определяет
состояние системы, т.е. форму ее бытия. Величины не зависящие от
предыстории системы и полностью определяемые ее состоянием в данный момент (т.е. совокупностью независимых параметров), называются функциями состояния.
Состояние называется стационарным, если параметры системы с течением
времени не изменяются.
Если, кроме того, в системе не только все параметры постоянны во
времени, но и нет никаких стационарных потоков за счет действия каких-либо внешних источников, то такое состояние системы называется равновесным (состояние термодинамического равновесия ). Термодинамическими системами обычно называют не всякие, а только те макроскопические системы, которые находятся в термодинамическом равновесии. Аналогично, термодинамическими параметрами называются те параметры , которые характеризуют систему в термодинамическом равновесии.
Внутренние параметры системы разделяются на интенсивные и экстенсивные.
Параметры не зависящие от массы и числа частиц в системе , называются
интенсивными ( давление , температура и др.). Параметры пропорциональные массе или числу частиц в системе , называются аддитивными или экстенсивными (энергия , энтропия и др.) . Экстенсивные параметры характеризуют систему как целое, в то время как интенсивные могут принимать определенные значения в каждой точке системы .
По способу передачи энергии , вещества и информации между
рассматриваемой системы и окружающей средой термодинамические системы классифицируются :
1. Замкнутая (изолированная) система - это система в которой нет
обмена с внешними телами ни энергией, ни веществом (в том числе и
излучением), ни информацией .
2. Закрытая система - система в которой есть обмен только с энергией .
3. Адиабатно изолированная система - это система в которой есть обмен
энергией только в форме теплоты .
4. Открытая система - это система, которая обменивается и энергией, и
веществом, и информацией.
2.Открытые диссипативные системы
ДИССИПАТИВНЫЕ СИСТЕМЫ, механические системы, полная энергия которых (сумма кинетической и потенциальной энергий) при движении убывает, переходя в другие виды энергии, напр. в теплоту, т. е. происходит диссипация энергии. Примеры диссипативных систем: тело, движущееся по поверхности другого тела при наличии трения, движение тела в вязкой среде.
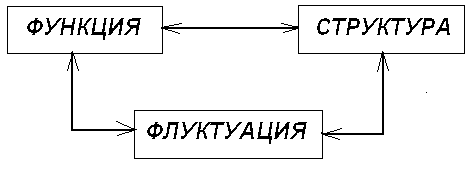
Каждая система состоит из элементов (подсистем). Эти элементы находятся в определенном порядке и связаны определенными отношениями. Структуру системы можно назвать организацию элементов и характер связи между ними. В реальных физических системах имеются пространственные и временные структуры.
Формирование структуры - это возникновение новых свойств и отношений в множестве элементов системы. В процессах формирования структур играют важную роль понятия и принципы:
1. Постоянный отрицательный поток энтропии .
2. Состояние системы в дали от равновесия .
3. Нелинейность уравнений описывающих процессы .
4. Коллективное (кооперативное) поведение подсистем .
5. Универсальный критерий эволюции Пригожина - Гленсдорфа.
Формирование структур при необратимых процессах должно сопровождаться качественным скачком (фазовым переходом) при достижении в системе критических значений параметров. В открытых системах внешний вклад в энтропию ∆S в принципе можно выбрать произвольно, изменяя соответствующим образом параметры системы и свойства окружающей среды. В частности энтропия может уменьшаться за счет отдачи энтропии во внешнюю среду, т.е. когда ∆S < 0 . Это может происходить, если изъятие из системы в единицу времени превышает производство энтропии внутри системы, чтобы начать формирование структуры, отдача энтропии должна превысить некоторое критическое значение. В сильно неравновесном расстоянии переменные системы удовлетворяют нелинейным уравнениям. Таким образом, можно выделить два основных класса необратимых процессов:
Похожие работы
... dQ/T = 0 (1.4) Для неравновесного кругового процесса неравенство Клаузиуса имеет следующий вид : dQ/T < 0 (1.5) Теперь можно записать основное уравнение термодинамики для простейшей системы находящейся под всесторонним давлением : TdS = dU + pdV (1.6) Обсудим вопрос о физическом смысле энтропии. 1.4.2. ЭНТРОПИЯ. ...
... , энтропия — не просто безостановочное соскальзывание системы к состоянию, лишенному какой бы то ни было организации. При определенных условиях энтропия становится прародительницей порядка. ПОРЯДОК И ХАОС От порядка к хаосу В физической картине мира до 70-х годов XX века царствовали два закона классической термодинамики. Первый закон термодинамики (закон сохранения и превращения энергии) ...
т вследствие уменьшения момента инерции при сохранении момента вращения. Тут мы и убеждаемся наглядно, что чем меньше момент инерции, тем выше угловая скорость и, как следствие, короче период вращения, обратно пропорциональный ей. 3. Что такое радиоактивность (естественная и искусственная)? Как использование явлений радиоактивности позволило осуществить мечту алхимиков? Радиоактивность (от ...
... это то, что устраняет неопределенность, количество "снятой" неопределенности. Тенденция к определенности, к повышению информативности - процесс негэнтропийный (процесс с обратным знаком). Термин "самоорганизующаяся система" ввел кибернетик У. Росс Эшби для описания кибернетических систем. Для самоорганизующихся систем характерны: 1) Способность активно взаимодействовать со средой, изменять ...


0 комментариев