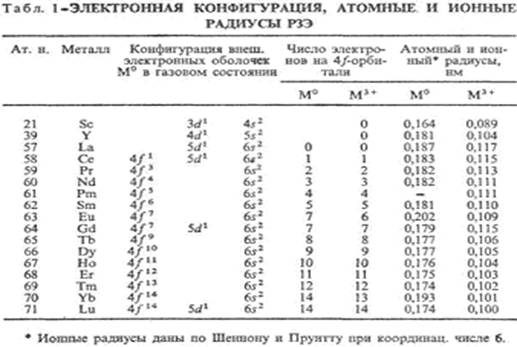
Гадолиний (от имени Ю. Гадолина; лат. Gadolinium) Gd, хим. элемент III гр. периодич. системы, ат. н. 64, ат. м. 157,25; относится к редкоземельным элементам (входит в иттриевую подгруппу лантаноидов). Состоит из семи стабильных изотопов с мас. ч. 152, 154-158, 160. Поперечное сечение захвата тепловых нейтронов 4,6*1025 м2. Конфигурация внеш. электронных оболочек 4f75s25p65d16s2; степень окисления + 3. редко + 2 и + 1; энергия ионизации Gd° -> Gd+ -> Gd2+ -> Gd3+ соотв. 8,9939, 16,9085, 20,63, 44,0 эВ; атомный радиус 0,179 нм; ионный радиус (в скобках указано координац. число) Gd2+ 0,092 нм (4), 0,109 нм (6), Gd3+ 0,115 нм (6), 0,128 нм (8).
Содержание в земной коре 5,4*10-4% по массе, в морской воде 6*10-7 мг/л. Вместе с др. РЗЭ находится в минералах гадолините, монаците, бастнезите, ксенотиме, апатите.
Г.-металл светло-серого цвета. До 1260°С устойчив![]() Gd, решетка гексагон. плотноупакованная типа Mg (a = = 0,36360 нм, с = 0,57826 нм, z = 2, пространств. группа Р63/mmc, плотн. 7,895 г/см3). Выше 1260°С устойчив
Gd, решетка гексагон. плотноупакованная типа Mg (a = = 0,36360 нм, с = 0,57826 нм, z = 2, пространств. группа Р63/mmc, плотн. 7,895 г/см3). Выше 1260°С устойчив![]() Gd, решетка кубическая типа
Gd, решетка кубическая типа![]() Fe (а = 0,406 нм, z = 2, пространств. группа Im3m, плотн. 7,80 г/см3),
Fe (а = 0,406 нм, z = 2, пространств. группа Im3m, плотн. 7,80 г/см3),![]() перехода
перехода![]() 3,9 кДж/моль. Т. пл. 1312°С, т. кип. 3280 °С; С° 37,1 Дж/(моль*К),
3,9 кДж/моль. Т. пл. 1312°С, т. кип. 3280 °С; С° 37,1 Дж/(моль*К),![]() 10 кДж/моль,
10 кДж/моль,![]() 360 кДж/моль; S°298 67,9 Дж/(моль*К); давление пара при 1280°С 0,0186 Па; теплопроводность 11,0 Вт/(м*К);
360 кДж/моль; S°298 67,9 Дж/(моль*К); давление пара при 1280°С 0,0186 Па; теплопроводность 11,0 Вт/(м*К);![]() 1,43*10-6 Ом*м (273 К); температурный коэф. линейного расширения 8,28-10-6 К-1; предел текучести 182 МПа (20°С). Ферромагнетик (точка Кюри 292 К). Легко поддается мех. обработке.
1,43*10-6 Ом*м (273 К); температурный коэф. линейного расширения 8,28-10-6 К-1; предел текучести 182 МПа (20°С). Ферромагнетик (точка Кюри 292 К). Легко поддается мех. обработке.
Г. медленно окисляется на воздухе при ~ 20 °С, выше 100°С - быстро; взаимод. с минер. к-тами (кроме фтористоводородной), не взаимод. с р-рами щелочей. Реагирует с Н2, N2, галогенами при нагревании.
Оксид (сесквиоксид) Gd2O3 - белые кристаллы; существует в двух модификациях: с моноклинной решеткой (а = = 1,408 нм, Ь = 0,3571 нм, с = 0,8764 нм,![]() = 100,03°, z = 6, пространств. группа С2/т)и с кубической (а = 1,0812 нм, пространств. группа Iа3, плотн. 7,618 г/см3); т-ра полиморфного перехода ок. 2300 °С; т. пл. 2350 °С; Сp° 105,52 Дж/(моль-К);
= 100,03°, z = 6, пространств. группа С2/т)и с кубической (а = 1,0812 нм, пространств. группа Iа3, плотн. 7,618 г/см3); т-ра полиморфного перехода ок. 2300 °С; т. пл. 2350 °С; Сp° 105,52 Дж/(моль-К);![]() - 1820,5 кДж/моль; S°298 150,6 Дж/(моль-К); не раств. в воде. Получают разложением Gd2(C2O4)3, Gd(NO3)3 или др. на воздухе, обычно при 800-1000 °С.
- 1820,5 кДж/моль; S°298 150,6 Дж/(моль-К); не раств. в воде. Получают разложением Gd2(C2O4)3, Gd(NO3)3 или др. на воздухе, обычно при 800-1000 °С.
Хлорид GdCl3 - белые кристаллы с гексагон. решеткой (а = 0,7363 нм, с = 0,4105 нм, z = 2); т. пл. 605 °С, т. кип. 1595°С; плотн. 4,541 г/см3; С° 98,3 Дж/(моль*К);![]() — 1005,4 кДж/моль; хорошо раств. в воде. Получают взаимод. С12 с Gd2(C2O4)3 и СС14 выше 200 °С, хлорированием Г. выше 200 °С и др.
— 1005,4 кДж/моль; хорошо раств. в воде. Получают взаимод. С12 с Gd2(C2O4)3 и СС14 выше 200 °С, хлорированием Г. выше 200 °С и др.
Фторид GdF3 - белые кристаллы; при обычных условиях устойчива модификация с орторомбич. решеткой (а = = 0,6570 нм, Ь - 0,6984 нм, с = 0,4398 нм, z = 4, пространств. группа Рпта, плотн. 7,058 г/см3), к-рая при 1075 °С переходит в гексагональную с плотн. 7,33 г/см3; т. пл. 1232°С; Ср 89,71 Дж/(моль*К),![]() - 1713,3 кДж/моль. Получают взаимод. соед. Gd(lll) с газообразным HF или водных р-ров соед. Gd(III) с фтористоводородной к-той, термич. разложением фтораммонийных комплексов (напр., (NH4)3[GdF6]*nH2O) при 400-500 °С и др.
- 1713,3 кДж/моль. Получают взаимод. соед. Gd(lll) с газообразным HF или водных р-ров соед. Gd(III) с фтористоводородной к-той, термич. разложением фтораммонийных комплексов (напр., (NH4)3[GdF6]*nH2O) при 400-500 °С и др.
При переработке руд, содержащих РЗЭ, Г. концентрируется вместе с Sm, Eu, Tb, Du и Y, от к-рых он отделяется методами экстракции и ионного обмена. Металлич. Г. получают восстановлением GdCl3 или GdF3 кальцием. Г - компонент магн. сплавов с Fe, Ni, Co; перспективный материал регулирующих стержней ядерных реакторов (поглотитель нейтронов). Gd2O3, активированный Еu, - люминофор красного свечения, оксисульфид Gd, активированный Тb, - рентгенолюминофор. Гадолиний-галлиевый гранатматериал подложек для наращивания эпитаксиальных пленок железных гранатов, ювелирный поделочный камень и др. (см. Гранаты синтетические). Г. открыт в 1880 Ж. Мариньяком.
Список литературыРедкоземельные элементы. Л. И. Мартыненко, С. Д. Моисеев, Ю. М. Кисел
Похожие работы
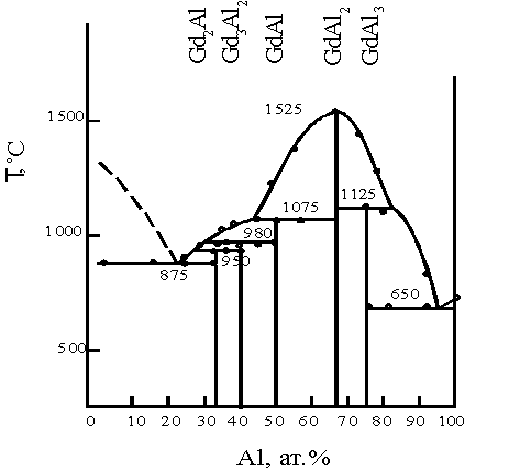
... (tпл. GdCl3 = 610˚C), остывший трихлорид хранили в герметически закрытых ампулах. Все операции с солью проводились в сухом боксе. Глава Ш. Исследование совместного электровосстановления гадолиния и алюминия в галогенидных расплавах. Из анализа литературных данных следует, что процесс электровосстановления алюминия из хлоридных и фторидных расплавов изучался в основном на платиновом ...
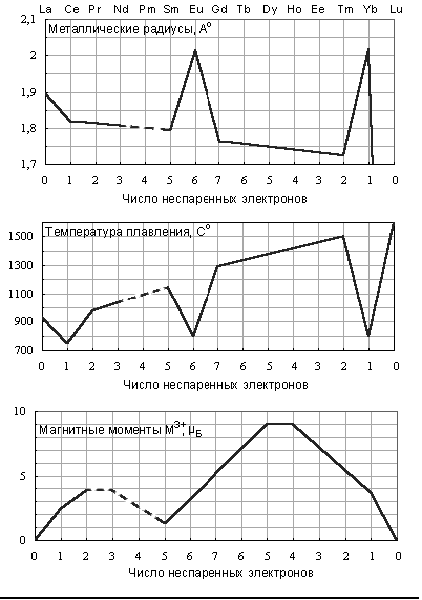
... постепенным уменьшением в ряду вышеуказанных металлов атомных и ионных радиусов (рис 2). R,нм 0,21 0,20 0,19 0,18 0,17 0,16 0,00 Z 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 Рис 2. Зависимость атомных радиусов лантаноидов от их порядкового номера Периодический характер заполнения 4f-орбиталей сначала по одному, а затем по два электрона предопределяет внутреннюю ...
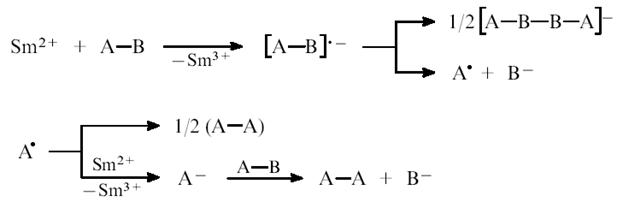
... H2O + Cl2 NaOH + CeO2 = Na2CeO3 + H2O а соединения со степенью окисления II (Eu, Sm, Yb) – восстановительные, причем окисляются даже водой: 2SmCl2 + 2H2O = 2SmOHCl2 + H2 Лантаноиды очень реакционноспособны и легко взаимодействуют со многими элементами периодической системы: в кислороде сгорают при 200–400 °С с образованием Э2O3, а в атмосфере азота при 750–1000 °С образуют ...
... —407.6 —414.0 (—414.8) (—415.6) —411.1 - —412.85 - - - —413.37 —415.4 —424.0 —428.2 —432.2 —430.2 —412.31 —427.7 Было показано, что образование полуторных оксидов окислением редкоземельных металлов сопровождается большим выделением тепла. Образовавшиеся оксиды являются весьма устойчивыми. Они плавятся выше 2000° и не разлагаются до температуры плавления. Исключение ...
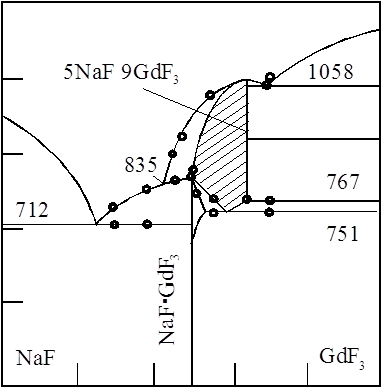
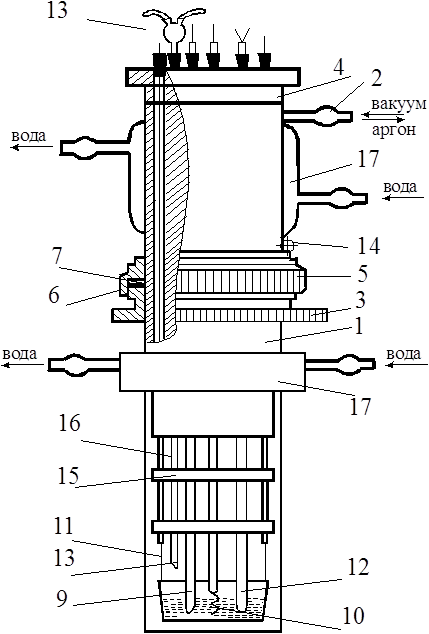
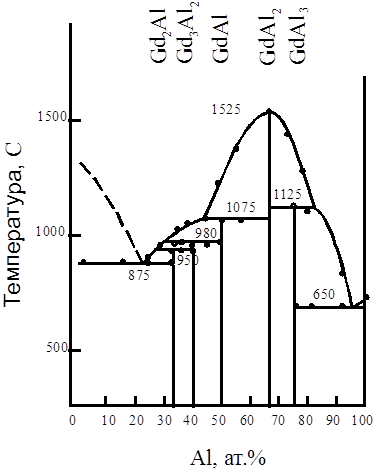



0 комментариев