
| Вещество | С чем реагирует | Что образуется | Уравнение реакции |
| Растворимое основание (Щёлочь) | Кислота | соль + вода | 2KOH + H2SO4 ® K2SO4 + 2H2O 2K+ +2 OH - + 2H+ + SO42- ® 2K+ + SO42- + 2H2O 2OH - + 2H+ ® 2H2O Реакция идёт до конца, так как образовалась вода |
| Соль | нов. соль+ нов. основание | 2NaOH + ZnCl2 ®2NaCl + Zn(OH)2 2Na+ + 2OH - + Zn2+ + 2Cl - « 2Na+ + 2Cl - + Zn2+ + 2OH - Реакция обратимая | |
| Нерастворимоеоснование | Кислота | соль + вода | Ba(OH)2 +H2SO4 ® BaSO4 + 2H2O Ba(OH)2 + 2H + + SO42- ® Ba2+ + SO42- + H2O Ba(OH)2 + 2H+ ® Ba2++ 2H2O Реакция идёт до конца, так как образовалась вода
|
|
| Металл (кроме HNO3) | соль+водорд | 3H2+1SO4 + 2Al0 ® Al2+3 (SO4)3 + 3H20 2H+1 +2e ® H20 3H 3 окислитель Al0 -3e ® Al+3 2Al 2 востановитель |
| Основание | соль + вода | HCl+ NaOH ®NaCl + H2O H+ + Cl - + Na+ + OH - ® Na+ + Cl - +H2O H+ + OH - ®H2O Реакция идёт до конца, так как образовалась вода | |
| Соль | нов. соль+ нов. кислота | 2H3PO4+ 3Na2SiO3 ® 3H2SiO3 + 2Na3PO4 6H+ + 2PO43- + 6Na+ + 3SiO32- « 6H+ + 3SiO32- + 6Na+ + 2PO43- Реакция обратимая | |
|
| Металл ( кроме Li, Na, K, Ba) | новая соль + новый металл | Mg+2Cl2 + Zn0 ® Mg0 + Zn+2Cl2 Mg+2 +2e ® Mg0 2Mg1Окислитель Zn0 -2e ® Zn+2 2Zn 1Восстановитель |
| кислота | новая соль + новая кислота | H2S + Na2SiO3 ® H2SiO3 + Na2S 2H+ + S2- + 2Na+ + SiO32- « 2H++ SiO32- + 2Na+ + S2- Реакция обратимая | |
| соль | новая соль + новая соль | 2Ag NO3+ MgCl2® 2AgCl ¯+ Mg(NO3)2 2Ag+ + NO3 - + Mg2+ + 2Cl - ® 2AgCl¯ + Mg2+ +NO32- 2Ag+ + 2Cl - ® 2AgCl¯ Реакция идёт до конца, та как образовался осадок (2AgCl) | |
| основание | нов. соль+ нов. основание | 2KOH + BaCl2 ®2KCl + Ba(OH)2 2K+ + 2OH - + Ba2+ + 2Cl - « 2K+ + 2Cl- + Ba2+ + 2OH - Реакция обратимая |
Работа ученика 9 класса “Б”
средней школы № 186
Шелудякова Алексея
Новосибирск. 2001г.
Похожие работы
... важно для выяснения механизмов электролиза, электрокатализа, электрокристаллизации, коррозии металлов и др., для совершенствования механизмов разделения веществ - экстракции и ионного обмена. Исследование свойств электролитов стимулируется энергетическими проблемами (создание новых топливных элементов, солнечных батарей, электрохимических преобразователей информации), а также проблемами защиты ...
... . Реакция среды в этом случае зависит от соотношения констант диссоциации соответствующих основания и кислоты. Усилить гидролиз можно разбавлением раствора, нагреванием системы. 2. Химические реакции Химические реакции (химические явления) – это процессы, в результате которых одни вещества превращаются в другие. Признаками осуществления химических реакций являются: – изменение цвета; ...
... реакции на альдегидную группу – окисляется оксидом серебра (1), присоединяет синильную кислоту (4): Химические свойства: 1. 2. 3. 4. 5. 6. 7. 8. Спиртовое брожение. Эта реакция характерна для гексоз. Она осуществляется с помощью биологических катализаторов – ферментов. При сбраживании гексозы превращаются в этиловый спирт. Для пентоз брожение ...
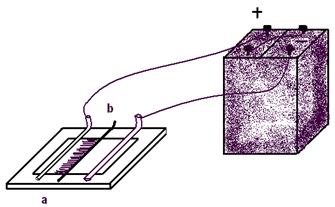
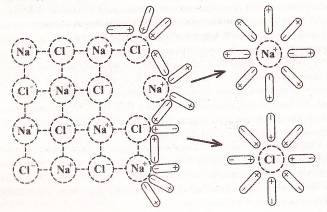
... по их поведению в растворах на две категории: а) вещества, растворы которых обладают ионной проводимостью (электролиты); б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты). К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы. Электролитическая диссоциация. ...
0 комментариев