Задача 05.
V миллилитров раствора, полученного путем растворения mВ грамм вещества в воде, имеет плотность, равную . Рассчитать молярную, нормальную и процентную концентрацию раствора.
Численные значения: V=500мл., mВ=54,4г., =1,09г/см3.
Растворенное вещество – карбонат калия К2СО3.
Решение:
Молярная концентрация:
М = 39,12 + 12 + 163 = 138,2г/моль.
МЭ = 138,2 2 = 69,1г/моль-экв.
Определяем молярность и нормальность раствора:
СМ = mB/(MV) = 54,5/138,250010-3 = 0,8моль/л2.
CN = mB/(MЭV) = 54,5/69,150010-3 = 1,6моль-экв/л.
Масса заданного объема раствора:
(mB + mP) = PV = 1,09500 = 545г.
Определяем процентную концентрацию раствора:
= (mB/(mB + mP))100% = (54,5/545) 100 = 10%
Задача 85.
Какие из ниже перечисленных солей подвергаются гидролизу? Составить молекулярные и ионно-молекулярные уравнения гидролиза этих солей. Какое значение рН (больше, меньше или равно 7) имеют растворы каждой из трех солей?
Соли: ZnSO4, NaNO2, KCl.
Решение:
KCl – соль, образована сильным основанием сильной кислотой, гидролизу не подвергается
[H+] = [OH-] – среда нейтральная.
KCl K+ + Cl-
HOH H+ + OH-
K+ + Cl- + HOH K+ + OH- + Cl- + H+
HOH = H+ + OH-
ZnSO4 – соль образована слабым основанием и сильной кислотой.
ZnSO4 Zn2+ + SO42-
HOH H+ + OH-
Zn2+ + SO42- + HOH ZnOH+ + H+ + SO42-
2Zn2+ + 2SO42- + 2HOH 2Zn(OH)+ + 2H+ + 2SO42-
2ZnSO4 + 2H2O H2SO4 + Cu(OH)2SO4
[H+] > [OH-] – среда кислая < 7.
Задача 25.
Рассматривается растворы 2-х электролитов, молярная концентрация каждого из которых равна СМ. Определить:
Силу электролитов и записать уравнения их диссоциации. Назвать электролиты.
Для сильного электролита определить молярную концентрацию каждого иона, считая, что он диссоциирует полностью.
Для слабого электролита записать выражение константы диссоциации и определит значение степени диссоциации , если величина его константы диссоциации равна КKnAm.
Определить значение рН растворов сильного и слабого электролита.
Численные значения СМ = 0,0001моль/л., КKnAm = 510-8.
Электролиты: [Cd(NH3)6](OH)2 и HClO.
Решение:
1. [Cd(NH3)6](OH)2 = Cd(NH3)62+ + 2OH- - гидроксид гексамин кадмия (II), сильный электролит.
HClO H+ + ClO- - хлорноватистая кислота, слабый электролит.
2. [Cd(NH3)6](OH)2 = Cd(NH3)62+ + 2OH-, при диссоциации 1 моля гидроксид гексамин кадмия (II) образуется 1 моль комплексных катионов Cd(NH3)62+ и 2 моля гидроксид-ионов ОН-, соответственно концентрация комплексных катионов при диссоциации электролита равна 0,0001моль/л., а концентрация ионов ОН- - 0,0002моль/л.
3. HClO H+ + ClO-
KHClO = ([H+][ClO-])/[HClO] = 510-8
KHClO = [H+]2/[HClO]
[H+] = [ClO-] = KHClO/[HClO] = (510-8 0,0001) = 2,2310-6
4. Для HСlO рН = - lg 2,2310-6 = 5,65
Для [Cd(NH3)6](OH)2
[H+] = КН2О/[ОН-] = 10-14/0,0002 = 510-10
рН = - lg 510-10 = 9,3
Задача 45.
Составить молекулярные и ионно-молекулярные уравнения реакций между следующими веществами:
Сульфат железа (II) и гидроксид натрия.
Азотная кислота и сульфат калия.
Сернистая кислота гидроксид калия
Если какая-либо реакция не протекает, объяснить, почему.
Решение:
1. FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
Fe2+ + SO42- + 2Na+ + 2OH- = Fe(OH)2 + 2Na+ + SO42-
Fe2+ + 2OH- = Fe(OH)2
2. 2HNO3 + K2SO4 2KNO3 + H2SO4
2H+ + 2NO3- + 2K+ + SO42- 2K+ + 2NO3- + 2H+ + SO42-, нет связывания ионов, поэтому реакция практически не осуществима.
3. H2SO3 + 2KOH = K2SO3 + 2H2O
H2SO3 + 2K+ + 2OH- = 2K+ + SO32- + 2H2O
H2SO3 + 2OH- = SO32- + 2H20
Задача 65.
Составить по два молекулярных уравнения для каждой реакции ионного объема:
СаСО3 + Н+ = Н2СО3 + Са2+
Fe3+ + 3OH- = Fe(OH)3
Объяснить, почему данные реакции могут протекать в прямом направлении. Назвать все вещества, участвующие в реакции.
Решение:
1. СаСО3 + 2НCl = Н2СО3 + СаCl2
СаСО3 + 2Н+ + 2Cl- = Н2СО3 + Са2+ + 2Cl2-
СаСО3 + 2НNO3 = Н2СО3 + Са(NO3)2
СаСО3 + 2Н+ + 2NO3- = Н2СО3 + Са2+ + 2NO3-
СаСО3 + 2Н+ = Н2СО3 + Са2+
Реакции могут протекать в прямом направлении т.к. образуется малодиссоциирующая угольная кислота Н2СО3.
2. FeCl3 + 3KOH = Fe(OH)3 + 3KCl
Fe3+ + 3Cl- + 3K+ + 3OH- = Fe(OH)3 + 3K+ + 3Cl-
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
Fe3+ + 3NO3- + 3Na+ + 3OH- = Fe(OH)3 + 3Na+ + 3NO3-
Fe3+ + 3OH- = Fe(OH)3
Реакции могут протекать в прямом направлении т.к. образуется нерастворимое вещество гидроксид железа III, Fe(OH)3
Похожие работы
... электролита в растворе и принимает максимальное значение a = 1 в бесконечно разбавленном растворе. так как процесс диссоциации является эндотермическим, то степень диссоциации слабого электролита в водных растворах будет увеличиваться с повышением температуры. Константой электролитической диссоциации К называется постоянная химического равновесия в растворе электролита: , где [К+], [A-] и [KA] - ...
... Планка; NA – число Авогадро; - приведенная масса молекулы электролита, г; сi – молярная концентрация ионов (сi= c0); с0 – исходная молярная концентрация электролита. 3. Изоморфизм уравнений При рассмотрении движения в поле вязких сил удобно ввести понятие подвижности b. Подвижность определяется как предельная скорость, приобретаемая телом под действием силы, равной единице, т. ...
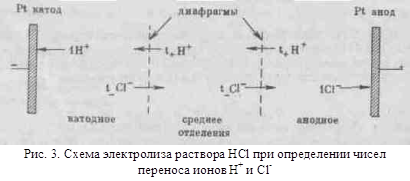
... по их поведению в растворах на две категории: а) вещества, растворы которых обладают ионной проводимостью (электролиты); б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты). К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы. Электролитическая диссоциация. ...
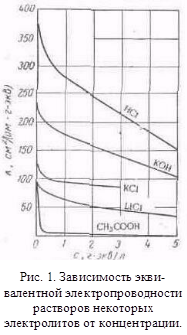
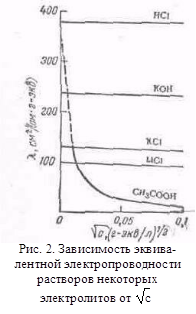
... с другими растворителями рассмотренные закономерности сохраняются, но имеются и отступления от них, например на кривых λ-с часто наблюдается минимум (аномальная электропроводность). 2. Подвижность ионов Свяжем электропроводность электролита со скоростью движения его ионов в электрическом поле. Для вычисления электропроводности достаточно подсчитать число ионов, ...
0 комментариев