Навигация
ОФ-1, БС-40, УКС – это смолы для скорейшего затвердевания состава
1. ОФ-1, БС-40, УКС – это смолы для скорейшего затвердевания состава.
2. 80% газовыделения всех вредных веществ приходится на первые 20 минут после заливки металла в формы.
3.2.4 ТЭС
Ежегодно в окружающую среду нашей планеты поступает до 2·1020 Дж теплоты, что сопровождается выбросом в атмосферу 18·109 тонн углекислого газа. Основными источниками тепловых выбросов являются процессы сжигания органического топлива (нефти, газа на ТЭС) и объекты ядерной энергетики (АЭС). Тепловые выбросы приводят к росту среднегодовой температуры атмосферы на Земле, снижению снежно-ледяного покрова и, как следствие, к уменьшению отражательной способности (альбедо) планеты. Все это стимулирует дальнейшее повышение средней температуры земной поверхности. По данным Национальной академии наук США, к середине 21 века температура атмосферы Земли возрастет примерно на 5,5°C. Поэтому за счет таяния ледников и полярных льдов в ближайшие 25 лет ожидается повышение уровня Мирового океана на 10 см.
Анализ выбросов теплоты в атмосферу от совокупности промышленных объектов на региональном уровне показывает, что характерно наличие регионов с тепловыделением от 10-20 Вт/м2 площадью до 104 км2.
3.2.5 транспортАвтотранспорт также является источником загрязнения атмосферы, количество машин непрерывно возрастает особенно в крупных городах; а вместе с тем растет валовой выброс вредных продуктов в атмосферу. Автотранспорт в отличие от промышленных предприятий относится к движущимся источникам загрязнения.
Токсическими выбросами ДВС (двигателя внутреннего сгорания) являются отработавшие и картерные газы, пары топлива из карбюратора и топливного бака.
Основная доля токсичных примесей поступает в атмосферу с отработавшими газами ДВС. Исследования состава отработавших газов ДВС показывают, что в них содержится несколько десятков компонентов, некоторые из них в таблице 3.
| компоненты | содержание компоненты, объем доли, % | примечание | |
| CO2 N2 CO CnHm | 5,0-12,0 74-77 0,5-12,0 2,0-3,0 | 1,0-10,1 76,0-78 0,01-0,50 0,009-0,5 | нетоксичны токсичны |
В целом 50% выбросов диоксида углерода в мире поставляет электроэнергетика, 1/4 – промышленность, 1/5 – транспорт.
3.3 Борьба с выбросами углекислого газа и их учетПервой страной, выступившей с заявлением о готовности сократить выбросы парниковых газов была Великобритания. Ее примеру последовали и другие страны. На переговорах по климатической конвенции наиболее решительную позицию заняли Скандинавские страны, Нидерланды, Швейцария (заявившая о сокращении выбросов углекислого газа на 2,5% к 2000 г.), ФРГ, Франция, Союз малых островных государств. Меньше энтузиазма проявили США, Канада, Россия, Япония, Саудовская Аравия.
Для борьбы с выбросами углекислого газа в атмосферу прибегают за помощью к процессам очистки и обезвреживания технологических и вентиляционных выбросов. Процессы эти различны, значит различны и способы очистки, так как:
1. газы, выбрасываемые в атмосферу вместе с углекислым газом, весьма разнообразны по своему составу.
2. имеют высокую температуру и содержат большое количество пыли, что затрудняет процесс очистки и требует дополнительной подготовки отходящих газов.
3. концентрация газа в вентиляционных и реже технологических выбросах обычно переменна и низка.
Для того, чтобы бороться с выбросами нужно точно знать присутствует интересуемый нас газ в выбросах или нет. И для этого создан высокочувствительный детектор для измерения углекислого газа.
Обычно надежность измерений содержания в атмосфере углекислого газа, играющего столь важную роль в создании парникового эффекта, снижает присутствие в воздухе водяных паров. По-видимому, японским химикам Н.Мидзуно и М.Ивамото (Хоккайдский университет, Саппоро) удалось создать детектор, устраняющий этот недостаток. Ранее в Японии велись эксперименты с порошком оксидов металлов, электрическое сопротивление которых изменяется в случае, когда диоксид углерода адсорбируется на их поверхности. Еще в 1990 г. группа под руководством Н.Ямадзо (Университет Кюсю) показала, что сопротивление порошкообразного оксида олова, помещенного между платиновыми электродами, возрастает при его продувке смесью углекислого газа с гелием при температуре 100°C. Аналогичный эффект наблюдался с использованием бария. Однако во всех этих случаях чувствительность к углекислому газу была незначительной и еще более ослабевала в присутствии водяных паров.
Позже было установлено, что высокой чувствительностью к углекислому газу обладает смесь индия с оксидами кальция, позволяющая хорошо идентифицировать этот парниковый газ даже в присутствии паров воды. Оксид индия получали путем гидролиза хлорида индия в присутствии раствора аммиака; осадок нагревали до 850°C. Полученное вещество еще активнее реагировало на углекислый газ, если к нему добавляли примерно 5% оксида кальция. Изготовленный на этой основе детектор оказался в состоянии измерять концентрации углекислого газа, не превышающие 2 тыс. частей на 1 млн. даже в присутствии 1,8% водяных паров.
Таким образом, способность оксида индия реагировать на малые концентрации углекислого газа связана с присутствием иных оксидов, причем оксид кальция повышает чувствительность в наибольшей степени; далее следуют оксиды стронция и бария; оксиды металлов – никеля, магния и калия – вполовину, а цинка, натрия, празеодима и неодима в 10 раз менее чувствительны.
Есть надежда на создание приборов, способных с большой точностью регистрировать наличие в атмосфере углекислого газа.
Очистка и последующая утилизация углекислого газа проходит через различного рода фильтры. Прибегают также и к рассеиванию выбросов.
Для контроля в России используются следующие приборы (табл. 4).
тип прибора | метод измерения | определяемое вещество | измеряемая концентрация, мг/м3 | погрешность,% |
| ФЛ-5601 | фотоколориметрический | углекислый газ | 0-20 | ±10 |
| КУ-3 | кондуктометрический | углекислый газ | 0-500 | ±5,0 |
| ГАИ-2 | оптикоабсорбционный | углекислый газ | 0-5 | ±4 |
В России ПДК (предельно допустимой концентрации) по содержанию углекислого газа не установлено, в США – 9000 мг/м3. Благодаря строгому учету нарушений ПДК и высоким штрафам в США выбросы углекислого газа на 1 млрд. долларов национального продукта за последние 10 лет уменьшились с 470 до 350 тыс. м3. Сокращение выбросов углекислого газа на 60% обойдется примерно в 2·1012$.
В ФРГ валовый национальный продукт с 1973 г. по 1985 г. увеличился на 26%, а выбросы углекислого газа сократились на 11%.
3.4 Океаническая вода как пожиратель углекислого газа
Согласно подсчетам специалистов, примерно на 60% углекислого газа, ежегодно поступающего в атмосферу Земли, надолго остается в воздушном пространстве, способствуя парниковому эффекту, остальное количество поглощается на суше и в Мировом океане. Однако механизм и активные участники этого процесса все еще вызывают дискуссии среди специалистов.
Недавно группа сотрудников Плимутской морской лаборатории (Великобритания) во главе с Уотсоном исследовала влияние скоплений планктона в северо-восточной части Атлантического океана на поглощение углекислого газа его поверхностными водами. Как показали измерения, это влияние очень существенно, причем содержание углекислого газа в воде, обусловленное активностью этих микроорганизмов, может различаться на 10% в пунктах, отстоящих друг от друга всего на 20 км. Все прежние оценки интенсивности поглощения углекислого газа Мировым океаном не учитывали подобный биологический фактор и, следовательно, были ошибочны. В течение длительного времени специалисты основным поглотителем углекислого газа считали Южный океан, и лишь в 1990 г. появились свидетельства, что и в Северном полушарии существуют районы, где этот процесс идет весьма активно.
Процесс растворения углекислого газа – в приложении 13.
Колоссальное значение океана состоит и в том, что он, будучи “легкими” планеты, пробуцирует своим фитопланктоном почти половину всего кислорода атмосферы. В обменном процессе между атмосферой и океаном, то есть в “дыхании” океана участвует 100 млрд тонн CO2. При этой жизнь, населяющая океан, ассимилирует в год в среднем 126 млрд. тонн CO2. Против 20 млрд. тонн, ассимилируемых жизнью суши. Океан, как насос, поглощает своими холодными водами CO2 в полярных широтах и отдает его в нагретых экваториальных и тропических зонах. Именно поэтому давление CO2 в области тропиков всегда несколько выше, чем в высоких широтах. Мировой океан как среда жизни представляет интерес прежде всего потому, что именно здесь, по мнению многих ученых, зародилась жизнь, которая в длительном процессе эволюции дала колоссальное многообразие форм. Разнообразие форм жизни на земле поразительно, хотя оно основано на одном типе химического процесса – фотосинтезе, в результате которого в растениях из неорганических веществ создается органическое. Большое часть растительного мира океана это микроскопические фитопланктоновые организмы прикрепленные ко дну водные растения занимают очень небольшую часть), которые в основном и являются первичной продукцией моря. Объем ежегодной продукции фитопланктона в Мировом океане оценивается величиной 500 млрд. тонн. На основе первичной продукции развиваются все другие морские организмы – бактерии, зоопланктон, рыбы, морские звери. Для развития фитопланктона кроме энергии солнечного света необходимы неорганические компоненты. В состав организмов входит до 60 химических элементов, однако 90–95% массы организмов состоит из 6 элементов, называемых биофильными (жизнелюбивыми) или биогенными. Это углерод, кислород, водород, фосфор, кремний.
Схема обмена углерода между его соединениями в океане
Атмосфера
![]() CO2
CO2
![]()
![]()
![]()
![]()
![]()
![]()
![]() водные CO2 H2CO3 HCO3- CO32-
водные CO2 H2CO3 HCO3- CO32-
![]()
![]()
![]() растения
растения
![]()
![]()
растворенные
органические вода
вещества
![]()
![]()
![]()
![]() остатки животные CaCO3 CaCO3
остатки животные CaCO3 CaCO3
![]() организмов крист. раст.
организмов крист. раст.
![]()
![]()
![]()
![]()
![]()
органические CaCO3 тв. CaCO3 тв.
вещества
На больших глубинах, где фотосинтез из-за недостатка света прекращается, идет образование CO2 за счет разложения органического вещества в результате распада. В верхнем 500 метровом слое окисляется в среднем до 87% первичной продукции. В донные осадки попадает 0,1% органического вещества. В океане ежегодно оседает все вносимое реками количество гидрокарбонатов 1,7 млрд. тонн кальция (0,5 млрд. тонн) и частично магния (0,36 млрд. тонн).
3.5 Неравномерное потребление углекислоты наземными системами.Почвы – один из важнейших природных ресурсов, который человечество активно использует с незапамятных времен. Почвы, почти сплошным ковром покрывающие поверхность земной суши, представляют собой как бы “кожу Земли”, которая предохраняет горные породы от интенсивного разрушения. Почвы – не просто субстрат, на котором растут растения, в них происходят активные биологические, химические и физические процессы, регулирующие обмен веществом и энергией между литосферой, гидросферой, атмосферой. Распределение почв, как и многих других биологических систем, подчиняются закону природной зональности, во многом связанной с климатическими параметрами. Как же поведут себя почвы в условия парникового эффекта? Потеряют ли черноземы свое плодородие? Что будет с тундровыми почвами, формирующимися на вечной мерзлоте, если она оттает на большую глубину? Будет ли скорость изменения почв равна скорости изменения климата? Как в условиях нарастающего парникового эффекта проявятся изменения почв связанные с другими антропогенными воздействиями на природу – ирригаций, сведением лесов, добычей полезных ископаемых, кислотными осадками?
Опыта по изучению данной проблемы мало. Но ясно, что локальные изменения передаются на почвы смежных территорий через поверхностные и грунтовые воды, однако со значительно меньшей скоростью и на меньшие пространства, нежели это имеет место в других природных средах (в воздухе, в воде).
Наиболее существенные сдвиги будут наблюдаться, видимо, в почвах северных широт где по прогнозам, потепление климата и увеличение осадков значительно превысят соответствующие средние и глобальные.
В тундре и лесотундре (севернее 70°с.ш.) где ожидается, что средняя температура поднимется на 4-5°C (главным образом за счет зимних температур) и возрастет количество осадков (на 50-100 мм) границы лесотундры и северной тайги начнут медленно сдвигаться к северу, значит на щебнистых и песчаных грунтах усилятся процессы подзолообразования, а на тяжелых глинистых породах, особенно в низинах – глеевые процессы или заболачивание.
В таежной зоне Восточной Сибири могут усилиться протаивание почв и грунтов, а также подзолистый процесс на равнинах в легких почвах, заболачивание полей, расширение термокарстовых и солифлюкционных явлений, приводящих к механическому перемещению почв, оползням, просадкам.
В южной тайге ожидается потепление зимой и летом на 2-3°C с одновременным уменьшением количества осадков (до 25 мм). Можно представить, что в хвойных лесах с подзолистыми почвами соответственно появятся широколиственные породы и кустарники, усилится дерновый процесс в почвах, и они приблизятся к серым лесным. На дерново-подзолистых почвах сельскохозяйственных угодий количество влаги может заветно снизиться.
В лесостепной зоне серых лесных почв, оподзоленных, выщелоченных и типичных черноземов – главной сельскохозяйственной зоне – прогнозируют некоторое потепление (на 1-2°C)и уменьшение осадков на 15-20 мм. В связи с этим в почвенном покрове весьма вероятна тенденция эволюции лугово-черноземных и черноземовидных луговых почв в черноземы, а в плакорах – за счет непромывного водного режима в последних – повысится уровень карбонатов. Усиление сухости климата в лесостепной зоне потребует в сельскохозяйственном производстве активизации мероприятий по сохранению влаги в почвах, а вероятнее всего – расширение орошаемого земледелия.
Конечно, этот прогноз основывается на ожидаемых климатических изменениях. Между тем в последние десятилетия наблюдается пока не нашедший объяснения медленный подъем уровня почвенно-грунтовых вод в Черноземной зоне Средней России и Украине, расширение площади так называемых “мочалистых” переувлажненных почв. Эти факты свидетельствуют о сложности динамики гидрологических режимов в почвах и ландшафтах, о многообразии причин их изменений, а значит, и о трудностях долговременных прогнозов.
В зонах степных черноземов и сухостепных каштановых почв с повышением среднегодовых температур на 1-2°C и с очень незначительным увеличением годовых осадков не следует ожидать изменения активности почвенной биоты и ухудшения водно-физических свойств почв; возможны локальные процессы осолонцевания почв и некоторой аридизации ландшафтов.
В полупустынной зоне светлокаштановых и бурых почв Прикаспийской низменности ожидается наряду с потеплением климата, увеличение атмосферных осадков примерно на 100 мм, что существенно усилит увлажнение почв и растительности в этой зоне. Скорее всего здесь, в типчаково-полынных и полынно-солянковых фитоценозах, постепенно возрастает количество злаков и в целом растительность пастбищных угодий улучшится, но только при разумном и бережном хозяйствовании.
В пустынях Казахстана и Средней Азии песчаные пустынные почвы, возможно, полнее покрываются злаково-кустарниковой растительностью и продлиться период ее вегетации. В почвах глинистых пустынь весьма вероятно увеличение пестроты почвенного покрова за счет перераспределения солей по элементам мезо- и микрорельефа.
3.6 ВыводыВ ходе работы выяснилось, что совсем нетоксичный оксид углерода (IV), то есть CO2 является нарушителем всего живого и неживого в природе.
В 20 веке наблюдается рост концентрации CO2 в атмосфере, доля которого с начала века увеличилась почти на 25%, а за последние 40 лет на 13%. Оценим вклад России в увеличение концентрации CO2 в атмосфере. Данные по выбросам CO2 в результате сжигания ископаемого топлива в России получены из данных по бывшему СССР, вклад которого в выбросы CO2 весьма значителен (таблица 6).
Выбросы углерода разными странами в 1960 и 1987 гг.
| Выбросы углерода по годам | ||||||
| страна | всего, млн. т | на 1 $ ВНП, г | на 1 человека, г | |||
| 1960 | 1987 | 1960 | 1987 | 1960 | 1987 | |
| США | 791 | 1224 | 420 | 276 | 4,38 | 5,03 |
| СССР | 396 | 1035 | 416 | 436 | 1,85 | 3,68 |
| Китай | 215 | 594 | - | 2024 | 0,33 | 0,56 |
| Великобритания | 161 | 156 | 430 | 224 | 3,05 | 2,73 |
| ФРГ | 149 | 182 | 410 | 223 | 2,6668 | 2,98 |
Примечание: Германия без восточной части.
По объему выбросов углерода (1 тонна углерода соответствует 3,7 тонны углекислого газа) первое место принадлежит США, затем страны Европейского экономического сообщества, а далее бывший СССР. Эти страны дали более половины выбросов, так как в России производится примерно 80% получаемой ранее в СССР продукции, ее вклад в выбросы CO2 в атмосферу весьма велик и составляет порядка 800 млн. тонн углерода, или около 3 млрд. тонн CO2, следовательно, на каждого жителя приходится несколько меньше 13% общей массы выбрасываемого в атмосферу углерода, на долю США более 20%, на долю ЕЭС – около 20%, на долю Китая немногим более 11%. Таким образом, вклад хозяйства России в возможный парниковый эффект весьма значительный.
Экологи предупреждают, что если не удастся уменьшить выбросы в атмосферу CO2, то нашу планету ожидает катастрофа. Сегодня остается нерешенной мировая проблема энергии и CO2.
Нерешенные проблемы в мире: энергия и углекислый газ.
![]()

![]()
выбросы CO2,
![]() в
млрд. т
в
млрд. т
 мировые
мировые
![]() потребления
потребления
 энергии,
в
энергии,
в

![]() млрд.
т
млрд.
т
![]() нефти
нефти

![]()
![]()
Эмиссия углекислого газа обусловлена энергией на душу населения в этих странах. Данные за 1986 г. в т. CO2:
![]() ГДР 21,2
ГДР 21,2
![]() США 19,7
США 19,7
![]() Канада 17,0
Канада 17,0
![]()
![]() Россия 13,2
Россия 13,2
Польша 12,7
![]()
![]() Великобритания 11,9
Великобритания 11,9
ФРГ 11,7
![]() Япония 7,5
Япония 7,5
![]() Франция 6,9
Франция 6,9
![]() Италия 6,4
Италия 6,4
![]() Китай 1,9
Китай 1,9
![]() Индия 0,7
Индия 0,7
В среднем в мире – 3,88
Источники загрязнения:
сжигание горючих ископаемых сопровождается выбросом 5 млрд. тонн CO2 в год. В результате этого за 1860-1960 содержание CO2 увеличилось на 18% (0,027 до 0,032%). За 1961-1991 темпы этих выбросов значительно возросли. При таких же темпах к 2000 году количество CO2 в атмосфере составит не менее 0,05%.
Библиография
1. Ахметов Н.С. Неорганическая химия. Учеб. пособие для учащихся 8–9 кл. шк. с углуб. изучением химии. В 2-х частях – ч. 1, ч. 2, – 2-е изд. – М.: Просвещение, 1990 – 208 с.
2. Ахметов Н.С. Общая и неорганическая химия. Учеб. пособие для ВУЗов, М.: Высшая школа, 1988 – 470 с.
3. Бабич Л.В., Балезин С.А., Гликина Ф.Б., Зак Э.Г. Практикум по неорганической химии. Учеб. пособие для ВУЗов, М.: Высшая школа, 1989 – 300 с.
4. Барабаш Ц.И. “Использование МПС для формирования у учащихся основ диалектико-материалистического мировоззрения”, ж. “Химия в школе”, 1982, № 3, с. 15.
5. Башлак А.Т. “Что может зажечь углекислый газ”, ж. “Химия в школе”, 1991, № 5, с. 58.
6. Белов С.В., Барбинов Ф.А., Козьеков А.Ф. Охрана окружающей Среды. Учеб. для техн. спец. ВУЗов, под ред. Белова С.В., 2-е изд. и доп. – М.: Высшая школа, 1991 – 319 с.
7. Богдановский Г.А. Химическая экология. Учеб. пособие. М.: Московский Университет, 1994 – 240 с.
8. Боголюбова З.К. Лекции по МПХ, 1993 – 1995.
9. Большая Советская Энциклопедия, т.18, 1974, с. 330.
10. Вишневский Л.В. Под знаком углерода. М.: Просвещение, 1983 – 100 с.
11. Воробьев А.Ф., Дракин С.И. Практикум по неорганической химии. М.: Химия, 1984, 151 с.
12. Вредные химические вещества. Под общей ред. д. биол. н., проф. Филова В.А., Л.: Химия, 1988.
13. Гаркунов В.П., Николаева Е.Б. “Межпредметные связи при проблемном изучении химии”, ж. “Химия в школе”, 1982, № 3, с. 28.
14. Гладкий Ю.Н., Лавров С.Б. Дайте планете шанс!. Книга для учащихся. М.: Просвещение, 1995 – 207 с.
15. Глинка Н.Л. Общая химия. Учеб. пособие для ВУЗов, 22-е изд. исп. Под ред. Рабиновича В.А., Л.: Химия, 1982 – 720 с.
16. Дюсюпова Л.З. “О связи преподавания органической химии с физикой”, ж. “Химия в школе”, 1981, № 4, с. 38.
17. А.Г. Джексон, М.Р. Гримметт. Общая органическая химия. Книга “Азотсодержащие гетероциклы”. Перевод с англ. д. х. н. Кондратьевой и проф. Вульфсона под ред. ак. Кочеткова, М.: Химия, 1985, т. 8.
18. Ерыгин Д.П., Орлова Л.Н. “МПС в процессе изучения химии в 8 классе”, ж. “Химия в школе”, 1982, № 3, с. 23.
19. Ерыгин Д.П., Шишкин Е.А. Методика решения задач по химии. Учеб. пособие для студентов пед. ин-тов по биологии и химии, М.: Просвещение, 1989, 179 с.
20. Зуева М.В., Иванова Р.Г., Каверина А.А. и др. Обучение химии в 9 классе. Пособие для учителя. Под ред. Зуевой М.В. – М.: Просвещение, 1990 – 176 с.
21. Корчагина В.А. Биология: растения, бактерии, грибы, лишайники. Учеб. 6 – 7 кл. ср. шк. – 23-е изд. М.: Просвещение, 1992 – 256 с.
22. Криксунов Е.А., Пасенчик В.В., Сидорин А.П. Экология России. Учеб. для 9 – 11 кл. общеобр. шк. – М.: АОМДС, ЮНИСАМ, 1995 – 232 с.
23. Криксунов Е.А., Пасенчик В.В., Сидорин А.П. Экология. Учеб. пособие для учащихся 9 кл. – М.: Дрофа, 1995 – 240 с.
24. Г. Лукс. Экспериментальные методы в неорганической химии. М.: Мир, 1965 – 365 с.
25. Максимова В.Н. “МП семинар “Биогенные элементы в периодической системе Д.И. М.””, ж. “Химия в школе”, 1981, № 2, с. 26.
26. “Методические пути реализации МПС курса химии с биологией в обучении и внеклассной работе”. Часть 1. Планирование МПС. Часть 2. Оптимизация уроков химии средствами МПС. Рекомендации подготовлены Зайцевым М.А., ассистентом кафедры химии КГПИ им. В.И. Ленина и Койковой Р.С., доцентом кафедры химии КГПИ им. В.И. Ленина, Киров, 1993.
27. Минченков Е.Е. “МПС неорганической химии и физики”, ж. “Химия в школе”, 1981, № 2, с. 22.
28. Миркин Б.М., Наумова Л.Г., Экология России. Учебник для 9–11 кл., М.: Юнисам, 1995.
29. Назаренко В.М. “Экологизированный курс химии от темы к теме”, ж. “Химия в школе”, 1994, № 4, с. 24.
30. Оганесян Э.Т. Руководство по химии. М.: Высшая Школа, 1991 – 200 с.
31. Михайло Ломоносов: Жизнеописание. Избранные труды. Воспоминания современников и суждения потомков. Стихи и проза о нем. Составили Павлова Г.Е., Орлов А.С., М.: Современник, 1989 – 493 с.
32. Пак М.С. “Из опыта использования тестовых заданий”, ж. “Химия в школе”, 1993, № 2, с. 41.
33. Покровский О.С., Савенко В.С. “Экспериментальное моделирование осаждения карбоната кальция в морской воде в условиях фотосинтеза”, ж. “Океанология”, МАИК “Наука”, т. 35, № 6, ноябрь – декабрь 1995, с. 883.
34. Протасов М.В., Молчанов А.В. Экология, здоровье, природопользование в России. М.: Финансы и статистика, 1995.
35. Рудзитис Г.Е., Фельдман Ф.Г. Химия: органическая химия. Учеб. для 10 кл. ср. шк. – М.: Просвещение, 1991 – 160 с.
36. Рябинович В.А., Хавин З.Я. Краткий химический словарь. Л.: Химия, 1978.
37. Сборник программ для общеобразовательных учреждений Российской Федерации 8 – 11 кл. Химия, М.: Просвещение, 1995.
38. Смирнов В.И. Геология полезных ископаемых, М.: Недра, 1969 – 640 с.
39. М.В. Сарджент, Т.М. Крест, О.Мет-Кон, Р. Ливингстон. Книга “Кислородсодержащие гетероциклы”, Перевод с англ. д. х. н. Л.И. Беленького под ред. Кочеткова, М.: Химия, 1985, т.9.
40. Химия. Справочный материал под редакцией академика Третьякова Ю.Д., М.: Просвещение, 1993.
41. Ходаков Ю.В. Общая и неорганическая химия. Пособие для учителей. М.: Просвещение, 1965 – 704 с.
42. Фельдман Ф.Г., Рудзитис Г.Е. Химия. Учеб. для 9 кл. ср. шк. – М.: Просвещение, 1990 – 176 с.
43. Цузмер А.М., Петришина О.Л. Биология: человек и его здоровье. Учеб. для 9 кл. ср. шк. под ред. Загорской В.Н., 19-е изд. – М.: Просвещение, 1990 – 240 с.
44. Энциклопедический словарь юного химика. М.: Просвещение, 1990.
43
Введение
Свою дипломную работу хочу начать со слов ученого-земляка М.В. Ломоносова, которые являются эпиграфом данной работы:
“Вольность и союз наук необходимо требуют взаимного сообщения и беззавистного позволения в том, что кто знает упражняться. Слеп физик без математики, сухорук без химии”.
Перед собой поставила следующие цели:
1. Проследить и изучить межпредметные связи в школьном курсе химии.
2. Подготовить тематическое планирование с взаимными связями в курсе химии-9 с географией, биологией.
3. Ознакомиться с методами и путями реализации межпредметных связей.
4. Опробовать межпредметные связи в различных формах (типы: урок, семинар, викторина, конференция) на педагогической практике 4-5 курса и провести анализ работы.
5. Изучить историю открытия углекислого газа, его химические, физические свойства.
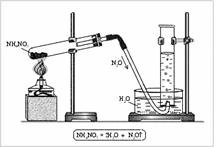
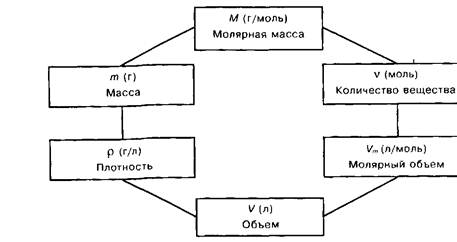
6. Провести эксперимент по определению молярной массы углекислого газа используя для его получения несколько методик. Дать ответ в виде столбиковых диаграмм об относительной ошибке определения. Выявить наиболее доступный способ его получения в условиях лаборатории университета относительно наличия химических реактивов, условий протекания химической реакции, наличия химической посуды.
7. Изучить одну из глобальных проблем человечества – “парниковый эффект” или “эффект гринхауз” (зеленый дом) и роль углекислого газа в его создании.
8. Изучить процесс поглощения водами Мирового океана атмосферного углекислого газа и образование карбонатных отложений.
9. Изучить реакцию наземных и морских экосистем к возникновению и развитию парникового эффекта.
10. Изучить возможные пути разрешения данной экологической проблемы.
11. Проследить при этом взаимосвязь химических процессов и географии.
Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений
Что же представляют из себя межпредметные связи?
Межпредметные связи – это современный принцип обучения в средней школе. Он обеспечивает взаимосвязь предметов естественнонаучного и естественно-гуманитарного циклов и их связь с трудовым обучением школьников.
По определению Д.П. Ерыгина: “Межпредметные связи можно рассматривать как дидактическую систему, которая отражает в школьных курсах объективно существующие взаимосвязи, обеспечивает посредством согласованного взаимодействия ее учебных компонентов осуществления целенаправленного процесса обучения школьников”.
Использование межпредметных связей – одна из наиболее сложных методических задач учителя химии. Она требует знания содержания программ и учебников по другим предметам. Реализация межпредметных связей в практике обучения предполагает сотрудничество учителя химии с учителями других предметов.
Учитель химии разрабатывает индивидуальный план реализации межпредметных связей в курсе химии. Методика творческой работы учителя в этом плане проходит следующие этапы:
1. Изучение программы по химии, ее раздела “Межпредметные связи”, программ и учебников по другим предметам, дополнительной научной, научно-популярной и методической литературы;
2. Поурочное планирование межпредметных связей с использованием курсовых и тематических планов;
3. Разработка средств и приемов реализации межпредметных связей на конкретных уроках (формулировка межпредметных познавательных задач, домашних заданий, подбор дополнительной литературы для учащихся, подготовка необходимых учебников и наглядных пособий по другим предметам, разработка методических приемов их использования);
4. Разработка методики подготовки и проведения комплексных форм организации обучения (обобщающих уроков с межпредметными связями, комплексных семинаров, экскурсий, занятий кружка, факультатива по межпредметным темам и т.д.);
5. Разработка приемов контроля и оценки результатов осуществления межпредметных связей в обучении (вопросы и задания на выявление умений учащихся устанавливать межпредметные связи).
Планирование межпредметных связей позволяет учителю успешно реализовать их методологические, образовательные, развивающие, воспитательные и конструктивные функции; предусмотреть всё разнообразие их видов на уроках, в домашней и внеклассной работе учащихся.
Для установления межпредметных связей необходимо осуществить отбор материалов, то есть определить те темы химии, которые тесно переплетаются с темами из курсов других предметов.
Курсовое планирование предполагает краткий анализ содержания каждой учебной темы курса с учетом внутрипредметных и межпредметных связей.
1.1 Использование межпредметных связей для формирования у учащихся основ диалектико-материалистического мировоззрения
Использование опорных знаний других предметов при изучении отдельных тем курса химии – важнейшее средство формирования у учащихся диалектико-материалистического мировоззрения, целостного представления о явлениях природы и взаимосвязи между ними.
Решение этой задачи успешно осуществляется при совместной согласованной работе учителей различных дисциплин: природоведения, химии, физики, географии, биологии, математики, обществоведения, истории и др. Рассмотрим те межпредметные связи курса химии, которые касаются формирования основ научно-материалистического мировоззрения учащихся. Рассмотрим это на отдельных примерах.
Изучению курса химии в 8 классе предшествуют курсы природоведения и ботаники, в которых учащиеся получают первоначальные представления о живой и неживой природе. Эти знания мы считаем опорными при рассмотрении различных разделов темы: “Первоначальные химические понятия”. Так, в курсе природоведения учащиеся изучали вещества: кислород, углекислый газ, воду и смеси веществ, песок, глину, получили некоторые сведения об использовании угля, руды, нефти, способах разделения смесей. Для углубления и расширения этих знаний предлагаем восьмиклассникам вопросы:
1. Какие вещества, изученные вами в предыдущих классах, относятся к чистым веществам, а какие к смесям?
2. Почему не имеют смысла выражения “молекула воздуха”, “молекула гранита”, “молекула нефти”?
3. Как отделить речной песок от опилок?
4. Почему нельзя фильтрованием выделить из раствора поваренную соль?
Обсуждение этих вопросов позволяет приступить к формированию понятий “тело”, “вещество” (как один из основных видов материи). Предлагаем учащимся самостоятельно, используя знания из курса физики, природоведения, географии привести примеры тел и веществ, обращаем внимание на их разнообразие, сходство и различие по свойствам. Подчеркиваем, что свойства веществ проявляются в конкретных условиях при том или ином воздействии на вещество и при взаимодействии его с другими веществами. Отмечаем, что отдельные свойства веществ при изменении условий при физических условиях могут меняться, но качества вещества будут оставаться прежними. Подчеркиваем, что под качеством понимается природа вещества, его индивидуальность. Внешне качество вещества проявляется в его свойствах. Обращаем внимание на то, что всякое изменение, превращение (химическая реакция) есть особый вид движения материи – химической формы движения. Вещества, отличающиеся по составу молекул, по разному ведут себя при химических реакциях.
При изучении простых и сложных веществ предлагаем ученикам вспомнить, с какими из них они ранее познакомились в курсе природоведения, каких веществ в природе больше – простых или сложных. Обращаем их внимание на разнообразие простых и сложных веществ.
Сообщая учащимся, что химические элементы делятся на две группы: металлы и неметаллы, мы отличаем наличие в них противоположных свойств и в то же время отсутствие резких границ между ними. Так формируется понятие о взаимосвязях веществ.
При рассмотрении понятия о валентности как свойстве атомов химических элементов, повторяем постоянство состава веществ и формируем понятие “количество”. Разъясняем, что количественные данные характеризуют отношения масс между элементами в сложном веществе в соотношении с их валентностью, относительной атомной и молекулярной массой, числом атомов в молекуле (для веществ с молекулярным строением), а также физические величины: плотность, температура кипения, замерзания и т.д. Через количественные соотношения входящих в состав данного вещества элементов выражается постоянство состава чистых веществ.
При изучении первоначальных химических понятий представляется возможность развить полученные в курсе природоведения 5 класса знания о веществе, в курсе физики 7 класса – физических и химических явлениях. Подчеркиваем реальность (объективное существование) атомов и молекул, существование веществ независимо от нашего сознания, объективность свойств веществ.
Рассматривая закон сохранения массы веществ, знакомим учеников с количественной стороной химических процессов. В ходе этой работы обсуждаем вопросы:
1) Будет ли масса сульфида железа (II) равна массе железа и серы, вступивших в реакцию?
2) Каковы массы кислорода и водорода, полученные при разложении воды? Сравните массы веществ до и после реакции.
3) Как можно объяснить сохранение массы веществ в свете атомно-молекулярного учения?
4) Объясните, почему масса угля и золы, образовавшихся при горении дров, меньше массы сгоревших дров?
5) Какое значение имеет закон сохранения массы веществ для практического получения веществ?
После обсуждения этих вопросов делаем вывод о неуничтожимости и несотворимости веществ (вечности материи).
Обращаем внимание на характеристику количественной и качественной сторон химической реакции. Указываем, что общее для всех типов химических реакций (разложение, замещение, соединение) – превращение веществ: возникновение из исходных новых веществ с новыми качествами, что и означает химическое движение. При это подчеркивается, что масса веществ, которые вступили в химическую реакцию, всегда равна массе веществ, образовавшихся в результате реакции. Из закона сохранения массы веществ следует, что вещества не могут возникать из ничего или превращаться в ничто.
Изучая тему “Кислород. Оксиды. Горение.” даем определения понятий “свойство” и “качество”, используя при этом знания о свойствах кислорода, полученные в курсе природоведения.
После изучения темы “Вода. Растворы. Основания.” предлагаем учащимся выполнить самостоятельные практические работы. При этом используем вещества, которые изучались в курсе природоведения (“Воздух”, “Вода” и др.), в курсе ботаники (“Дыхание семян”, “Дыхание листьев”), а также в курсе физики. Даем задание осуществить превращения:
C ® CO2 ® H2CO3 ® Na2CO3
Практические работы такого характера раскрывают взаимосвязь между различными классами химических соединений, развивают идею о познаваемости мира.
Исходя из превращений, осуществляемых при переходе от одних веществ к другим, даем определение понятия “развитие” (переход от одного качественного состояния к другому).
Большое научное и мировоззренческое значение имеют темы: “Периодический закон и периодическая система химических элементов Д.И. Менделеева”, “Строение атома”. Показываем, что все химические элементы имеют общую материальную основу: “общность элементов проявляется и том, что все они являются членами упорядоченной совокупности периодической системы элементов”.
На следующих уроках развиваются знания о строении атомов, полученные в курсе физики 7 класса. При этом изучение проводится так, чтобы оно способствовало формированию диалектико-материалистического мировоззрения. В ходе урока ученики убеждаются во внутреннем противоречии в структуре атома (атом как единство и борьба противоположностей): в его состав входит положительно заряженное ядро и отрицательно заряженные электроны. Единство этих противоположностей есть условие существования атомов как электронейтральных частиц.
Автор учебника химия-8 (“Просвещение”, 1995г.) Леонид Степанович Гузей считает, что в настоящее время ПСХЭ следует рассматривать как справочное пособие к строению атома и периодического закона Д.И. Менделеева рассматривать соответственно этой концепции.
Не менее важно и то, что межпредметные связи позволяют более целесообразно планировать изучение материала, экономить время, при этом знания по другим предметам конкретизируются, углубляются, обобщаются.
1.2 Пути и методы реализации межпредметных связей
Вопрос о путях и методах реализации межпредметных связей – это один из аспектов общей проблемы совершенствования методов обучения. Отбор методов обучения учитель производит на основе содержания учебного материала и на подготовленности учащихся к изучению химии на уровне межпредметных связей.
На первых этапах обучения учащихся приемам установления межпредметных связей преобладает объяснительно-иллюстративный метод. Учитель весь материал межпредметного содержания объясняет сам. Когда у учащихся сформируются умения работы с материалом межпредметного содержания, можно применять репродуктивный и частично-поисковый методы и творческие межпредметные задачи.
Средства реализации межпредметных связей могут быть различны:
· вопросы межпредметного содержания: направляющие деятельность школьников на воспроизведение ранее изученных в других учебных курсах и темах знаний и их применение при усвоении нового материала.
· межпредметные задачи, которые требуют подключения знаний из различных предметов или составлены на материале одного предмета, но используемые с определенной познавательной целью в преподавании одного другого предмета. Они способствуют более глубокому и осмысленному усвоению программного материла, совершенствованию умений выявить причинно-следственные связи между явлениями.
· домашнее задание межпредметного характера – постановка вопросов на размышление, подготовка сообщений, рефератов, изготовление наглядных пособий, составление таблиц, схем, кроссвордов, требующих знаний межпредметного характера.
· межпредметные наглядные пособия – обобщающие таблицы, схемы, диаграммы, плакаты, диаграммы модели, кодопозитивы. Они позволяют учащимся наглядно увидеть совокупность знаний из разных предметов, раскрывающую вопросы межпредметного содержания.
· химический эксперимент – если предметом его являются биологические объекты и химические явления, происходящие в них.
Использование межпредметных связей вызвало появление новых форм организации учебного процесса: урок с межпредметными связями, комплексный семинар, комплексная экскурсия, межпредметная экскурсия и др.
Уроки с межпредметным содержанием могут быть следующих видов: урок-лекция; урок-семинар; урок-конференция; урок-ролевая игра; урок-консультация и др.
· уроки межпредметного обобщения или тематические задания – проблема педагогики и методики как соединить знания с практической полезной деятельностью. Научить применять знания.
Суть тематического планирования заключается в следующем: группам учащихся дается задание разработать рекомендации по использованию удобрений, веществ, реакций относительно данной местности. Эти задания имеют МПС и готовятся совместно с учителями биологии, географии, черчения, рисования – это бинарные уроки.
Ход проведения: группа из 4-6 человек выбирает руководителя проекта, специалистов (биолог, агроном, чертежников, художник-оформитель), определяет задания каждому ученику. Группы собираются и отчитываются о работе.
Каждой группе дается своеобразное домашнее задание, которое будет завершено защитой своих работ. Вначале такого урока – краткая беседа учителя, в ходе которой ставится цель, представляются учащиеся, определяется порядок защиты. Затем идут выступление групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание. Обязательно прослеживается связь с окружающей средой.
По этим урокам можно сделать вывод:
1. Все уроки связаны педагогической логикой.
2. Строго выполняется учителем тема по программе.
3. Включено обязательно решение задач.
4. Главное достоинство – ученики учатся учиться по указанию учителя.
5. Но самое главное – все задания выполняются самостоятельно.
Конкретные примеры – в приложении 1 дипломной работы.
1.3 Межпредметные связи в процессе изучения химии в 9 классе
Отражение межпредметных связей и определение содержания в программах : а) для обычных классов без специализации – программа курса химии для 8-11 классов средней общеобразовательной школы – разработана в лаборатории химического образования Института общеобразовательной школы РАО – Москва “Просвещение” 1993 год, тема “Подгруппа углерода” – 7 часов. б) программа курса неорганической химии для 8-9 классов химико-биологического профиля (авторы: Н.Е. Кузнецова, Г.П. Никифорова, И.М. Титова, А.Ю. Жегин) на тему “Неметаллические соединения и их важнейшие химические соединения” отводится 50 часов, на тему “Углерод и его соединения” – 16 часов, является своевременным и важным положением в системе обучения учащихся, поскольку методически обоснованное осуществление межпредметных связей в процессе изучения школьных дисциплин способствует повышению качества знаний учащихся, развитию их мыслительной деятельности.
Реализация межпредметных связей при изучении химии является одной из форм логического повторения, углубления и совершенствования приобретенных знаний.
Поскольку межпредметные связи обеспечивают привлечение учащимися на уроках знаний из области других предметов, важно с учетом требований программ выделить наиболее общие, устойчивые и долговременно действующие межпредметные понятия. Примером таких понятий могут быть понятия о составе, строении, химических свойствах и биологических функциях веществ. При отборе и использовании межпредметной информации важно не нарушить логику построения учебных предметов и не допускать перегрузки их содержания.
Способы привлечения знаний из других предметов различны. Можно предложить учащимся при подготовке к занятиям восстановить в памяти ранее изученные вопросы. В отдельных случаях учитель при изложении нового материала сам напоминает сведения, полученные при изучении других предметов, включая при этом учащихся в активную беседу. Опыт учителей-методистов показывает, что установление взаимосвязей между предметами успешно проходит при включении в содержание урока (или в задание на дом) примеров и задач межпредметного характера.
Для того, чтобы успешно реализовать межпредметные связи в учебной деятельности, учитель химии должен прежде всего овладеть содержанием соответствующих дисциплин.
Конкретизация использования межпредметных связей в процессе обучения достигается с помощью поурочного планирования. Последнее осуществляется с учетом вида урока с межпредметными связями:
фрагментальный, когда лишь фрагменты, отдельный этап урока, требует реализации связей с другими предметами;
узловой, когда опора на знания из других предметов составляет необходимое условие усвоения всего нового материала или его обобщения в конце учебной темы;
синтезированный, который требует синтеза знаний из разных предметов на протяжении всего урока и специально проводится для обобщения материала ряда учебных тем или всего курса.
Поурочный план – разработка показывает, когда, на каком этапе урока и как, какими способами, включаются знания из других курсов в изучении нового или закрепления учебного материала. Особенно необходима тщательная разработка обобщающего урока с межпредметными связями. Выделение таких уроков производится на основе тематического планирования. Поурочное планирование может быть выполнено в виде плана конспекта или в виде таблицы
| этапы урока | вопросы МП содержания | методы и приемы | средства наглядности | внутрипредметные и межпредметные связи |
Составляя поурочные планы, учителю важно знать, что учащиеся уже усвоили из необходимых опорных знаний на уроках по другим предметам, согласовать с учителями смежных предметов постановку вопросов и заданий, чтобы избежать дублирования и достигнуть развития общих идей и понятий, их углубления и обогащения. Этому помогает взаимопосещение уроков и изучение составляемых коллегами планов реализации межпредметных связей.
Таким образом, планирование составляет необходимое и существенное условие подготовки учителя к эффективному осуществлению межпредметных связей и является одним из средств их реализации в практике обучения школьников.
Предлагаю тематическое планирование по теме “Подгруппа углерода” в курсе химии 9 класса в приложении 2.
1.4 О связи обучения химии и географии
Помимо межпредметных связей между химией, биологией, учителя используют и сведения из географии. В 8 классе во время объяснения состава воздуха и его применения можно использовать знания учащихся об атмосфере, полученные ими на уроках географии. Восьмиклассники могут дать правильные ответы на вопросы: какое значение имеет атмосфера для живых организмов? Назовите атмосферные слои, расскажите о составе воздуха. Затем учитель сам дополняет рассказ о составе воздуха и его применении.
Проблема парникового эффекта
При изучении свойств воды задаем учащимся следующие вопросы:
1. На какие группы подразделяются материковые воды? Отмечаем, что образование горячих источников связано с остыванием вулканов, в процессе которого из их сопел начинают бить гейзеры. Подчеркиваем, что возникновение гейзеров не связано с какими-то божественными силами. Учащиеся узнают о значении воды в жизни человека, ее химическом составе и получении чистой воды.
2. Расскажите об очистке природной воды.
3. Какое значение имеет очистка питьевой воды?
4. Где используют воду?
В 9 классе при изучении минеральных удобрений используем знания учащихся по экономической географии. Ученики рассказывают о значении минеральных удобрений для повышения урожайности сельскохозяйственных культур, о роли химии в развитии животноводства. После этого дополняем более подробными сведениями материал о свойствах минеральных удобрений и их разновидностях. Выделяется удобрение мочевина CO(NH2)2 и его роль в питании животных.
Во время изучения основных видов горючего 10 класс 5 тема “Природные углеводороды” предлагаем учащимся следующие вопросы:
1. Назовите крупнейшие месторождения каменного угля.
2. Расскажите о месторождениях нефти.
3. Где находятся крупные месторождения природного газа?
Ученики показывают на географической карте где находятся эти месторождения.
При знакомстве в 10 классе с каучуком учащиеся вспоминают страны – основные производители натурального каучука: Бразилию, Индонезию.
В декаду естественных наук можно организовать турнир знатоков, в который можно включить вопросы по химии и географии – в приложении 4.
1.5 Межпредметные связи неорганической, органической химий и физики.“Химик без знания физики подобен
человеку, который всего должен искать
ощупом. И сии две науки так соединены
между собой, что одна без другой в
совершенстве быть не могут”
М.В. Ломоносов.
Эти слова подтверждаются делом учителями-методистами, когда первые химические понятия строятся на тех знаниях учеников, которые они получают на уроках физики.
8 класс. При изучении темы “Первоначальные химические понятия” можно использовать знания учащихся важных понятий, сформированных в курсе физики 7 класса. К ним относятся: тело, вещество, атом, молекула, физические и химические явления, внутренняя энергия, температура. Из курса физики учащимся известны также общие сведения о строении твердых тел, жидкостей и газов, положения молекулярно кинетической теории.
Необходимо учитывать, что большинство физических понятий находятся в процессе формирования, а поэтому на данном этапе обучения учащихся эти понятия сформированы еще недостаточно строго. Это относится и к таким изначальным понятиям, как тело и вещество. Под физическим телом учащиеся понимают каждое из окружающих тел, а под веществом – один из видов материи.
Достаточно полное представление получили учащиеся в 7 классе на уроках физики о молекулах. Они узнали, что молекулы – мельчайшие частицы вещества, кроме того им известно, что молекулы одного вещества одинаковы, что они находятся в непрерывном движении. На уроках химии это понятие углубляется, расширяется.
На уроках физики учащиеся знакомятся с понятием массы вещества, которое вводится в процессе анализа опыта по взаимодействию тележек. Этот опыт исключает в дальнейшем путаницу в понятиях вес тел, их масса.
В 7 классе начинается формирование первых представлений об энергии. Учащиеся узнают, что энергию, определяемую взаимным расположением тел, называют потенциальной, а энергию движущихся тел – кинетической. Каждое тело, состоящее из большого числа частиц (атомов и молекул) обладает внутренней энергией, характеризующейся суммой кинетической и потенциальной энергий всех частиц.
Углубленное изучение энергетики химических реакций осуществляется по учебнику Ахметова “Химия, 8-9”.
Энергетика химических реакций.
Знание закономерностей химических реакций позволяет прогнозировать их протекание. Можно получать вещества с требуемыми свойствами.
Для изучения данной темы необходимо повторить с учащимися материал из курса физики, касающийся закона сохранения и превращения энергии.
При химическом превращении, т.е. в период протекания химической реакции происходит перестройка электронных структур атомов, ионов, молекул. Поэтому химическая реакция всегда сопровождается энергетическими изменениями.
Тепловые эффекты реакций можно определить и экспериментально, и с помощью термохимических расчетов.
В основе данных расчетов лежит закон, сформулированный Г.И. Гессом. Даем формулировку данного закона и приводим пример, давая пояснения: “Тепловой эффект реакции зависит от вида и состояния исходных веществ и конечных продуктов и не зависит от пути процесса”. В качестве примера возьмем реакцию полного сгорания угля:
C(k) + O2(r) ® CO2(r); DH1 = -393,5 кДж
Предлагаем учащимся допустить, что данный химический процесс протекает в две стадии.
I стадия – при горении угля образуется оксид углерода (II) CO:
C(k) + 1/2 O2(r) ® CO(r); DH2 = -110,5 кДж
II стадия – при сгорании CO образуется оксид углерода (IV) CO2:
CO2(r) + 1/2 O2(r) ® CO2(r); DH3 = -283,0 кДж
Суммируем эти две стадии:
C(k) + 1/2 O2(r) ® CO(r); DH2 = -110,5 кДж
CO2(r) + 1/2 O2(r) ® CO2(r); DH3 = -283,0 кДж
ѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕ
C(k) + O2(r) ® CO2(r)
DH2 + DH3 ® -110,5 кДж + (-283,0 кДж) = -393,5 кДж
Исходя из закона Гесса тепловые эффекты образования CO2 и из простых веществ и через промежуточную стадию образования и сгорания CO равны:
DH1 = DH2 + DH3 = -393,5 кДж
Если бы тепловые эффекты не были бы равны, то нарушался бы закон сохранения энергии. В качестве подтверждения наших рассуждений приводим диаграмму на рис. 4.
![]()
![]()
![]() E
E
![]()
![]()
![]()
![]()
![]()
![]()
![]() C(k)
+ O2(r)
C(k)
+ O2(r)
DH2 = -110,5 кДж
![]()
![]()
![]()
![]()
![]()
![]()
![]() CO(r)
+ 1/2 O2(r)
CO(r)
+ 1/2 O2(r)
![]() DH1
= -393,5 кДж DH3
= -283,0 кДж
DH1
= -393,5 кДж DH3
= -283,0 кДж
![]()
![]()
![]()
![]()
![]() CO2(r)
CO2(r)
Из диаграммы видны различия в энергии исходных, промежуточных и конечных продуктов. На диаграмме они отвечают тепловым эффектам соответствующихреакций. Делаем вывод, что DH1 = DH2 + DH3.
При изучении темы “Кислород. Оксиды. Горение.” можно использовать понятие плотности веществ, с которыми учащиеся познакомились в 7 классе на уроках физики, а также количество теплоты и теплоты сгорания топлива, изученные уже в 8 классе.
Под плотностью вещества r учащиеся понимают величину, равную соотношению массы тела к его объему
r = m/V, где m – масса вещества, V – объем тела.
По международной системе единиц, масса измеряется в килограммах, а объем – в кубических метрах. Следовательно, плотность имеет обозначение кг/м3.
Изучая тему “Водород. Кислоты. Соли.” можно использовать знания учащихся о подъемной силе газов. Подъемной силой газов (разумеется легче воздуха) называется разность между весом воздуха, объемом 1м3 и весом газа того же объема. Например, воздух объемом 1м3 весит 13H, а вес водорода, объемом 1м3 составляет 0,3H (при н.у.), 1H = 1кг·10м/с2. Следовательно, подъемная сила водорода будет равна 12,1H. Обладая такой подъемной силой, водород объемом 1м3 способен поднять тело массой равной:
12,1 кг·м/с2 : 10 м/с = 1,21 кг.
Межпредметные связи химии и физики могут быть реализованы не только в процессе формирования теоретических, химических понятий, но и при проведении практических работ. Так, при изучении темы “Вода. Основания. Растворы.” учащиеся выполняют практическую работу по приготовлению раствора соли с заданной массовой долей. Для проведения данной работы необходимо взвесить соль. С правилами же взвешивания на рычажных весах учащиеся познакомились на уроках физики в 7 кл.
В качестве примера: 8 кл. “Практическая работа № 4” – приложение 6.
При изучении темы “Периодический закон и периодическая система химических элементов Д.И. Менделеева” можно опереться на знания учащихся о строении атомов, полученные ими на уроках физики в начале 8 класса. На основе изучения схемы опыта Резерфорда учащиеся узнали, что атомы состоят из ядер и вращающихся вокруг них электронов, что ядро массивно и заряжено положительно. По величине этот положительный заряд равен суммарному отрицательному заряду всех электронов, движущихся вокруг ядра. Поэтому атом в целом электронейтрален. На практике мне удалось опробовать данную тему. Надо отметить, что тема сложна, т.к. требует большого пространственного воображения. Для того, чтобы у детей осталось в памяти строение атома, предлагала им следующую схему:
![]()
![]() Атом0
Атом0
ядра я+ электронов e-
![]()
![]() m = 1 m нет
m = 1 m нет
протонов p+ нейтронов n0
В процессе дальнейшего развития представлений о строении атома учащиеся узнают, что основной его характеристикой является заряд ядра, что ядро состоит из протонов и нейтронов и число электронов в атоме равно числу протонов. Все эти знания можно использовать при объяснении физической сущности основных характеристик периодического закона Д.И. Менделеева.
При изучении темы “Химическая связь” могут быть использованы знания учащихся об ионах и их зарядах, о взаимодействии заряженных частиц (тел), электрическом поле.
В курсе физики 7 кл. – начала 8 кл. учащиеся узнают о том, что в результате отрыва электронов от атомов или, наоборот, присоединения электронов к атому образуются ионы. Физики ионом называют заряженный атом, у которого число электронов не соответствует числу протонов. Поэтому на уроках химии учащиеся первое время могут называть ионы заряженными атомами.
При изучении темы “Основные закономерности протекания химических реакций” можно использовать знания учащихся о скорости и равновесии, полученные ими в курсе физики 7 и 8 классов. Под скоростью (средней и мгновенной) учащиеся понимают отношение величины перемещения тела к промежутку времени, в течение которого произошло это перемещение
vср = s/t; vмг = DS/Dt,
где vср – средняя скорость, vмг – мгновенная скорость. Знак D означает небольшое изменение.
Реализация межпредметных связей химии и физики в 8 классе при изучении видов химических связей может быть произведена с целью углубления химических понятий, их формулировки. Рассмотрим возможный пример взаимосвязи двух дисциплин при изучении ионной связи.
Урок начинаем с повторения известного учащимся материала по следующим вопросам: Что называется ионами? По каким свойствам отличаются ионы от атомов? На какие две группы можно разделить ионы по знаку их зарядов?
Затем переходим к объяснению химических явлений, приводящих к появлению ионов.
Похожие работы
... и для поступающих в вузы под редакцией Г.П. Хомченко, И.Г. Хомченко. На изучение этой темы отводится 7 ч [4, 5]. ГЛАВА 3. МЕЖПРЕДМЕТНЫЕ СВЯЗИ ПРИ ИЗУЧЕНИИ III И V ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.МЕНДЕЛЕЕВА 3.1 III-А группа 3.1.1 Бор 3.1.1.1 Распространение в природе Бор никогда не встречается в природе в свободном состоянии, он всегда оказывается связанным с кислородом. В этой ...
... на новые программы и учебники этот вопрос становится наиболее острым. Наша школа перешла на новое учебники О.С. Габриеляна и новую программу, как и большинство школ Заволжского района, поэтому мы представляем календарно-тематическое планирование к курсу "Органическая химия" 10 класс. Тематическое планирование составлено согласно программе разработанной Департамента образовательных программ и ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...
... необходимостью творческого использования имеющихся у них знаний и приобретения недостающей информации) [10,11]. ГЛАВА III. УРОК «ПРАКТИКУМ ПО РЕШЕНИЮ ЗАДАЧ КУРСА ОРГАНИЧЕСКОЙ ХИМИИ С ЭКОЛОГИЧЕСКИМ СОДЕРЖАНИЕМ» Цель. Описывать и объяснять задачи с экологическим содержанием. Оптимальное использование в учебном процессе таких задач позволяет приблизить теоретический материал к жизни, сделать его ...

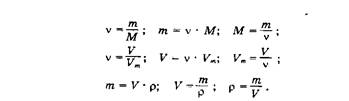

0 комментариев