Навигация
Оксид углерода (IV) – кислотный оксид, ему соответствует двухосновная угольная кислота. Растворение оксида углерода (IV) – обратимая реакция
1. Оксид углерода (IV) – кислотный оксид, ему соответствует двухосновная угольная кислота. Растворение оксида углерода (IV) – обратимая реакция.
H2O + CO2![]() H2CO3
H2CO3
равновесие при комнатной температуре на 99% сдвинуто влево
Углекислый газ не просто растворяется в воде, а частично соединяется с нею, образуя угольную кислоту.
2H2O + CO2![]() H3O+ +
HCO3-
H3O+ +
HCO3-
Однако угольная кислота – соединение крайне непрочное. Она может присутствовать лишь в водном растворе, при всякой же попытке выделить угольную кислоту из раствора она опять разлагается на CO2 и H2O.
H2CO3![]() H+ + HCO3 KaI = 4,45·10-7
H+ + HCO3 KaI = 4,45·10-7
HCO3-![]() H+ + CO3 KaII = 4,69·10-11
H+ + CO3 KaII = 4,69·10-11
2. С сильными основаниями оксида углерода (IV) реагирует с образованием солей угольной кислоты – карбонатов и гидрокарбонатов.
Ca(OH)2 + CO2 ® CaCO3Ї + H2O
CaCO3 + H2O + CO2 ® Ca(HC03)2
3. Углекислый газ – вещество очень прочное, тем не менее при температуре красного каления с кальцием дает карбид и оксид кальция.
2CO2 + 5Ca ® CaC2 + 4CaO
4. Наиболее активные металлы горят в оксиде углерода (IV).
600°C
2Mg + CO2 ® 2MgO + C
5. При высоких температурах восстанавливается в CO с железом, цинком, углем.
3CO2 + 4Fe ® 2Fe2O3 + 3C
CO2 + C ® 2CO
6. С водородом в присутствии никеля при 350-400°C или оксида меди (II) при 200°C восстанавливается в метан.
350-400°C
CO2 + 4H2 ® CH4 + 2H2O
Ni
7. С аммиаком при 600°C дает карбамид.
CO2 + NH3 ® CO(NH2)2
8. С сероуглеродом в присутствии меди дает
CO2 + CS2 ® 2S + 2CO
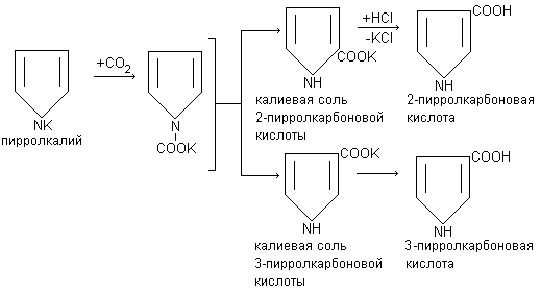
9. Реагирует со многими органическими соединениями, карбоксилируя их. Пиррол, подобно фенолу карбоксилируется оксидом углерода (IV), образуя 2-пирролкарбоновую кислоту, а в более жестких условиях температуры 3-пирролкарбоновую кислоту.
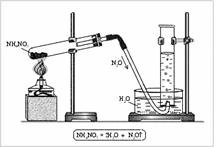
В химических лабораториях либо пользуются готовыми баллонами с жидким угольным ангидридом, либо получают двуокись углерода в аппаратах Киппа действием соляной кислоты на куски мрамора. Пользоваться серной кислотой вместо соляной при этом нельзя, потому что тогда вместо растворимого в воде хлорида кальция получился бы гипс – соль, малорастворимая в воде. Отлагаясь на куски мрамора, гипс крайне затрудняет доступ к ним кислоты и тем самым очень замедляет течение реакции. От примеси паров хлористого водорода двуокись углерода освобождается в промывной склянке с водой, а от паров воды – в следующей склянке с серной кислотой.
В промышленности двуокись углерода получается главным образом как побочный продукт обжига известняка, спиртового брожения.
2.6 Применение углекислого газа
Г.Кавендиш первый обратил внимание на то, что водный раствор двуокиси углерода имеет хотя и слабый, но приятный кислый вкус. Он продемонстрировал в Королевском обществе стакан “чрезвычайно приятно искрящийся (шипучей) воды, едва ли отличной от сельтерской воды” и получил за это открытие золотую медаль общества. Это было первое практическое применение диоксида углерода, им заинтересовались американские предприниматели (когда Д.Пристли находился уже в эмиграции), после того как один доктор стал прописывать карбонизированную воду с добавкой фруктовых соков своим пациентам. Отсюда и стала развиваться промышленность газированных напитков, которая до сих пор является одним из важнейших потребителей углекислого газа.
Диоксид углерода применяют для газирования фруктовых и минеральных вод, для производства сахара, пива, в медицине для углекислых ванн. Его наполняют спасательные пояса и плоты из маленьких стальных баллонов с жидкой массой диоксида углерода. Жидкий угольный ангидрид применяют:
1) в портативных огнетушителях;
2) в огнетушительных системах самолетов и кораблей, пожарных углекислотных машинах.
Такое широкое применение в огнетушении связано с тем, что в некоторых случаях вода не годится для тушения, например, при тушении загоревшихся огнеопасных жидкостей или при наличии в помещении невыключенной электропроводки, уникального оборудования, которое от воды может пострадать.
Применение прессованного твердого угольного ангидрида, который мы называем сухим льдом, тоже достаточно широкое. Так его используют для поддержания низкой температуры в вагонах-холодильниках для транспорта скоропортящихся продуктов, а также при производстве мороженого. Почему, возникает вопрос, нельзя использовать обыкновенный лед. А оказывается сухой лед имеет ряд преимуществ:
1. позволяет поддерживать в холодильнике, роль которого у продавцов мороженого играет простой картонный короб, гораздо более низкую температуру до -78,2°C;
2. поглощает при испарении втрое больше теплоты на единицу массы, чем лед при плавлении;
3. не загрязняет холодильника, как обыкновенный лед, жидким продуктом плавления;
4. создает в холодильнике атмосферу из диоксида углерода, дополнительно предохраняющую пищевые продукты от порчи.
Сухой лед применяют также для охлаждения и отвердевания заклепок из алюминиевых сплавов и при надевании бандажей – металлических колец или поясов на части машин.
Углекислый газ применяется также как теплоноситель в графитовых реакторах.
Очень интересное применение оксида углерода IV для изменения погоды: при рассеивании порошка сухого льда с самолета, пролетающего над переохлажденным облаком, создается искусственный снегопад над аэродромами (при расходе всего примерно 100 г льда на 1 км3 облака). При этом начинают падать густые мокрые хлопья снега, а вскоре сквозь сплошную облачность начинает просвечивать небо. Просветы быстро расширяются и сливаются в широкое синее небо. В результате сильного охлаждения замерзают лишь немногие водяные капельки. Остальные остаются в переохлажденном состоянии. Но так как при одной и той же температуре переохлажденная вода имеет большую упругость пара, чем лед, тотчас начинается нарастание ледяных кристаллов за счет капелек жидкой воды, что и приводит к снегопаду.
Во многих случаях угольный ангидрид используют не в готовом виде, а получают в процессе использования. В таких случаях исходные вещества применяют либо раздельно – как серная кислота и дикарбонат натрия в обычных огнетушителях, либо в виде смеси двух сухих порошков (как в некоторых хлебопекарных порошках), например, смесь бикарбоната натрия с кислым виннокислым калием, виннокислым аммонием или хлоридом аммония. Пока такая смесь остается сухой, реакция не происходит. При добавлении воды соли растворяются, диссоциируют, и возникает ионная реакция с выделением диоксида углерода.
Подобные реакции происходят в результате смешивания хлебопекарных порошков с тестом для разрыхления теста химическим путем, без применения биологических средств – дрожжей и заквасок. В результате тесто “всходит”, наполняясь пузырьками диоксида углерода, и выпеченный из него продукт получается мягким и легче переваривается.
Углекислый газ выступает как инертная атмосфера.
Вот такое широкое применение имеет оксид углерода (IV). Здесь показаны лучшие его качества, но не весь углекислый газ бывает полезен человеку и природе.
2.7 Круговорот углекислого газа в природе
В истории зеленого углерода можно различить несколько этапов. До появления водной оболочки Земли углерод главным образом входил в состав земной атмосферы в виде углекислого газа. Об этом свидетельствует анализ газовых включений в силикатных минералах: кислород в них отсутствует, а содержание углекислого газа достигает 96%. С охлаждением земной коры и появлением жидкой воды, насыщенной углекислым газом, начинается процесс выветривания магматических горных пород, сводящийся в основном к вытеснению кремниевой кислоты из силикатов угольной кислотой, как кислотой более сильной. Нерастворимые продукты разрушения горных пород в виде рыхлых масс остаются на листе, а растворимые соли, в том числе дикарбонаты, увлекаются в мировой океан. Таким образом создается необходимое сочетание условий для возникновения растительной живой материи: углекислый газ, жидкая вода и растворенные в ней соли.
В мировом океане зародилась жизнь; это начало нового этапа в геохимической жизни углерода. В результате основного процесса жизнедеятельности растений – фотосинтеза – углерод из атмосферы переходит в состав живой массы биосферы, и состав атмосферы постепенно изменяется, углекислый газ в ней сменяется кислородом. Таким образом возникают необходимые предпосылки к возникновению животной жизни: свободный кислород и накопленные растениями органические вещества.
Рисунок сводит отдельные, рассмотренные выше превращения углекислого газа в природе в единую цельную картину.
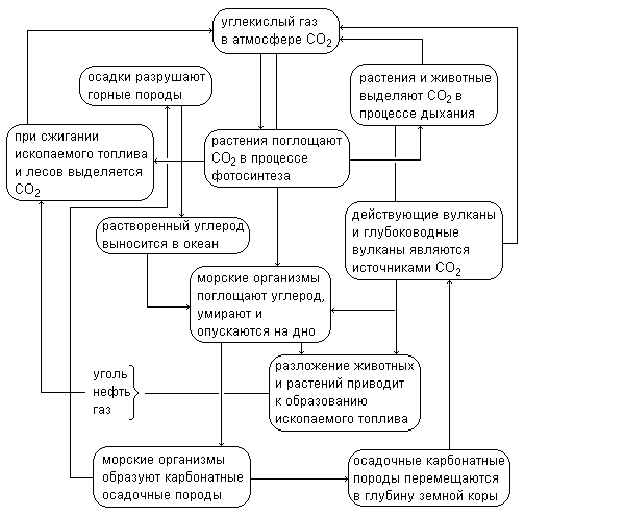
Углекислый газ используется в процессе фотосинтеза для образования органических веществ. Именно благодаря этому процессу замыкается круговорот углерода в биосфере. Как и кислород, углерод входит в состав почв, растений, животных, участвует в многообразных механизмах круговорота веществ в природе. Содержание углекислого газа в воздухе, который мы вдыхаем, примерно одинаково в различных районах планеты. Исключение составляют крупные города, в которых содержание этого газа в воздухе бывает выше нормы.
Некоторые колебания содержания углекислого газа в воздухе местности зависят от времени суток, сезона года, биомассы растительности. В то же время исследования показывают, что с начала века среднее содержание диоксида углерода в атмосфере, хотя и медленно, но постоянно увеличивается. Ученые связывают этот процесс главным образом с деятельностью человека.
Как и каждый химический элемент, углерод в земной коре находится в постоянном движении, преобразовании из одной химической формы соединений в другую; эти изменения замыкаются в целую систему взаимно переплетающихся циклов. Исходя из одной определенной формы существования углерода, например из CO2, и последовательно прослеживая его преобразования мы вновь возвратимся в исходную точку – в CO2.
В минеральной природе главными генераторами углекислого газа являются вулканы, не только действующие, но и давно потухшие; вулканические местности изобилуют выделяющимися из под земли струями углекислого газа и ключами, постоянно выбрасывающими CO2 из земных недр в виде раствора, насыщенного углекислым газом (нередко под большим давлением).
В минеральной природе диоксид углерода расходуется процессами выветривания. Это крайне медленные химические реакции; мы непосредственно не можем проследить их течение. Но, встречая на поверхности земли полуразрушенные выветриванием глубинные породы, например гранит в окружении продуктов его разрушения – песка и глины, мы легко можем мысленно воссоздать процесс разрушения, всякий раз необходимым участником агрессии, постигшей изверженную породу, окажется углекислый газ. Таким образом, с точки зрения геохимии углерода, процессы выветривания – это процессы связывания углекислого газа. Именно углекислый газ является главным деятелем процессов выветривания, а так как они идут повсеместно, и охватывают неизмеримо большие массы минеральной материи, диоксид углерода извлекается ими из атмосферы в настолько больших количествах, что по расчетам геологов, углекислого газа, содержащегося в данный момент в атмосфере, хватило бы на процессы выветривания не больше чем на 18000 лет.
Масштабы процессов, пополняющих атмосферу углекислым газом и расходующих его, представляются в современную эпоху существования земного шара таблицей:
Масштабы круговорота угольного ангидрида (в млрд. т в год).
| Поступление в атмосферу | Уход из атмосферы |
| Из океанов 200 | В океаны 200 |
| Дыхание и гниение 60 | Фотосинтез 60 |
| Горячие источники и вулканы 0,1 | Выветривание 0,1 |
| Сжигание топлива 6 | |
| Освоение целинных земель 2 |
Из таблицы видно, что в природе образование и расходование углекислого газа сбалансированное. Но деятельность человека нарушает баланс. Сопоставление анализов воздуха на протяжении последних 100 лет обнаруживает постепенное накопление диоксида углерода в атмосфере. С этим предположительно связывают некоторое смягчение климата на земном шаре.
Круговорот углерода представляется нам движением по замкнутому кругу, однако в рамках сравнительно ограниченного геологического срока; если же рассматривать историю углерода в целом, начиная с возникновения его первых простейших соединений и кончая зарождением, постепенным усложнением и усовершенствованием органической материи, легко убедиться, что в действительности круговорот углерода не простое повторение пройденного, а движение поступательное, по восходящей линии, развитие от простого к сложному, от низшего к высшему. Это относится и к круговороту всех других элементов, образующих земной шар.
2.8 Гигиенические нормативы предельно допустимой концентрации (ПДК)
Оказывается, у людей появляется привыкание к углекислому газу. Но существует в странах мира ПДК углекислого газа в атмосфере. К сожалению у нас в России ПДК в воздухе рабочей зоны не установлена, в США – 9000 мг/м3. В угольных и озокеритовых шахтах разрешается содержание углекислого газа до 0,5%. По данным Елисеевой, в жилых и общественных зданиях среднесуточная концентрация не должна превышать 0,05% углекислого газа, а кратковременная (разовая) – 0,01%.
4
Содержание
Введение......................................................................................................................4
Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5
1.1 Использование межпредметных связей для формирования у учащихся основ диалектико-материалистического мировоззрения....................................7
1.2 Пути и методы реализации межпредметных связей......................................11
1.3 Межпредметные связи в процессе изучения химии в 9 классе.....................13
1.4 О связи обучения химии и географии..............................................................16
1.5 Межпредметные связи неорганической, органической химий и физики.........................................................................................................................18
1.6 Межпредметные связи при проблемном обучении химии............................27
1.7 Межпредметные связи при решении расчетных задач..................................33
Глава 2. Химия элемента углерода и его соединений.........................................37
2.1 История открытия углекислого газа...............................................................37
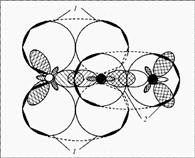
2.2 Строение молекулы углекислого газа.............................................................40
2.2.1 С позиции валентных связей..........................................................................40
2.2.2 С позиции МЛКАО.........................................................................................42
2.3 Физические свойства углекислого газа...........................................................46
2.4 Химические свойства углекислого газа..........................................................47
2.5 Получение углекислого газа.............................................................................49
2.6 Применение углекислого газа...........................................................................50
2.7 Круговорот углекислого газа в природе.........................................................53
2.8 Гигиенические нормативы предельно допустимой концентрации (ПДК)..........................................................................................................................58
Глава 3. Роль соединений углерода в природе.....................................................59
3.1 Роль углекислого газа в создании парникового эффекта.Углекислый газ и парниковый эффект..................................................................................................59
3.2 Основные загрязнители атмосферы.................................................................69
3.2.1 Природные источники....................................................................................69
3.2.2 Авиация.............................................................................................................70
3.2.3 Машиностроительное предприятие..............................................................73
3.2.4 ТЭС....................................................................................................................74
3.2.5 Транспорт.........................................................................................................74
3.3 Борьба с выбросами углекислого газа и их учет...........................................75
3.4 Океаническая вода как пожиратель углекислого газа.................................78
3.5 Неравномерное потребление углекислоты наземными системами.............81
3.6 Выводы.................................................................................................................85
Заключение................................................................................................................89
Библиография
Приложения
91
Заключение
В ходе работы удалось проследить взаимосвязь между школьными предметами: химией, географией, физикой, биологией, математикой. Ознакомилась с методами и путями реализации МПС и опробовала на педагогической практике. Чаще всего удавалось использовать фрагментарный метод, реже узловой. На уроках повторения и обобщения темы – наиболее эффективным является синтезированный метод, с помощью его осуществляются связи межпредметные (МП) и внутрипредметные (ВП). При использовании методов вводила различные средства реализации (вопросы МП характера, МП задачи, домашние задания, наглядные пособия, химический эксперимент). Все это давало неплохой результат, у учащихся возрастает интерес к предметам. Необходимо использовать МПС на всех уроках, научить самостоятельно находить МПС, использовать уже полученные знания. Для удобства учителю необходимо иметь тематическое планирование, где заранее обработаны все учебные пособия, дополнительная литература, указаны МПС, составлены задания для учащихся.
В главе: “Химия элемента углерода и его соединений” рассмотрены вопросы по происхождению углекислого газа, рассмотрены его физические и химические свойства. Углекислый газ имеет широкое применение во всех сферах жизни человека. Проведен химический эксперимент по определению молярной массы углекислого газа, который получали, используя несколько методик. Наилучшего результата, т. е. наименьшей относительной ошибки удалось достичь при разложении гидрокарбоната натрия – 0,31%, при разложении малахита – 1,24%, при традиционном методе взаимодействия мрамора с HCl – 1,5%. Был проведен опыт и по декарбоксилированию лимонной кислоты – Cu – Kat – 3,7%. По полученным данным построена столбиковая диаграмма.
При написании географической главы использовалось огромное количество источников, изучением глобальных проблем, в частности, проблемой парникового эффекта занимается немало ученых. По статистическим данным были построены круговые и столбиковые диаграммы. Сделаны следующие выводы: главными загрязнителями углекислым газом атмосферы являются: ТЭС, авиация, машиностроительные предприятия, транспорт, вулканы и другие мофеты. По количеству углекислого газа на душу населения 1 место у развитых капиталистических стран. Это связано с высоким экономическим развитием стран, мощной ТЭ базой, отлично развитым м/с комплексом, транспортом.
По ходу работы были использованы следующие методы: картографический, статистический, анализ научной и научно-популярной литературы, исследовательский. В работе задействовано более 40 источников.
94
Глава 3. Роль соединений углерода в природе
Не то, что мните вы, природа:
Не слепок, не бездушный лик –
В ней есть душа, в ней есть свобода,
В ней есть любовь, в ней есть язык.
Ф.И. Тютчев
В современных условиях, когда в мире интенсивно развивается промышленность, сельское хозяйство и резко возрастает потребление природных энергетических ресурсов, природа не выдержала хамского, беспощадного отношения к ней и закричала. Закричала так, что похоже услышала все сразу. В своей работе я хочу рассмотреть причины одной из “слезинок” природы, ее характер и способы стирания ее с лица природы.
Итак, человечество встало перед проблемой изменения климата планеты из-за, так называемого, “парникового эффекта”.
3.1 Роль углекислого газа в создании ”парникового эффекта”. Углекислый газ и парниковый эффект.
Что же такое “парниковый эффект”? Существует несколько точек зрения на определение “парникового эффекта”. Рассмотрим некоторые из них. Так, доктор геолого-минеральных наук, профессор В.А. Красилов дает следующее определение:
“Парниковый эффект – разогревание нижних слоев атмосферы – возникает в результате поглощения части теплового излучения поверхности Земли молекулами углекислого газа, водяного пара, метана, хлорфторуглеродов и некоторых других газов.”
И определение, данное в экологическом словаре в учебнике “Экология России”:
“Парниковый эффект – потепление климата на Земле в результате повышения содержания в приземном слое атмосферы углекислого газа, метана, пыли. Смесь пыли и газов действует, как полиэтиленовая пленка над парником: хорошо пропускает солнечный свет, идущий к поверхности почвы, но задерживает рассеиваемое почвой тепло, в результате под пленкой создается теплый микроклимат.”
Однажды на обложке популярного западногерманского журнала “Шпигель” был изображен знаменитый Кельнский собор, со всех сторон окруженный водой. При этом то была не рейнская вода, а морская – итог предсказываемого потепления Земли, попытка наглядно изобразить возможные итоги климатических изменений.
Действительно, некоторые явления последних лет заставляют задуматься: а не началось ли уже это потепление? 1988 год побил все рекорды климатических “ненормальностей”, а целых пять лет в 80-х годах были самыми теплыми за все уходящее столетие. В 1988 году впервые за много десятилетий жара в Нью-Йорке не спадала сорок дней, ртутный столбик не спускался ниже 31°C. Небывалая жара была и в Лос-Анджелесе, но ей предшествовал февраль – необычная для Калифорнии волна холода. Осенью того же года страшный ураган в Карибском море лишил крова 500 тыс. человек только на Ямайке. Суровая засуха летом того же года в США привела к тому, что сбор зерна впервые упал ниже его потребления, экспорт его шел только за счет старых запасов, урожайность зерновых в этом году упала на 1/3 – небывалое в истории устойчивого земледелия США явления. К этому следует добавить, что в том же году 2/3 территории Бангладеш было затоплено в итоге затяжных муссонных дождей, наводнение оставило без крова 25 млн. человек (почти 1/4 населения этой страны). А в Антарктиде от огромного ледового шита шестого континента откололся гигантский айсберг длиной 130 км – предвестник и символ грозящего потепления. Жарко было в эти “ненормальные” годы и в Европе. Директор одного из институтов НАСА (США) предупредил тогда: “Очень вероятно, что тепличный эффект уже действует”.
“Парниковый эффект” или “гринхауз-эффект”.
Миллиарды тонн углекислого газа ежечасно поступают в атмосферу в результате сжигания угля и нефти, природного газа и дров, миллионы тонн метана поднимаются в атмосферу от разработок газа, с рисовых полей Азии (газы полей орошения, образующиеся при гниении органических веществ под действием метанообразующих бактерий в условиях ограниченного доступа воздуха, водяного пара). Все это – “парниковые газы”.
Как видим, в обоих определениях указан главный источник беды – углекислый газ. Не считая выбросов, в атмосфере Земли находится 2,3·1012 т диоксида углерода. Где же может располагаться “природный” и “антропогенный” CO2? Оказывается основные резервуары CO2 – стратосфера и тропосфера, где CO2 равномерно распределен до высоты 7 км, а также глубинные слои океана; временный резервуар – биосфера. В стратосферу в год поступает 2,5·1016 т CO2, в тропосферу – 3,1·1016 т, в перемешиваемый слой океана – 2,0·1016 т. Время задержки в этих резервуарах 40 лет, 2 года и 1 год соответственно.
Из курса биологии мы знаем, что CO2 является источником питания растений – играет огромную роль в фотосинтезе. Так и пусть его будет много. Кругом будет благоухать флора. Так нет, все ученые мира требуют снижения выбросов в атмосферу диоксида углерода. Почему?! По своей химической устойчивости диоксид углерода, в отличие от других газов-загрязнителей, более устойчив в атмосфере, он поглощается гидросферой, расходуется на фотосинтез и выветривание силикатных пород, на постройку кораллов, однако эти регуляторы не могут справиться с техногенными выбросами. Накопление CO2 в атмосфере приведет к потеплению, которому будут сопутствовать таяние полярных льдов, подъем уровня мирового океана, затопление густонаселенных приморских низменностей и целых островных государств, опустынивание, иссушение основных сельскохозяйственных районов Северного полушария. Такого рода опасения были существенно подкреплены обнародованным в 1990 году докладом первой рабочей группы Международного пленума по климатическим изменениям, составленным 170 авторитетными специалистами из 25 стран (и еще 200 ученых были привлечены к рецензированию доклада). По их единодушному мнению парниковый эффект уже дал потепление на 0,3-0,6°С (0,5°C) в конце 19 века. Удвоение содержания CO2 в атмосфере произойдет в 2035 г. Соответствующее глобальное потепление составит по разным оценкам от 1,5°C до 4,5°C, а, скорее всего, около 2,5°C. К этому времени ожидается подъем уровня моря от 8 см до 29 см (около 20 см) и до 65 см к 2100 г. На обширных пространствах Евразии и Северной Америки, включая основные житницы, установится летне-сухой климат.
Обнаружена тесная связь между концентрацией CO2 и температурами в экваториальной области. Оба показателя возрастают и снижаются согласованно, причем изменения концентрации CO2, активно участвующей в создании парникового эффекта, на несколько месяцев отстает от потеплений и похолоданий тропических морей. Отсюда следует, что либо первопричиной краткосрочных вариаций содержания CO2 являются изменения температуры, либо оба явления подвержены влиянию неизвестного метеорологического фактора.
Обнаруженная связь двух параметров подтверждает давно высказанную идею, согласно которой рост температур должен приводить к тому, что поверхность суши и океана отдает часть накопленной ими CO2, что, в свою очередь, способствует новому потеплению.
Научное прогнозирование предполагает ряд наблюдений, исторический материал, на основе которого можно выявить те или иные закономерности. В отличие от него обиходный прогноз представляет собой простую картину в будущее, перенесение современной ситуации вперед. Так, эпизодическое падение уровня Каспия до середины 70-х годов побудило лиц, принимающих решение, перенести предприятия ближе к побережью в ожидании еще большего падения в будущем. В результате современный подъем Каспия привел к много миллиардному ущербу.
Парниковая модель климатических изменений, принимающая в качестве точки отсчета начало нынешнего века и предсказывающая современный уровень техногенного воздействия на атмосферу без учета других факторов, относится к прогнозам последнего типа. В отличие от нее, модели, опирающиеся на исторический материал, прогнозируют природные процессы, которым противостоять невозможно. К ним можно лишь приспособиться ценой больших или меньших потерь.
Урок Каспия показывает, что хозяйственная система, не приспособленная к изменениям природной среды, терпит ущерб не только от негативных, но и от потенциально позитивных изменений, которые она не способна оперативно использовать. Повышение уровня моря могло бы помочь восстановлению утраченных нерестилищ. Потепление позволило бы сократить энергозатраты и повысить продуктивность зерновых. В действительности же любое изменение оборачивается катастрофой. Оптимальная стратегия, по-видимому, заключается не в стремлении любой ценой сохранить status guo, а в адаптации хозяйственной системы к циклическим природным процессам, которые можно прогнозировать на основе исторических данных.
Известно, что в прошлом климат существенно отличался от современного и что природные климатические колебания происходили с определенной периодичностью, проявляющейся, в частности, как чередование ледниковых и межледниковых эпох. Последний ледниковый максимум датирован 18 тыс. лет назад, а мы живем в условиях межледниковья, начавшегося около 11 тыс. лет назад. На фоне этой периодичности происходят относительно кратковременные колебания, подобные малому климатическому оптимуму 1000 лет назад, малому ледниковому периоду 200-250 тыс. лет назад, и еще более мелкие вплоть до 4-5 и 2-х летних циклов. Это исторический материал, позволяющий прогнозировать аналогичные (хотя и не вполне идентичные) колебания в будущем. Точность прогноза зависит от качества информации о климатах прошлого, которое, как было признано на совещании “Климаты прошлого и климатический прогноз” (Москва, институт охраны природы и заповедного дела, 1992 г.), во многих случаях оставляет желать лучшего.
Техногенные воздействия происходят не на статическом, а на динамическом фоне природных процессов. Около 1000 лет назад климат был теплее на 0,5°C. Есть ли основания приписывать современное потепление того же масштаба техногенным газам? По-видимому, нет, так как 40-60 годы, первый этап массовых выбросов CO2 ознаменовались заметным похолоданием. Резко возросшие техногенные выбросы 80-х по сверхточным спутниковым измерениям за десятилетие (1979-1988 гг.) не дали парникового эффекта.
Модели парникового потепления, решая уравнения с множеством неизвестных, не принимают в расчет обратных связей между потеплением и реакцией планетарных систем атмосферы, биосферы и гидросферы – изменения облачности, продуктивности растительных сообществ, циркуляции биологических вод.
Недавно обнаружена несомненная связь между содержанием CO2 в атмосфере и распространением аномально теплых поверхностных вод в Тихом океане, названное Эль-Ниньо, происходящим с периодичностью в 4-5 лет и вызывающим аномальные климатические явления – теплые зимы на Аляске, засухи в Африке – практически по всему шару. Оказалось, что в начале Эль-Ниньо концентрация CO2 уменьшается, а затем увеличивается, превышая техногенную добавку. Спад CO2 можно объяснить подавлением апвеллинга – подъема холодных глубинных вод, выделяющих CO2 в атмосферу, а пик – уменьшением растворимости CO2 при повышении температуры (альтернативный биологический механизм, предполагаемый Дж. Килингом и другими авторами, маловероятен, так как временной интервал колебаний CO2 недостаточен для ощутимой реакции биосферы).
Дальнейшим подтверждением роли океанической циркуляции как основного регулятора содержания CO2 в атмосфере явились ряды наблюдений, показывающих не только хорошую корреляцию CO2 с температурой, но и запаздывание колебаний CO2 на 4 месяца по отношению к температуре поверхностных вод и на 1 месяц по отношению к температуре воздуха. Становится еще более очевидным, что в системе “CO2 – температура” ведущий фактор – температура, а не CO2 и что происходящее увеличение концентрации CO2 (включая техногенный источник) объясняется потеплением, а не наоборот. Эти данные не только вносят существенные коррективы в традиционные представления о роли океана в регуляции газового состава и поддержании теплового баланса атмосферы, но и приближают нас к общему объяснению климатических колебаний. Эль-Ниньо связаны с кратковременными изменениями скорости вращения Земли в результате гравитационных воздействий других небесных тел, которые служат пусковым механизмом волновых процессов в земных оболочках, включая Мировой океан и биосферу.
Известно, что в смене климатических ситуаций ледникового периода выражены циклы прецессий, наклона эклиптики и эксцентриситета земной орбиты. Содержание CO2 в атмосфере геологического прошлого по пузырькам воздуха в льдах Антарктиды, проверенных на станции Восток, коррелирует с температурой ледниковых и межледниковых эпох. Эти данные были использованы для подтверждения парниковой модели. Однако и здесь возникает вопрос о причинах и следствиях. Поскольку техногенного источника не было, то остается биосфера, продуктивность которой в межледниковье возрастала (сток, а не приток CO2), и океан, повышение температуры которого, по-видимому и было основным источником CO2.
Среди более отдаленных геологических периодов определенный интерес представляет меловой – 130 – 65 млн. лет назад. Постоянных полярных льдов в меловом периоде не было (хотя могли быть сезонные). Составленные фитоклиматические схемы дают представления о климатической зональности безледниковой планеты и позволяют сделать некоторые выводы прогнозного характера. Экваториальная зона примерно в современных границах отличалась сухостью и температурой ниже современной (крайний ксероморфизм растений, хвойные в низинных растительных формациях).
Область преимущественного распространения жестколистных кустарниковых формаций, интерпретируемая как зона летне-сухого климата, простиралась до 50° с. ш. в Азии, и на западе Северной Америки. На атлантическом побережье ее северная граница поднималась до 60°. Данные по годичным кольцам прироста древесины и склеритам на чешуе рыб указывают на непродолжительный сухой сезон. Вместе с тем, к этой зоне приурочены самые крупные захоронения меловых динозавров, свидетельствующие о высокой продуктивности жестколистной растительности.
Зона листопадных лесов простиралась далеко за полярный круг, по крайней мере до 80°с. ш. В ее пределах намечалась незначительная дифференциация по содержанию теплолюбивых компонентов, причем на полярных широтах снова возрастала роль вечнозеленных растений и, судя по количеству месторождений, численности динозавров, остатки которых известны на Шпицбергене, северной Камчатке, северном склоне Аляски.
По общей продуктивности меловая растительность едва ли существенно отличалась от современной, так как слабая облесенность экваториальной зоны могла компенсироваться полярными лесами. Вместе с тем мощный вулканизм мелового периода, в десятки раз превышавший современную вулканическую активность, служил источником парниковых газов, не уступавшим техногенному.
Таким образом, мы подошли ко второму разделу, доказав, что в создании парникового эффекта играют роль как природные так и антропогенные источники.
3.2 Основные загрязнители атмосферы 3.2.1 природные источникиПри извержениях вулканов вместе с лавой из них изливается и углекислый газ в таком изобилии, что после одного извержения Везувия им было задушено тысячи зайцев и других маленьких животных. В то же время колодцы и погреба в Неаполе, далеко отстоящем от вулкана оказались наполненными углекислым газом. Углекислый газ постоянно выделяется сильными струями из почвы даже в таких местностях, где вулканическая деятельность давно прекратилась.
Сколько столетий функционирует в качестве постоянно действующего генератора углекислого газа неаполитанская “Собачья пещера”, без упоминания о которой не обходился ни один учебник химии и географии, вряд ли можно определить это; “чудо природы” упоминалось не только Ван-Гельмгольтом, но и в “Естественной истории” Плиния, созданной в начале нашей эры. Такие же пещеры существуют в Иеллоустонском заповеднике (США). Птицы и насекомые, залетающие в них в поисках убежища, гибнут. Громадные количества углекислого газа доставляются из недр Земли в атмосферу и ключами, изливающимися в местностях, где действуют или когда-то действовали вулканы.
Природные источники углекислого газа называются мофетами. Мофеты характерны для последней, поздней стадии затухания вулканов, в которой находится в частности знаменитый кавказский вулкан Эльбрус. Поэтому там наблюдаются многочисленные выходы пробивающихся сквозь снега и льды горячих источников, насыщенных углекислым газом. Наиболее известные из минеральных источников (углекислотных) находятся в Кисловодске (Назран), где они используются в лечебных целях (лечение желудочно-кишечного тракта).
Вне земного шара углекислый газ обнаружен спектроскопическим путем в атмосфере Венеры. Атмосфера ближайшей к Земле планеты лишена кислорода и водяных паров и полностью состоит из углекислого газа. При атмосферном давлении, составляющем около половины давления, господствующего на нашей планете, и средней температуре около 70°C Венера являет нам, примерный вид Земли, какой она была до появления на ней растительного покрова.
3.2.2 авиацияГруппа Л. Майкелис – управление энергетических технологий, Харуэлл, Великобритания (ж. “Природа” № 2, 1993г.) пересмотрела выводы о поступлении парниковых газов в атмосферу, сделанные в 1990 году Межправительственной комиссией по изменению климата.
По их мнению: самолеты способствуют парниковому эффекту в восемь раз сильнее автомашин и в 22 раза больше, чем междугородний электрический железнодорожный транспорт. На каждое пассажирское место в самолете “приходится” 684 грамма углекислого газа на 1 км проделанного пути, на одного пассажира легковой машины, прошедшего то же расстояние – лишь 83 грамма, а скоростного электропоезда – 31 грамм. Так из таб. 1 видно, сколько выбрасывается углекислого газа в двигателях космического корабля “Шаттл” за 1 полет.
| продукты сгорания, кг | высота приземного пограничного слоя | тропосфера | стратосфера |
| CO2 | 0 – 0,5 | 0,5 – 1,3 | 13 – 50 |
| 55075 | 172570 | 147684 |
Таблица 1, Количество углекислого газа в слоях атмосферы.
Особое беспокойство вызывает большое оксидов азота, выделяемых авиадвигателями во время полетов на высоте 10-12 км. Подвергаясь там фотохимическим реакциям, этот газ образует озон, порождающий парниковый эффект. На уровне Земли 1 грамм газа по воздействию втрое превосходит то же количество углекислого газа, а в верхних слоях атмосферы в 335 раз больше. В первую очередь это связано с более низкими температурами верхней атмосферы, замедляющими химические реакции и тем самым парниковое воздействие таких, как озон, газов со сравнительно коротким сроком “жизни”.
Выбросы оксидов азота ответственны примерно за 2/3 всех поставляемых самолетом парниковых газов; остальные на “совести” углекислого газа. Наибольшее воздействие на температуру Земли, имеет озон, находящийся на высоте около 12 км, где проходит основная часть самолетов.
Таким образом, хотя самолеты в Европе производят видимо, не более 3% выброса оксидов азота, их вклад в парниковый эффект равен вкладу всех иных источников этого газа. Проблема усугубляется быстрым ростом авиасообщений: количество самолетов, садящихся или взлетающих, например, в аэропортах Великобритании, за последние 20 лет удвоилось.
Но проблему уже пытаются решать. Как известно, основная часть оксидов азота авиапроисхождения образуется в двигателе при температуре 1700°C. Ведущая авиастроительная компания “Роллс-Ройс” (Великобритания) начала разрабатывать двигатель, сжигающий топливо в несколько этапов – без высоких температур, но с прежней эффективностью.
До сих пор авиаконструкторы, повышая эффективность в расходовании горючего, шли по пути увеличения давления и температур, в результате выброс углекислого газа сократился, но возросло поступление в атмосферу оксидов азота. По оценкам специалистов, полная смена концепций и налаживания выпуска экологически чистых самолетов потребует не только больших затрат, но и длительного времени.
3.2.3 машиностроительное предприятие
Современное машиностроение развивается на базе крупных производственных объединений, включающих заготовительные и кузнечно-прессовые цехи, цехи термической и механической обработки металлов, цехи покрытий и крупное литейное производство.
Наиболее крупными источниками пыле- и газовыделения в атмосферу в литейных цехах являются вагранки, печи, участки складирования и переработки шихты.
Газовыделения углекислого газа при заливке металлом форм и их охлаждении можно определить по данной таблице 2.
вещество | удельные газовыделения для марки связующего вещества мг/кг смеси·час | ||
| ОФ - 1 | БС - 40 | УКС | |
| диоксид углерода CO2 | 688 | 3260,0 | 8563,0 |
| для сравнения оксид углерода CO | 920,0 | 496,0 | 1921,0 |
Примечание:
Похожие работы
... и для поступающих в вузы под редакцией Г.П. Хомченко, И.Г. Хомченко. На изучение этой темы отводится 7 ч [4, 5]. ГЛАВА 3. МЕЖПРЕДМЕТНЫЕ СВЯЗИ ПРИ ИЗУЧЕНИИ III И V ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.МЕНДЕЛЕЕВА 3.1 III-А группа 3.1.1 Бор 3.1.1.1 Распространение в природе Бор никогда не встречается в природе в свободном состоянии, он всегда оказывается связанным с кислородом. В этой ...
... на новые программы и учебники этот вопрос становится наиболее острым. Наша школа перешла на новое учебники О.С. Габриеляна и новую программу, как и большинство школ Заволжского района, поэтому мы представляем календарно-тематическое планирование к курсу "Органическая химия" 10 класс. Тематическое планирование составлено согласно программе разработанной Департамента образовательных программ и ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...
... необходимостью творческого использования имеющихся у них знаний и приобретения недостающей информации) [10,11]. ГЛАВА III. УРОК «ПРАКТИКУМ ПО РЕШЕНИЮ ЗАДАЧ КУРСА ОРГАНИЧЕСКОЙ ХИМИИ С ЭКОЛОГИЧЕСКИМ СОДЕРЖАНИЕМ» Цель. Описывать и объяснять задачи с экологическим содержанием. Оптимальное использование в учебном процессе таких задач позволяет приблизить теоретический материал к жизни, сделать его ...


0 комментариев