А. Ф. Бровкина, А. Г. Амирян, В. Г. Лелюк
Московский НИИ глазных болезней им. Гельмгольца МЗ РФ
ГНЦ - Институт биофизики
Гемангиома – редкая врожденная опухоль – относится к порокам развития (гамартомам) и составляет 0,76% от удаленных внутриглазных опухолей [6]. Мужчины и женщины заболевают одинаково часто. Их возраст колеблется от 10 до 60 лет, средний составляет 35,2 года [1, 2].
Опухоль развивается очень медленно, длительно протекает бессимптомно [1, 2, 4, 5]. При локализации в заднем полюсе глаза снижение зрения является первой причиной обращения пациентов к офтальмологу.
По своему характеру роста гемангиома хориоидеи может быть представлена одиночным узлом (отграниченная гемангиома), но может иметь и диффузное распространение. Последняя, как правило, сопровождает синдром Стюрж–Вебера [1, 2, 4, 16, 19].
Ранее диагноз отграниченной гемангиомы хориоидеи считался для глаза фатальным в результате появления тотальной отслойки сетчатки. В исходе возникала вторичная глаукома. В 70–80 гг. была попытка использовать лазеркоагуляцию для локализации «роста» гемангиомы и ее разрушения [3]. Однако полной регрессии опухоли достичь не удалось: в большинстве случаев продолжалась прогрессия отслойки сетчатки. В последние годы, как свидетельствуют данные литературы, эффективными оказались брахитерапия и наружное облучение глаза (при диффузной гемангиоме). Облучение приводит к резорбции субретинальной жидкости, уменьшению и локализации экссудата.
В связи с возможностью локального разрушения гемангиомы стало актуальным раннее ее выявление. Офтальмоскопически диагностика гемангиомы сложна, ее часто приходится дифференцировать с увеальной меланомой и метастатическими поражениями хориоидеи, в то же время от точного диагноза зависит выбор тактики лечения больного и оценки прогноза для жизни [1, 2, 3, 10, 16, 18]. Клинико–инструментальные методы исследования не всегда доказательны. Наиболее информативна ангиография – флюоресцентная и с индоцианин зеленым [1, 7, 8, 9, 11, 14, 15, 17, 18].
При ультразвуковом сканировании, которое широко применяется для диагностики внутриглазных опухолей, выделены эхографические признаки гемангиомы хориоидеи. К ним можно отнести проминирующий очаг повышенной эхогенности и отсутствие «экскавации» хориоидеи, столь характерной для увеальной меланомы [1]. Однако они относительны. Характерные для гемангиомы кровеносные сосуды при УЗ–сканировании не выявляются. Определенные надежды возлагали на дуплексное сканирование, сочетающее в себе элементы УЗ–сканирования (В–метод), цветового допплеровского кодирования (ЦДК) и спектрального допплеровского анализа, позволяющее получить информацию о кровотоке в сосудах глаза и в новообразованных сосудах опухоли в режиме реального времени. Тем не менее, данные литературы о диагностических возможностях дуплексного сканирования при отграниченной гемангиоме хориоидеи не многочисленны и противоречивы. В основном они принадлежат зарубежным авторам [11, 13, 16, 20, 21]. В отечественной литературе имеется публикация, в которой представлена только описательная картина ЦДК гемангиомы [4]. Располагая наблюдениями над 9 больными с гемангиомой хориоидеи, мы поставили перед собой задачу изучить особенности гемодинамики отграниченных гемангиом хориоидеи методом дуплексного сканирования.
Материалы и методы
Нами обследовано 9 пациентов (9 глаз) с отграниченной гемангиомой хориоидеи. Возраст больных – от 18 до 67 лет (средний – 44,7), женщин – 5, мужчин– 4. В 5 случаях диагноз отграниченной гемангиомы хориоидеи подтвержден флюоресцентной ангиографией (ФАГ), в 1 случае ФАГ не проведена из–за недостаточной прозрачности оптических сред, а в остальных случаях – из–за индивидуальной чувствительности к флюоресцеину. В этих случаях диагноз ставился на основании клинической картины, УЗ – сканирования и длительно существующего анамнеза.
Дуплексное сканирование с цветовым доплеровским кодированием и спектральным допплеровским анализом проводили на многофункциональном ультразвуковом сканере Acuson–Sequoia–512 линейным датчиком 15L8 с частотой сканирования 14–8 МГц, работающим в режиме реального времени (рис. 1). Сканирование проводили транспальпебрально в положении больного лежа с использованием обычного геля для УЗ–исследований.

Рис. 1. Общий вид ультразвукового сканера
На первом этапе проводили сканирование в режиме серой шкалы, оценивая при этом локализацию опухоли, топометрию, характер контура опухоли, эхогенность, наличие или отсутствие сопутствующей отслойки сетчатки.
В режиме ЦДК с помощью цветовых картограмм потоков визуализировали собственные сосуды опухоли, изучали их ангиоархитектонику. С помощью спектрального допплеровского анализа регистрировали показатели кровотока в собственных сосудах образования, центральной артерии и вене сетчатки (ЦАС, ЦВС), задних циллиарных артериях (ЗЦА). Контролем являлись гемодинамические параметры в ЦАС, ЦВС и ЗЦА здоровой стороны.
Результаты и их обсуждение
Располагаясь в центральной зоне, гемангиома почти в 2/3 случаях поражает макулярную и парамакулярную области. Юкстапапиллярное расположение гемангиомы, по нашим данным, встречается у 1/3 больных (рис. 2).
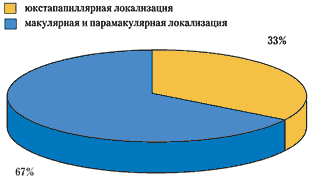
Рис. 2. Распределение больных с учетом локализации
С учетом локализации опухоли ранним признаком ее, заставившей больных обратиться к офтальмологу, практически во всех случаях явилось снижение зрения. К моменту обследования гемангиома имела толщину, равную в среднем 3±0,7 мм (от 1,6 до 3,9 мм), а основание ее достигало в среднем 8,9±3,2 мм (от 3,8 до 13,5). Во всех случаях имелась вторичная отслойка сетчатки (в 6 случаях плоская, в 3–х – высокая).
При УЗ–сканировании у всех больных определялся проминирующий гиперэхогенный очаг без «экскавации» хориоидеи с ровной поверхностью.
При исследовании в режиме ЦДК во всех случаях, независимо от размеров отграниченной гемангиомы, выявлено равномерное распределение новообразованных сосудов по всей ее толщине и площади. Визуально кровоснабжение гемангиомы осуществляется за счет сосудов хориоидеи: сосуды сетчатки не участвуют в ее питании (рис. 3, 4) Только при юкстапапиллярной локализации (3 случая) опухоль получала двойное кровоснабжение – за счет сосудов хориоидеи и ЦАС (рис. 5).
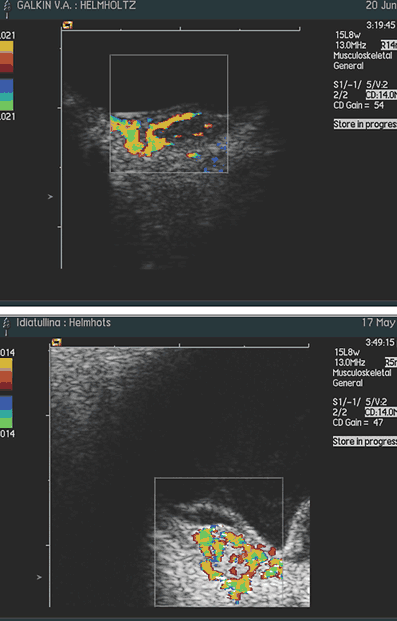
Рис. 3, 4: Цветовое допплеровское картирование гемангиомы макулярной локализации
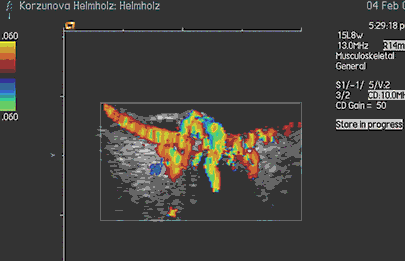
Рис. 5. Цветовое допплеровское картирование юкстапапиллярной гемангиомы хориоидеи
Скоростные показатели кровотока представлены в таблице 1.
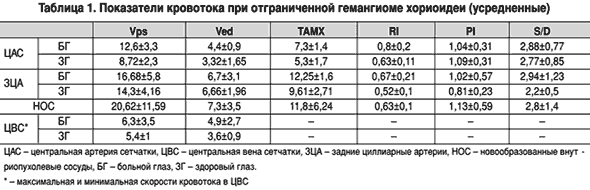
С учетом того, что хориоидея наполняется из бассейна задних цилиарных артерий, представляет интерес, как меняется кровоток в них при хориоидальной опухоли и, в частности, при гемангиоме. Оказалось, что скорость кровотока в задних цилиарных артериях здоровой и больной сторон отличаются и составляют 14,3±4,16 см/с и 16,68±5,8 см/с соответственно. Таким образом, в задних цилиарных артериях при гемангиоме хориоидеи отмечается усиление кровотока в среднем на 16,6%, что можно объяснить необходимостью усиленного притока к опухоли.
При гемангиоме хориоидеи отмечается также увеличение кровотока в ЦАС и ЦВС. По сравнению со «здоровой» стороной кровоток в ЦАС увеличен в среднем на 44,4%, что касается кровотока в ЦВС – он увеличен лишь на 18,9%. Хотя исследуемые нами группы не многочисленны, тем не менее удалось выявить зависимость кровотока в ЦАС в зависимости от локализации опухоли. Так, систолическая скорость кровотока в ЦАС при гемангиоме юкстапапиллярной локализации в среднем составила 15,13 см/с, а при макулярной и парамакулярной локализациях – 10,8 см/с. То есть именно при юкстапапиллярной гемангиоме кровоток в ЦАС усилен по сравнению с гемангиомой макулярной и парамакулярной локализации на 40,1%. Вероятно, увеличением общего притока крови к глазу при гемангиоме хориоидеи можно объяснить такие клинические признаки, как выраженная экссудативная реакция, сопровождающая вторичную отслойку сетчатки даже при небольшой ее проминенции, которые особенно выражены при юкстапапиллярной гемангиоме.
Анализ гемодинамики в новообразованных сосудах опухоли свидетельствует, что пиковая систолическая скорость и конечная диастолическая скорость в них достаточно высоки и превышают таковые в ЗЦА в 1,2 и 1,1 раза соответственно. Именно этим и можно объяснить быстрое «вымывание» флюоресцеина при флюоресцентной ангиографии, на что имеются указания в литературе [7, 13].
Зависимости между степенью выраженности кровотока и размерами опухоли в анализируемой группе не выявлен (табл. 2).
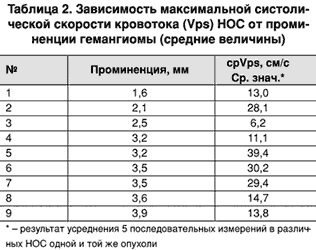
Возможно, это связано с торпидным характером роста, свойственным доброкачественным образованиям. В процессе роста таких новообразований происходит медленное постепенное увеличение новообразованных сосудов и сосудистых полостей.
Изменение кровотока в новообразованных сосудах гемангиомы с учетом локализации патологического очага сопровождается увеличением максимальной систолической скорости кровотока во внутриопухолевых сосудах, что более демонстративно при юкстапапиллярной локализации гемангиомы. В среднем она оказалась выше, чем при макулярной и парамакулярной локализациях, и составила 24,6 см/с и 18,7 см/с соответственно. Т.о., при юкстапапиллярной локализации гемангиомы отмечается усиление скорости кровотока в среднем в 1,3 раза. Обнаруженные изменения можно рассматривать, как документальное подтверждение двойного кровоснабжения опухоли.
Резюмируя изложенное, позволим себе сделать следующее заключение.
Отграниченная гемангиома хориоидеи может быть достаточно четко дифференцирована с помощью дуплексного сканирования. Выявляемые при этом гемодинамические сдвиги позволяют утвердиться в мнении о двойном кровоснабжении опухоли (из системы ЦАС и ЗЦА). Именно этим можно объяснить неудовлетворительные результаты лазеркоагуляции. При последней нарушается питание от сети ретинальных сосудов, но остаются сохранными питающие сосуды из бассейна задних цилиарных артерий, которые облитерируются после брахитерапии.
Список литературы
1. Бровкина А. Ф., Офтальмоонкология. – М., Медицина, 2002. – С. 255–259.
2. Бровкина А.Ф., в Сб.: Современные технологии в диагностике и лечении сосудистой патологии органа зрения. – Краснодар, 2002. – С. 52–53.
3. Бровкина А. Ф., Макарская Н. В. Гемангиомы хориоидеи. // Офтальмол. Журнал. – 1985. – №7. – С. 407 – 411.
4. Катькова Е. А. Диагностический ультразвук в офлальмологии. – М., «Фирма СТРОМ», 2002. – С. 55 – 79.
5. Терентьева Л. С. Внутриглазные опухоли. //Опухоли глаза, его придатков и орбиты. – Киев.: Здоров я, 1978. – С. 109 – 135.
6. Шепкалова В. М., Хорасанян –Тадэ А. А., Дислер О. Н. Внутриглазные опухоли. Атлас. – М.: Медицина, 1965. – С. 6 – 86.
7. Юровская Н. Н. Флюоресцентная ангиография при внутриглазных опухолях. //Офтальмоонкология. – М., Медицина, 2002. – С 16 – 35.
8. Anand R., Augsburger J., Shilds J. Circumscribed choroidal hemangiomas. //Arch ophthal. – 1989. – Vol. 107. – №9. – P. 1338 – 1342.
9. Arevalo J. F., Shields C. L., Shields J.A., et al. Circumscribed choroidal hemangioma: characteristic features with indocyanine green videoangiography. // Ophthalmology . – 2000. – Vol. 107. – P. 344 – 50.
10. Gass GMD. Stereoscopic Atlas of macular diseases. Diagnosis and treatment, 4th ed. St. Louis: Mosby, 1997; 208 – 13.
11. Guthoff R., Berger R., Helmke K. et al. Doppler sonographic findings in intraocular tumors. // Fortschr. Ophthalmol. – 1989. – Vol. 83. – №3. – P. 239.
12. Leys A., Bonnet S. Case repot: associated retinal neovascularization and choroidal hemangioma. // Retina. – 1993. – Vol. 13. – №3. – P. 528 – 532.
13. Lieb W. E., Shields J.A., Cohen S. M., Merton D. A., Mitchell D. G., Shields C. L. et al. Color Doppler imaging in the management of intraocular tumors. // Ophthalmology. – 1990. – Vol. 97. – P. 1660 – 1664.
14. Piccolino F., Borgia L, Zincola E. Indocyanin green angiography of circumscribed choroidal hemangiomas. // Retina. – 1996. – Vol. 16. – №1 – P. 19 – 28.
15. Ruby A., Jampol L., Goldberg M et al. Coroidal neovascularizaions assotiated with choroidal hemangiomas. // Arch. Ophthal. – 1992. – Vol. 110. – №3. – P. 658 – 661.
16. Shields C. L., Honovar S. G., Shields J.A., et al. Circumscribed choroidal hemangioma. // Ophthalmology. – 2001. – Vol. 108. – №12. – P. 2237 – 48.
17. Shields C. L., Shields J.A., De Potter P. Patterns of indocyanine green videoangiography of choroidal tumours. // Br. J. Ophthalmol. – 1995. – Vol. 79. – P. 237 – 45.
18. Shields J.A., Shields C. L. Atlas of intraocular tumors. Philadelphia: Lippincott. Williams & Wilkins, 1999; 170 – 9.
19. Shields J.A., Stephens R. F., Eagle R.C., Shields C.L. Progressive enlargement of a circumscribed choroidal hemangioma. // Arch. Ophthalmol. – 1992. – Vol. 110. – P. 1276 – 78.
20. Yang W., Hu S., Wang L. Color Doppler imaging diagnosis of ocular tumor. // Chin. Med. J. Engl. – 1997. – Vol. 110. – №9. – P. 664 – 6.
21. Yang W., Hu S., Wang L. Color Doppler imaging diagnosis of ocular tumor. //Chang. Hua. Yen. Ko. Tsa. Chin. – 1997. – Vol. 33. – №4. – P. 272 – 6.
0 комментариев