Навигация
Флуориметрія (люмінесцентний аналіз)
ЗМІСТ
|
Вступ………………………………………………………………….. |
4 |
|
|
1 |
ОГЛЯД БІОЛОГІЧНОЇ СКЛАДОВОЇ БІОТЕХНІЧНОЇ СИСТЕМИ |
5 |
|
1.1 |
Опис методу.…………………………………………………………… |
5 |
|
1.2 |
Застосування флуориметрії …………………………………………… |
11 |
|
2 2.1 2.2 |
АНАЛІЗ ТЕХНІЧНОЇ СКЛАДОВОЇ ..…. …………………………… Опис флуориметра …………………………………………………….. Порівняльні характеристики флуориметрів………………………….. |
13 14 19 |
|
3 3.1 3.2 3.3 |
ОЦІНКА ФУНКЦІОНАЛЬНИХ ХАРАКТЕРИСТИК БІОТЕХНІЧ-НОЇ СИСТЕМИ …...…………..……………………………………….. Класифікація біотехнічної системи …………….. ….……………….. Ефективність біотехнічної системи……... …………………………… Оцінювання надійності біотехнічної системи ……………………… |
20 20 20 21 |
|
ВИСНОВОК…………………………………………………………….. |
25 |
|
|
Список використаної літератури ………………………… Додатки..……………………………………………………………... |
26 27 |
ВСТУП
Флуориметрія (люмінесцентний аналіз) заснований на вимірюванні вторинного випромінювання, що виникає в результаті взаємодії ультрафіолетового випромінювання з визначальним компонентом. Зміст катіонів, що не володіють власною люмінесценцією, визначають за допомогою флуоресцентних реакцій комплексів катіонів з органічними реагентами. Для визначення змісту індію, галію, танталу і ін. Флуориметричний метод аналізу заснований на порушенні електронних спектрів випускання молекул визначаємої речовини при зовнішньому УФ-опроміненні і вимірі інтенсивності нх фотолюмінесценції. Для виникнення явища люмінесценції молекули речовини необхідно перевести з основного стану в збуджений з тривалістю його існування, достатньою для здійснення радіаційного електронного переходу зі збудженого стану в основний. Це можливо для молекул з відносно стійким збудженим станом [2].
Флуориметричні методи застосовують тоді, коли відсутні колориметричні методи, досить чутливі або досить виборчі щодо обумовленого елемента. В неорганічному аналізі найчастіше виділяють іони металів у вигляді їх флуоресціюючих комплексів з органічними аддендів у водному розчині або після екстракції органічними розчинниками[3].
Мета курсової роботи розглянути та проаналізувати систему флуориметрії, розглянути прилади для флуориметрії та на їх основі розробити структурну та функціональну схеми для даних типів приладів.
Завдання курсової роботи:
1. Провести огляд біологічної складової біотехнічної системи та проаналізувати принципи взаємодії її з технічною складовою.
2. Провести аналіз технічної складової біотехнічної системи.
3. Розробити схему електричну структурну та схему електричну функціональну біотехнічної системи.
4. Здійснити оцінювання функціональних характеристик біотехнічної системи (провести її класифікацію, оціннювання ефективності та надійності).
5. Сформулювати висновки за підсумками проекту.
1 ОГЛЯД БІОЛОГІЧНОЇ СКЛАДОВОЇ БІОТЕХНІЧНОЇ СИСТЕМИ
1.1 Опис методу
Флуориметрія - метод визначення концентрації речовини по інтенсивності випромінювання, що виникає після поглинання ним енергії збуджуючого випромінювання. Діапазон збудливого і порушуваного оптичного випромінювання досить широкий і простягається від ультрафіолету до ближнього ІЧ (близько 220-1100 нм). Принцип методу флуориметрії полягає в пропорційності між інтенсивністю фотолюмінесценції аналізованого зразка і кількістю визначаємих речовини. Флуориметрія знаходить застосування в таких напрямках, як [1]:
Ідентифікація. Характер спектра флуоресценції, а також колір випромінюваного світла специфічні для будь-якої флуоресціюючої речовини[1].
Кількісний аналіз. При кількісних визначеннях інтенсивність флуоресценції випробуваного зразка порівнюють з інтенсивністю флуоресценції стандартного зразка речовини з відомою концентрацією, яка вимірюється в ідентичних умовах на одному і тому ж приладі[1].
Методика. Згідно фармакопейної статті випробуваний зразок розчиняють в розчиннику або в суміші розчинників. Переносять розчин в кювету флуориметра і висвітлюють променем збуджуючого світла з вказаною в методиці довжиною хвилі[1].
Флуориметричний метод аналізу заснований на порушенні електронних спектрів випускання молекул визначаємої речовини при зовнішньому УФ-опроміненні і вимірі інтенсивності нх фотолюмінесценції. Для виникнення явища люмінесценції молекули речовини необхідно перевести з основного стану в збуджений з тривалістю його існування, достатньою для здійснення радіаційного електронного переходу зі збудженого стану в основний. Це можливо для молекул з відносно стійким збудженим станом [2].
В основі різноманітних хімічних і фізико-хімічних методів аналізу лежать, як правило, реакції трьох типів кислотноосновного, окислювально-відновні і комплексоутворення. Значення їх в практиці аналізу приблизно однаково, але наукові дослідження зосереджені переважно навколо реакцій двох останніх типів. Теорія кислотно-основних взаємодій непогано розроблена. Правда, в даний час увага прикута до кислотно-основних реакцій в наведених розчинах. Окислювально-відновні реакції знаходять все нові застосування в різноманітних фізико-хімічних методах аналізу, і тому їх досліджують вельми інтенсивно. Однак особливо велике значення має вивчення процесів комплексоутворення для фотометричного і флуориметричного аналізу з використанням органічних реагентів, кінетичних методів аналізу, методів поділу елементів [2].
Флуориметричний метод є найбільш чутливим методом аналізу в ТШХ. Визначення кількості речовини в плямі цим методом можна проводити двояко по-перше, вимірюванням флуоресценції комплексних сполук, що утворюються при взаємодії досліджуваної речовини з флуорогенним реагентом, що вводиться при обприскуванні пластинки з проявником. По-друге, по гасінню флуоресценції введеного в шар сорбенту. Найкращі результати в цьому способі флуориметрії можуть бути отримані при використанні можливо тонших шарів сорбенту, хоча при цьому знижується чутливість визначення. Відносна помилка вимірів 3-8% [2].
Викликає подив, що флуориметричні методи аналізу розчинів до сих пір використовуються відносно мало. Одним з найбільш відомих застосувань флуориметрії є аналіз для визначення урану, що виконується, однак, не в розчині. Пробу сплавляють з фторидом натрію в твердий перл і в ньому визначають зміст урану. Навпаки, берилій в силікатних породах визначають в розчинах, використовуючи утворюється комплекс з морином (пентаоксіфлавоном). Подібним же чином визначають слідові кількості галію в породах, використовуючи жовту флуоресценцію комплексу з 8-оксихинолином. Метод поєднує простоту з відтворюваністю і точністю[3].
Флуориметрія (люмінесцентний аналіз) заснований на вимірюванні вторинного випромінювання, що виникає в результаті взаємодії ультрафіолетового випромінювання з визначальним компонентом. Зміст катіонів, що не володіють власною люмінесценцією, визначають за допомогою флуоресцентних реакцій комплексів катіонів з органічними реагентами. Для визначення змісту індію, галію, танталу і ін. Флуориметричним методом використовують наприклад, родаміновие барвники. Флуориметричні методи характеризуються низькою межею виявлення (10-7), але вони часто є недостатньо селективними. Використовуються в основному для визначення вмісту мікродомішок в матеріалах високої чистоти[3].
Флуориметричні методи застосовують тоді, коли відсутні колориметричні методи, досить чутливі або досить виборчі щодо обумовленого елемента. В неорганічному аналізі найчастіше виділяють іони металів у вигляді їх флуоресціюючих комплексів з органічними аддендів у водному розчині або після екстракції органічними розчинниками[3].
Потужність флуоресцентного та фосфоресцентних випромінювання, що випускається пробою, є прямою функцією квантового виходу. Тому квантовий вихід цікавить процесу люмінесценції повинен бути постійним і відтвореним, якщо необхідно розробити успішний флуориметричний або фосфориметричний метод аналізу. Коли квантовий вихід значно зменшується, то кажуть, що люмінесценція загасає. На жаль, багато сторонні речовини можуть впливати на квантовий вихід і тушкувати люмінесценцію. Зокрема, важкі атоми або парамагнітні частинки сильно впливають на швидкість інтеркомбінаційної конверсії, яка, в свою чергу, змінює квантовий вихід флуоресценції або фосфоресценції, тим самим приводячи до похибки в аналізі. У фосфориметрії, звичайно, бажано збільшити швидкість інтеркомбінаційної конверсії, в той час як в флуориметрії - зменшити. Тому, для того щоб запобігти гасіння в більшості флуориметричних методик, важкі атоми і парамагнітні частинки повинні бути вилучені з розчину проби. Кисень, будучи парамагнітним, є особливо серйозною перешкодою, і його також видаляють, пропускаючи азот через аналізовані розчини [3].
Явище люмінесценції широко використовується в хімії для дослідження процесів, пов'язаних зі змінами електричної енергії в різних процесах. Зміна спектрів збудження або випускання (визначення див. нижче) несе в собі важливу інформацію про хімічний склад системи, кінетики процесів, формах знаходження флуорофора в гомогенних і гетерогенних середовищах. В основі люмінесценції лежить явище випускання світла часткою, що знаходиться в збудженому електронному стані[4].
За методом збудження люмінесценції ділиться на фото-, електро- і хемілюмінесценцію; за часом життя і мультиплетності порушеного і основного станів - на флуоресценцію і фосфоресценцію. Флуоресценція - швидко загасаюче випромінювання, пов'язане з переходом між станами без зміни мультиплетності системи, наприклад, із збудженого синглетного в основний синглетний стан. Фосфоресценція - повільно загасаюче випромінювання, що відповідає переходу між станами з різною мультиплетністтю, наприклад, з триплетного в синглетне. Довжина хвилі випускання і час життя збудженого стану є індивідуальними характеристиками флуорофора. При наявності в системі декількох компонентів флуророфоров їх індивідуальне визначення можливо на основі спектральних і / або тимчасових характеристик[4].
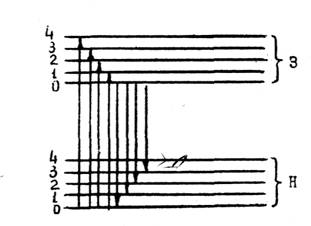
Для схематичного зображення процесів, що відбуваються при поглинанні, перетворенні і випущенні енергії в процесі люмінесценції часто використовують діаграми Яблонського, що представлені на рисунку 1.1. Різні стани з наборами відповідних їм коливальних рівнів: S0, S1, S2 – електронні стани з однаковою мультиплетністтю; Т1 – триплетний електронний стан [4].
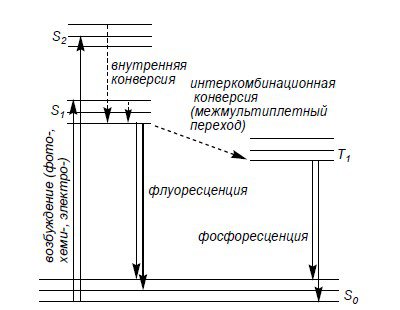
Рисунок 1.1 – Діаграма Яблонського [4]
На відміну від спектрів, що відповідають поглинанню енергії, спектри, відповідають випромінюванню енергії, називають спектрами випускання, або спектрами флуоресценції (фосфоресценції) - залежність інтенсивності випускається випромінювання від його довжини хвилі. При цьому збудження системи (В разі фотолюмінесценції) забезпечується опроміненням з фіксованою довжиною хвилі. Розрізняють також і спектри збудження флуоресценції, які мають залежність інтенсивності випромінювання при фіксованій довжині хвилі від довжини хвилі збудження. Якщо випускання збудженої молекули відбувається з єдиного стану, то спектр поглинання збігається за формою з спектром збудження флуоресценції [4].
На практиці можливість запису того чи іншого спектру реалізується різними способами. Так, спектр поглинання реєструється шляхом запису інтенсивності сигналу, що пройшов крізь зразок від джерела випромінювання до фотоприймача (рис. 1.2) при зміні довжини хвилі випромінювання, що пройшов через монохроматор [4].
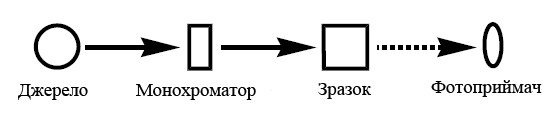
Рисунок 1.2 – Оптична схема реєстрації поглинання випромінювання однопроменевим приладом [4]
Найбільш часто для отримання спектрів флуоресценції, а також спектрів збудження флуоресценції апаратно реалізується інша оптична схема, що представлена на рисунку 1.3.
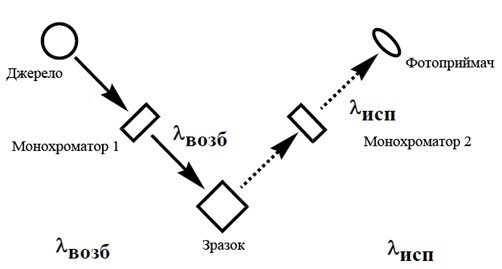
Рисунок 1.3 – Оптична схема реєстрації флуоресценції, що записується при різних режимах роботи монохроматорів [4]
У ній джерело випромінювання і фотоприймач, якщо дивитися від зразка, знаходяться під прямим кутом один до одного для зменшення попадання збудливого випромінювання в детектор. Крім того, часто в приладах існує можливість розкладання в спектр як збудливого, так і випускається зразком випромінювання. Для цього в нього вводять два монохроматора. Якщо за допомогою монохроматора 1 фіксують довжину хвилі випромінювання
(lвозб), а для запису випускання використовують монохроматор 2, то в результаті
отримують спектр випускання (флуоресценції) зразка. Якщо ж за допомогою
монохроматора 2 фіксують довжину хвилі випускання (lісп.), то змінюючи довжину хвилі монохроматора 1, отримують спектр збудження флуоресценції зразка[4].
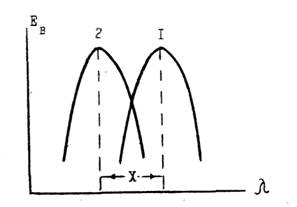
У разі єдиного випускає збудженого стану спектр випускання (флуоресценції) не залежить від довжини хвилі збудження. надлишок енергії збудження над нижчим електронно-коливальних збудженим рівнем (S1) витрачається на внутрішню конверсію флуорофора. Цей факт є основоположним при доказі присутності в системі флуорофора. Для флуорофорів виконується правило дзеркальної симетрії Левшина, згідно з яким спектри поглинання і
люмінесценції, побудовані в одних координатах, є дзеркальними відображеннями один одного (рис. 1.4). Якщо в спектрі поглинання присутній кілька смуг, то дзеркальної по відношенню до спектру люмінесценції є смуга, що відповідає порушеній станом, з якого відбувається випускання. За допомогою правила Левшина можна ідентифікувати такі смуги поглинання[4].
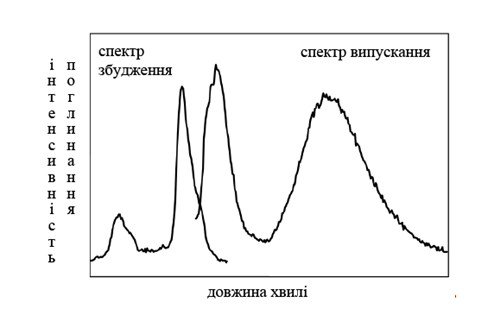
Рисунок 1.4 – Спектри збудження флуоресценції, що представлені в одних координатах [4]
Правило Левшина виконується, якщо близькі геометрії молекул в основному та збудженому станах, а також енергії їх коливальних рівнів в цих станах, що відраховані від енергії нульових коливань[4].
Збудження, як правило, відбувається з нижчого коливального рівня основного стану на випадковий (відповідний конкретної енергії поглинутого кванта) рівень. Тому форма піку в спектрі поглинання відповідає розподілу коливальних рівнів збудженого стану. Випускання ж, як правило, протікає після
внутрішньої конверсії (або релаксації) з більш високих коливальних рівнів електронного збудженого стану на нижчий. розподіл квантів випускання по енергіях в такому випадку відповідає коливальним рівнями основного стану[4].
У ряді випадків можуть спостерігатися відхилення від цього правила. зазвичай це пов'язано з різницею в геометрії молекул в основному і збудженому станах або формуванням специфічних збуджених частинок, таких як Ексімер або ексіплекси. При порушенні флуоресценції в конденсованої фазі спостерігається зрушення ліній спектру випускання в довгохвилбову область, званий зрушенням Стокса. Важливою характеристикою флуоресценції є квантовий вихід, що є відношенням випущених і поглинених фотонів. В межі він дорівнює одиниці, в разі, якщо всі збуджені молекули переходять в основний стан (релаксує) через радіаційний шлях. Ставлення молекул, релаксируючих по випромінювальному і безвипромінювальному шляхах, можна також висловлювати через швидкості випускання фотона і швидкості безвипромінювальній конверсії. Тоді квантовий вихід, близький до одиниці, відповідає тому, що константа швидкості внутрішньої безвипромінювальній конверсії набагато менше константи швидкості випускання фотона[4].
Розрізняють також і енергетичний вихід флуоресценції, а саме -
ставлення енергії що була випущена і поглиненої енергії. Розрахувати його можна, домножимо квантовий вихід на ставлення енергій що були випущені і поглинених квантів. Оскільки випускання відбувається на більш довгих хвилях (рис. 1.4), енергії квантів випускання менше. Це ж показано і на діаграмі
Яблонського (рис. 1.1), де видно, що внутрішня конверсія призводить до
зменшення енергії випускаються квантів по відношенню до поглинутої. Таке зменшення називається стоксовими втратами. Через таких втрат енергетичний вихід флуоресценції завжди менше одиниці, навіть якщо квантовий вихід і кількісний. На вихід флуоресценції впливає і середовище, що оточує молекули
флуорофора. Оскільки процеси поглинання і випускання світлових квантів є статистичними, то склад середовища може позначатися на ефективності процесу. Так, розчинений кисень має ефект гасіння флуоресценції, пов'язаним з безизлучательним перенесенням енергії збудженого стану флуорофора на молекули кисню. отже, при дослідженні флуоресцентних властивостей речовини необхідно брати до увагу не тільки процеси, що відбуваються безпосередньо за участю молекул флуорофора, а й процеси за участю навколишнього його середовища [4].
При експериментальному вимірюванні квантового виходу вважають, що мірою числа випущених квантів є площа під спектром флуоресценції, то
тобто ці величини прямо пропорційні один одному. Також вважають, що і
число поглинених квантів пропорційно оптичної щільності. Найчастіше квантовий вихід (j) люмінесценції (флуоресценції або фосфоресценції) досліджуваної речовини визначають по відношенню до іншого речовині, званому стандартом, для якого він відомий. цей спосіб найбільш простий експериментально, а виміряний таким способом квантовий вихід називають відносним квантовим виходом. Для його розрахунку потрібно виміряти в однакових умовах площі під спектрами випускання як досліджуваної речовини, так і стандарту (Si), оптичні щільності цих речовин на довжині хвилі збудження (Di), а також показники заломлення розчинників (ni), в яких відбуваються дослідження. Розрахунок проводять за формулою[4]:
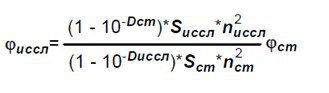 (1.1)
(1.1)
Флуоресценція органічних сполук охоплює спектральную область від 200 до 830 нм [5].
Як правило, довжина хвилі флуоресцентного випромінювання більше довжини хвилі збудження на 20 - 30 нм і більш через втрату частини енергії в збудженому стані (Стокс зрушення). Поглинання і випускання випромінювання здійснюється завдяки переходу електронів між різними енергетичними рівнями або молекулярними орбіталями. Випускання світла відбувається через певний проміжок часу після його поглинання; цей проміжок часу є тривалість перебування молекули в збудженому стані. Для більшості флуоресціюючих речовин час загасання флуоресценції становить зазвичай 10-9 - 10-8 с. Короткий час життя флуоресценції відрізняє цей тип люмінесценції від фосфоресценції, яка представляє собою довгоживучі світіння, що має час життя від 10-3 с до кількох хвилин[5].
Метод флуориметрії в 10 - 100 разів чутливіший абсорбційної спектрофотометрії, але флуоресцентними властивостями володіє тільки обмежене коло сполук: ароматичні, особливо з конденсованими структурами, гетероциклічні та карбонільні сполуки. З фармацевтичних субстанцій визначенням методом флуориметрії підлягають амінокислоти (фенілаланін, триптофан, тирозин), алкалоїди (стрихнін, резерпін, хінін), вітаміни (фолієва кислота, рибофлавін, ретинолу ацетат), стероїдні гормони (етинілестрадіол).
Інтенсивність флуоресценції вимірюється в умовних одиницях, пропорційних відгуку детектора і позначається символом I[5].
Спектр випускання флуоресценції є залежність інтенсивності флуоресценції від довжини хвилі (в нм) або частоти (в см-1) при заданій довжині хвилі збудження. Спектр збудження флуоресценції є залежність інтенсивності випромінювання в максимумі випущення флуорофора від довжини хвилі або частоти збуджуючого світла. При цьому спектр збудження зазвичай збігається зі спектром поглинання, так само як і інтенсивність флуоресценції пропорційна світлопоглинанню. Комбінування спектрів випускання, отриманих при різних довжинах хвиль збудження, дає тривимірну карту випускання[5].
Похожие работы
... і. Початок розвитку цього методу відноситься до глибокої старовини. Віками люди спостерігали за світінням у темряві гнилого дерева, комах, однак природа цього явища тривалий час залишалася нерозкритої. Рукописні зведення про люмінесценцію починаються з Каскаріоло, що у 1604 р. синтезував першу штучну речовину здатну до люмінесценції (болонский фосфор). Пізніше алхіміки відкрили цілий ряд мінерал ...
0 комментариев