Навигация
Комплексные соединения в аналитической химии
Министерство образования и науки РФ
Государственное образовательное учреждение высшего профессионального образования
Дальневосточный государственный университет
Институт химии и прикладной экологии
Химический факультет
Кафедра неорганической и элементорганической химии
Курсовая работа тему:
Комплексные соединения в аналитической химии
Выполнил:
Иванов И.И.
Владивосток 2010
Оглавление
Введение
1. Основные понятия и терминалогия
2. Химическая связь в комплексных соединениях и особенности их строения
2.1 Тип гибридизации атомных орбиталей комплексообразователя и структура внутренней сферы комплексного соединения
3. Химические свойства комплексных соединений
3.1 Диссоциация в растворах
3.2 Образование комплексных соединений
3.3 Трансформация или разрушение комплексных соединений
3.4 Кислотно-основные свойства комплексных соединений
4. Комплексные соединения в аналитической химии
4.1 Качественный анализ катионов
5. Комплексонометрия
5.1 Понятие
5.2 Комплексонометрическое титрование — комплексонометрия
Заключение
Список использованной литературы
Введение
Обширную группу химических соединений составляют комплексы, в молекулах которых всегда можно выделить центральный атом или ион, вокруг которого сгруппированы другие ионы или молекулярные группы.
Комплексы имеют исключительно большое значение в живой и неживой природе. Гемоглобин, благодаря которому осуществляется перенос кислорода из легких к клеткам ткани, является комплексом железа, а хлорофилл, ответственный за фотосинтез в растениях, – комплексом магния. Значительную часть природных минералов, в том числе многие силикаты и полиметаллические руды, также составляют комплексы. Химические методы извлечения металлов из руд связаны с образованием легкорастворимых, легкоплавких и высоколетучих комплексов. Современная химическая промышленность широко использует комплексы как катализаторы.
С использованием комплексов связана возможность получения многообразных лаков и красок, прочных электрохимических покрытий, фотоматериалов, надежных средств переработки и консервирование пищи.
Огромное значение имеют комплексные соединения в аналитической химии. Они используются как в качественном, так и в количественном анализах. Такое разнообразие применений заключается в особенностях строения, структуре химических связей.
При изучении литературы я перед собой ставил следующие цели:
- иметь представление о следующих понятиях и величинах: комплексообразователь, лиганд, координационное число, дентатность лиганда, внутренняя и внешняя сферы комплексного соединения, хелатные и полиядерные комплексные соединения;
- знать особенности химической связи во внутренней сфере комплексных соединений; условия образования, разрушения и трансформации комплексных соединений; особенности строения и функции в организме миоглобина, гемоглобина, метгемоглобина, цитохромов, ионофоров;
- понимать сущность металлолигандного гомеостаза и возможностей его нарушения и восстановления; комплексонометрии и ее применения в санитарно-клиническом анализе.
1. Основные понятия и терминалогия
Многие процессы жизнедеятельности протекают с участием комплексных соединений. В живых организмах присутствуют комплексные соединения биогенных металлов с белками, витаминами и другими веществами, играющими роль ферментов или выполняющими специфические функции в обмене веществ. Характерной особенностью комплексных соединений является наличие в них химической связи, возникшей по донорно-акцепторному механизму.
Поэтому сущность реакции комплексообразования заключается во взаимодействии двух противоположностей: акцептора электронной пары и донора электронной пары.
Комплексные соединения - устойчивые химические соединения сложного состава, в которых обязательно имеется хотя бы одна связь, возникшая по донорно-акцепторному механизму.
Комплексные соединения состоят из комплексообразователя и лигандов, образующих внутреннюю сферу, и внешней сферы, состоящей из ионов, которые компенсируют заряд внутренней сферы.
Комплексообразователь (центральный атом) - атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали, и занимает центральное положение в комплексном соединении.
Роль комплексообразователя в основном выполняют атомы или ионы d- и f-металлов, так как они имеют много свободных атомных орбиталей на валентном уровне и достаточно большой положительный заряд ядра, за счет которого способны притягивать электронные пары доноров. Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число. Значение координационного числа комплексообразователя зависит от многих факторов, но обычно оно равно удвоенному заряду иона комплексообразователя. Наиболее характерными координационными числами являются 2, 4 и 6.
В комплексных соединениях комплексообразователь связан с лигандами.
Лиганды - молекулы или ионы, которые являются донорами электронных пар и непосредственно связаны с комплексообразователем.
Обычно лигандами являются ионы или молекулы, содержащие неподеленные (свободные) электронные пары или достаточно подвижные π-электронные пары.
Лиганды-анионы: F- , Cl-, Br-, I-, OH-, NO2-, CN-, CNS-, RCOO-
фторид хлорид бромид иодид гидроксид нитрит цианид роданид карбоксилат
Лиганды-молекулы: H2O, ROH, R—O—R, CO, NH3
вода спирты эфиры монооксид углерода аммиак
По числу связей, образуемых лигандом с комплексообразователем, лиганды делятся на моно-, би- и полидентатные. Все вышеуказанные лиганды являются монодентатными, так как они выступают донорами только одной электронной пары.
К бидентатным лигандам относятся молекулы или ионы, содержащие две функциональные группы и способные выступать донорами двух электронных пар:
H2NCH2CH2NH2-OOC—COO-,H2NCH2COOмолекула этилендиамина дианион щавелевой кислоты анион аминоуксусной кислоты
Примерами полидентатных лигандов являются:
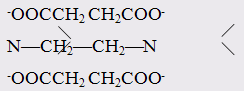
тетраанион этилендиаминтетрауксусной кислоты (EDTA)
6-дентатный лиганд
В соответствии со своей дентатностью лиганд может образовывать соответствующее число связей с комплексообразователем.
Лиганды координируются вокруг комплексообразователя, образуя внутреннюю сферу комплексного соединения.
Внутренняя сфера комплексного соединения есть совокупность центрального атома и лигандов.
Во внутренней сфере связь комплексообразователя с лигандами имеет донорно-акцепторное происхождение и является ковалентной. При записи формулы комплексного соединения его внутреннюю сферу выделяют квадратными скобками, например [NН4]С1; К3[Fе(СN)6]. Заряд внутренней сферы комплексного соединения равен алгебраической сумме зарядов комплексообразователя и всех лигандов. Внутренняя сфера может быть:
а) заряжена положительно - катион:
[Сu2+(NН3)40]z z = +2 + 4 -0 = +2
б) заряжена отрицательно - анион:
[Fe3+(CN-)6]z z = +3 + 6*(-1) = -3
в) электронейтральна:
[Fе0(СО)0]z z = 0 + 5*0 = 0
В соответствии с зарядом внутренней сферы комплексные соединения подразделяются на анионные, катионные и нейтральные комплексы.
Заряд внутренней сферы компенсируется ионами внешней сферы комплексного соединения.
Внешняя сфера комплексного соединения — это положительно или отрицательно заряженные ионы, нейтрализующие заряд комплексного иона и связанные с ним ионной связью.
Суммарный заряд ионов внешней сферы всегда равен по значению и противоположен по знаку заряду внутренней сферы, чтобы молекула комплексного соединения была электронейтральна
[Сu(NH3)4]S04
внутренняя внешняя
сфера сфера
2. Химическая связь в комплексных соединениях и особенности их строения
В образовании химической связи во внутренней сфере комплексного соединения важнейшую роль играет донорно-акцепторное взаимодействие лигандов и комплексообразователя. При этом между ними возникает ковалентная и не сильно полярная связь. Именно этим объясняются главные особенности свойств внутренней сферы комплекса: строго определенное пространственное расположение лигандов вокруг комплексообразователя и достаточно высокая устойчивость к диссоциации связи лиганда с комплексообразователем. Вначале рассмотрим структуру внутренней сферы комплексного соединения. Комплексообразователь предоставляет свободные орбитали, которые формируются из незанятых s-, p- и d-атомных орбиталей внешних электронных слоев. При этом комплексообразователь предоставляет не чистые s-, р- и d- орбитали, а энергетически равноценные гибридные орбитали, оси которых определенным образом располагаются в пространстве. Это и создает структуру внутренней сферы комплекса, которая определяется типом гибридизации исходных свободных атомных орбиталей комплексообразователя.
Похожие работы
... - + H3O+, внутрисферные превращения лимандов, например, координированных нитрилов R-CЇN (R - органический радикал) в амидины [Pt(R-CЇN)2Cl2] + 2NH3 [Pt()2Cl2] и другие превращения. Многие комплексные соединения являются катализаторами различных процессов гомогенного и гетерогенного катализа. Часто при получении лекарственных препаратов на основе фармакологически активных комплексных ...
... АНАЛИЗА 4.1. Теории кислотно-основных индикаторов Кроме использования органических соединений для образования металлокомплексов, образования окрашенных соединений органические реагенты используются очень широко в аналитической химии в качестве индикаторов методов кислотно-основного титрования. Индикатор – это вещество, которое проявляет видимое изменение в точке эквивалентности или вблизи ...
... химия не только обеспечила эти области эффективными методами анализа, но и послужила основой разработки многих новых технологических процессов. Основные этапы развития аналитической химии Многие практические приемы аналитической химии и аналитические методики были известны в глубокой древности. Это, прежде всего пробирное искусство, или пробирный анализ, который выполнялся «сухим» путем, т. ...
... дитизон образует экстрагируемые комплексы. В этих же работах предпринята попытка теоретического обоснования подхода к оценке констант межлигандного обмена в экстрактах комплексов металлов. Этот подход основан на том, что неизвестная константа равновесия обмена , в экстракте (индекс 0) пропорциональна отношению соответствующих констант экстракции комплексов, измеренных для равновесий в воде. Такое ...

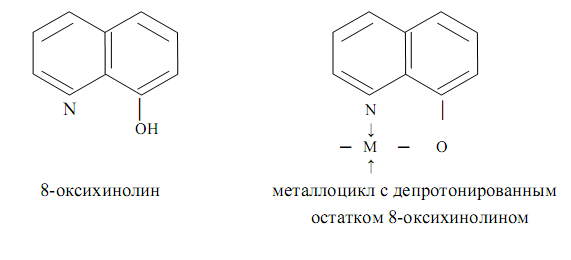
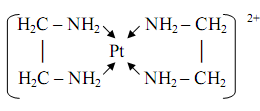
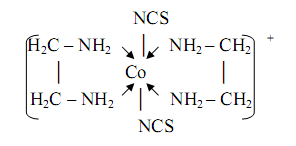
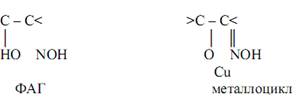
0 комментариев