Навигация
Получение медного купороса из окиси меди и сернистого газа
1.4.2 Получение медного купороса из окиси меди и сернистого газа
Этот способ производства медного купороса является весьма экономичным. Однако применение его целесообразно главным образом в районах расположения медеплавильных заводов, где имеется соответствующее сырье – окись меди и отбросный сернистый газ.
В связи с этим особый интерес приобретает получение медного купороса из белого матта. При окислительном обжиге белый матт превращается в окись меди. Выделяющийся при этом сернистый газ рационально использовать для превраще-ния полученной окиси меди в медный купорос. Недостающее количество SO2 может быть пополнено за счет сернистых газов медеплавильных печей. Таким образом, белый матт может быть переработан на медный купорос без затраты серной кислоты и с полным использованием его компонентов – меди и серы.
Способ производства медного купороса из окиси меди и сернистого газа основан на взаимодействии при 85 – 950 суспензии окиси меди в водном растворе медного купороса со слабым сернистым газом, содержащим SO2 и кислород.
Отбросный сернистый газ, в случае необходимости, должен разбавляться воздухом. Это ускоряет процесс, так как концентрация SO2 в газе не имеет существенного значения, а увеличение содержания кислорода ускоряет реакцию.
Образование медного купороса происходит в результате двух независимо идущих процессов. Первый из них заключается в том, что сернистый газ в присутствии каталитически действующих ионов меди окисляется кислородом в серную кислоту:
2 SO2 + O2 + 2 H2O = 2 H2S (17)
Образовавшаяся кислота растворяет окись меди, причем получается медный купорос:
H2SO4 + СuO = CuSO4 + H2O (18)
Второй, параллельно идущий процесс заключается в частичном восстановлении сернистым газом двухвалентной (окисной) меди в одновалентную (закисную) с образованием плохо растворимой в воде соли Шевреля – комплексной окисно-закисной соли сернистой кислоты Сu(CuSO3)2 ∙ 2 H2O или CuSO3 ∙ Cu2SО3 ∙ 2 H2O:
3 CuSO4 + 3 H2SO3 + 3 H2O = CuSO3 ∙ Cu2SО3 ∙ 2 H2O + 4 H2SO4 (19)
Эта соль в отсутствие кислорода при кипячении суспензии разлагается с выделением закиси меди:
3 (CuSO3 ∙ Cu2SО3 ∙ 2 H2O) = CuSO4 + 2 Cu2О + 5 SO2 (20)
Однако под действием сернистого газа и кислорода в результате дальнейшего образования серной кислоты закись меди снова переходит в раствор, и осадок соли Шевреля постепенно исчезает из суспензии, также превращаясь в медный купорос:
CuSO3 ∙ Cu2SО3 ∙ 2 H2O + SO2 + 2 O2 = 3 CuSO4 + 2 H2O (21)
Окисление соли Шевреля при действии SO2 и O2 протекает с образованием вначале основного сульфата меди:
2 (CuSO3 ∙ Cu2SО3 ∙ 2 H2O) + 3 O2 = Cu(OH)2 ∙ Cu SO4 + 3 CuSO4 + 2 H2O (22)
Эта реакция идет с большей скоростью, чем образование серной кислоты под каталитическим влиянием ионов меди. По мере накопления H2SO4 основной сульфат меди переходит в раствор:
2 Cu(OH)2 ∙ Cu SO4 + 2 H2SO4 = 3 CuSO4 + 4 H2O (23)
В результате этих процессов из суспензии исчезают все твердые фазы – и СuO и CuSO3 ∙ Cu2SО3 ∙ 2 H2O и 2 Cu(OH)2 ∙ Cu SO4 – и суспензия превращается в раствор медного купороса. Таким образом, в общем процессы сводятся к окислению четырехвалентной серы (SO2) в шестивалентную и могут быть выражены суммар-ным уравнением:
2 СuO + 2 SO2 + O2 = 2 Cu SO4 (24)
Растворимость соли Шевреля возрастает с повышением температуры и содержанием в растворе CuSO4. При 200С растворимость этой соли в воде равна 0,042 %, а при 60 – 0,14 %. В 30 % растворе CuSO4 ∙ 5H2O при 200С растворимость повышается до 0,1 %, а при 600С – до 0,379 %. Поэтому, будучи суспензирована в растворе медного купороса, комплексная соль окисляется быстрее, чем в водной суспензии. Следовательно, для приготовления исходной суспензии окиси меди целесообразно брать не воду, а раствор медного купороса.
Скорость окисления соли Шевреля возрастает с уменьшением концентрации SO2 в газе. Последнее объясняется, вероятно, тем, что в газовых смесях с высоким содержанием SO2 количество кислорода недостаточно для окисления. При содержании в газе 1 – 4 % SO2 и температуре 950С соль Шевреля окисляется полностью за 15 – 20 минут. Однако длительность процесса увеличивается за счет времени, необходимого для предварительного растворения окиси меди и образования соли Шевреля. При 950С и достаточном содержании кислорода в газе (при объемном отношении O2: SO2 > 4) степень использования меди за 1 час составляет 94 – 97 %, а за 1,5 ч больше 99 %.
Технологическая схема производства медного купороса этим способом весьма проста. Окись меди суспендируют в маточном растворе, оставшемся после кристаллизации медного купороса, суспензию нагревают до 85 – 950 и насыщают отбросным сернистым газом, разбавленным воздухом. Из полученного раствора при охлаждении до 200С кристаллизуется медный купорос. Кристаллы отжимают на центрифуге, и маточный раствор возвращают в процесс.
Похожие работы
... 14,2 16,0 11 Сульфаты, мг/дм3 56 49 61 48 60 57 12 Микробиологический тест, кол./мл - - - - - - 13 Скорость коррозии, мм/год 0,10 0,16 0,17 0,09 0,12 0,15 3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 3.1. Усовершенствование метода водоподготовки производства этилбензол-стирола реагентами фирмы «Nalco» Вода является основным охлаждающим агентом, используемым во всех отраслях ...
... ходом процесса. Через 3 минуты внесите в одну из пробирок раствор хлорида натрия. Что вы наблюдаете? Проведите анализ опытов а) и б). Глава 2. Методика изучения растворов. Теория растворов – одна из ведущих теорий курса химии. Причины важности темы кроется не только в том, что она имеет большое практическое значение, но и прежде всего ...
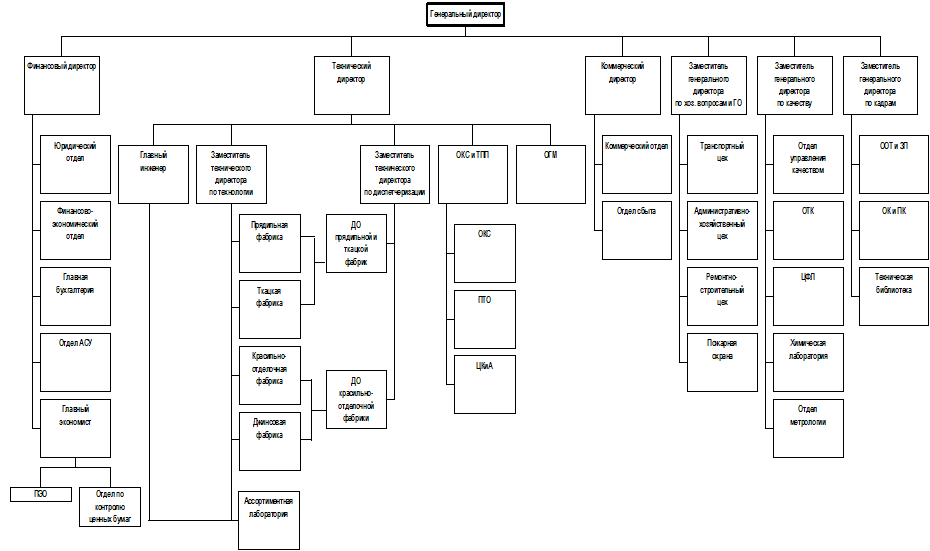
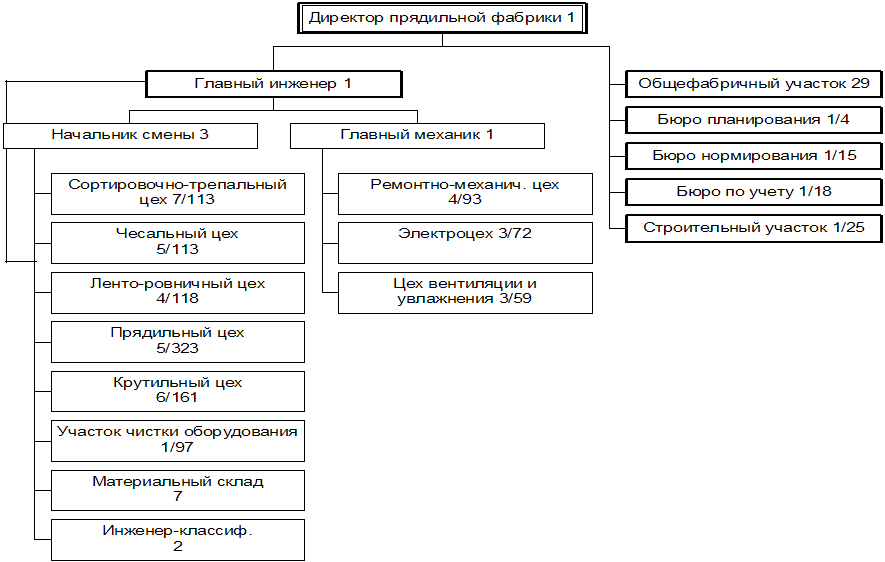
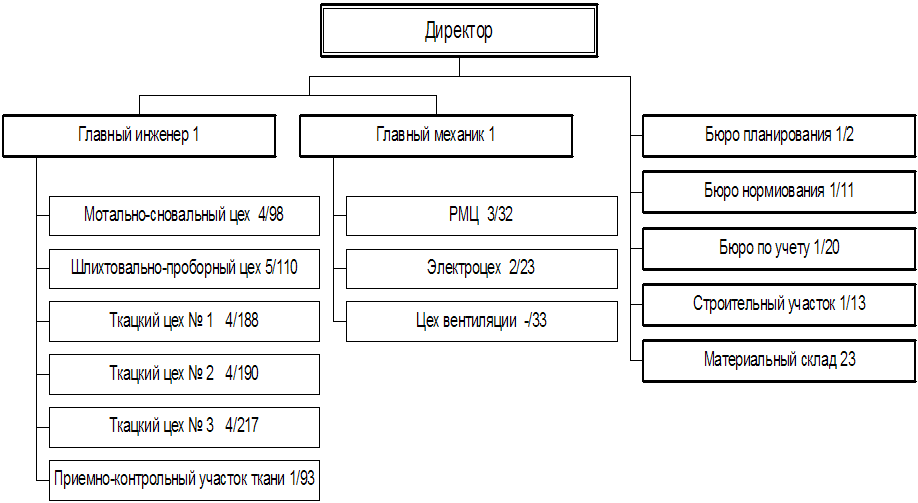
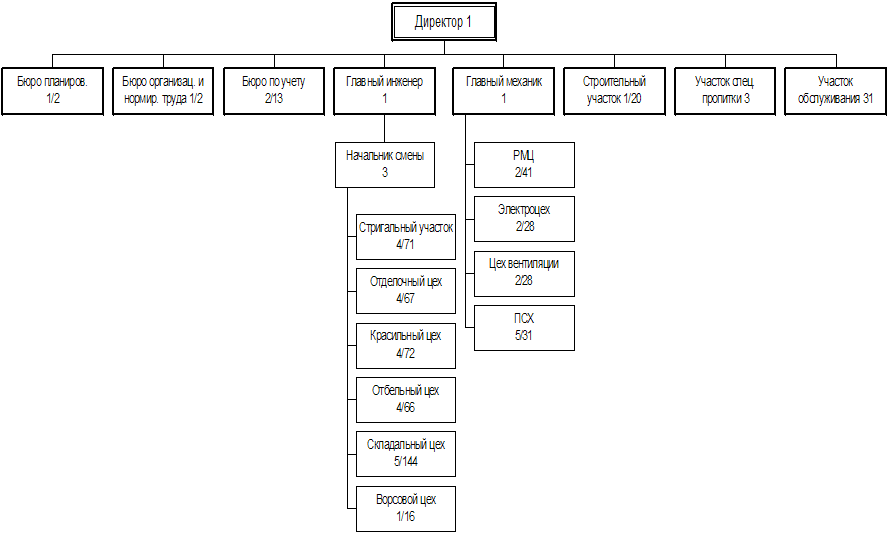
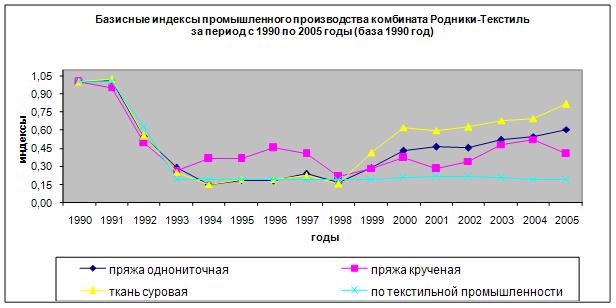
... 145 761 138 892 162 142 169 012 дек.05 169 012 147 915 166 203 187 300 2. МАРКЕТИНГОВАЯ, ПРЕДПРИНИМАТЕЛЬСКАЯ И КОММЕРЧЕСКАЯ ДЕЯТЕЛЬНОСТЬ ОАО «РОДНИКИ - ТЕКСТИЛЬ» 2.1 Анализ конкурентов Конкуренция - состязательность хозяйствующих субъектов, когда их самостоятельные действия эффективно ограничивают возможность каждого из них односторонне воздействовать на общие условия обращения ...
... из темного стекла, закрывают корковой пробкой с хлоркальциевой трубкой и хранят в темном месте, так как на свету в нем образуются перекиси, вызывающие взрывы. ЭКСПЕРТИЗА РЫБЫ И РЫБНЫХ ПРОДУКТОВ Рыбу и рыбную продукцию принимают по количеству и качеству партиями. Партией считается определенное количество продукции одного наименования, способа обработки и сорта, одного предприятия-изготовителя, ...
0 комментариев