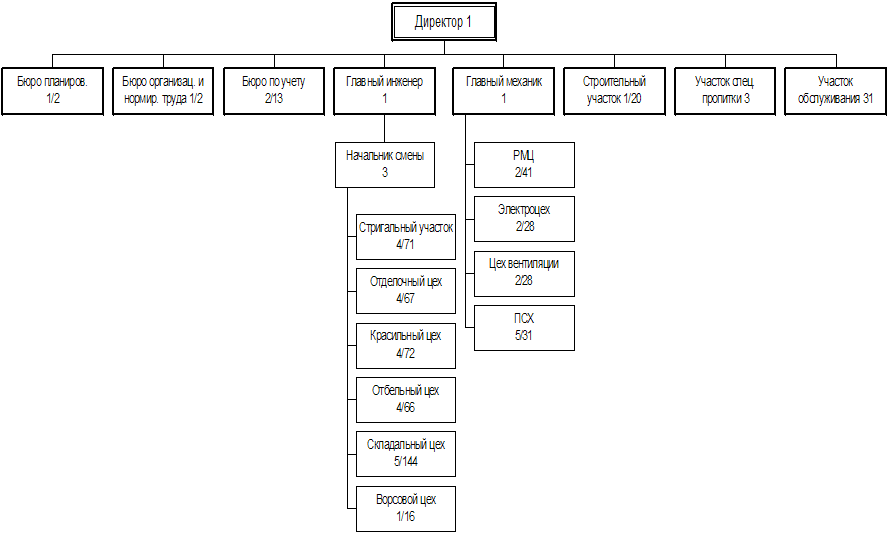
Навигация
Производство медного купороса из медного лома
1.1 Производство медного купороса из медного лома
В отсутствие окислителей, в частности кислорода воздуха, в разбавленной серной кислоте медь практически не растворяется. Она с достаточной скоростью растворяется в горячей концентрированной серной кислоте, но осуществлять этот процесс не рационально, так как при этом половина затрачиваемой кислоты восстанавливается до SO2, окисляя медь в окись меди, которая и растворяется в серной кислоте, образуя медный купорос. Схема этого процесса может быть выражена следующими уравнениями реакций:
Cu + H2SO4 = CuO + H2O + SO2 (1)
![]() CuO + H2SO4 = CuSO4 + H2O (2)
CuO + H2SO4 = CuSO4 + H2O (2)
Cu + 2 H2SO4 = CuSO4 + 2 H2O + SO2 (3)
С целью экономии серной кислоты окисление меди производят кислородом воздуха одновременно с процессом «натравки», то есть растворения в серной кислоте. Медный лом предварительно переплавляют для рафинирования (очистки от примесей Fe, Zn, Al, Pb и др.) и придания ему формы, удобной для растворения – пустотелых гранул, обладающих большой поверхностью, что ускоряет растворение в кислоте в 5 – 10 раз.
1.1.1 Очистка и грануляция медного лома
Чистая медь плавится при 10840С, а в присутствии примесей – при более низкой температуре. Примеси летучих металлов и окислов – металлический цинк, трехокиси мышьяка и сурьмы – удаляются при нагревании меди до ее расплавления. При расплавлении медь окисляется до закиси меди, устойчивой выше 11000. Закись меди накапливается на поверхности расплавленной меди в твердом (до 12000С) и в жидком (выше 12350С) виде и частично растворяется в меди, а затем вступает во взаимодействие с примесями, например:
Cu2O + Fe = FeO + 2 Cu (4)
По мере расходования растворенной закиси меди новые ее количества переходят с поверхности в раствор, и медь подвергается дальнейшему окислению.
Образующиеся окислы железа, магния, кальция и других металлов не растворимы в меди и переходят в шлак, всплывающий на поверхность металла. Вследствие взаимодействия закиси меди с некоторыми окислами (например, с окисью железа с образованием феррита меди) часть ее также переходит в шлак и содержание в нем Cu2O достигает 30–40 %.
После окисления, ошлакования примесей металлов и удаления шлака температуру в печи немного снижают с целью окисления присутствующей в меди полусернистой меди:
Cu2S + 2 Cu2O↔ 6 Сu + SO2 (5)
Эта реакция протекает бурно, и выделяющаяся двуокись серы увлекает брызги меди с образованием «медного дождя» («кипение» массы).
В производстве медного купороса дальнейшая очистка меди не требуется, а присутствие в ней кислорода и двуокиси серы необходимо для получения пористых и пузыристых гранул. Растворимость газов в расплавленной меди возрастает с повышением температуры. В твердой меди, нагретой даже до температуры плавления, растворимость газов незначительная. Процесс гранулирования с получением пузыристой и пористой меди основан на быстром выделении газов при внезапном охлаждении и затвердевании расплавленной меди. Это осуществляется выливанием ее тонкой струей в холодную воду.
Серы, содержащейся в меди, обычно недостаточно для образования полных гранул. Поэтому в период «кипения» расплава в него добавляют некоторое количество полусернистой меди или комовой серы (1 – 1,5 %). Образующаяся при этом двуокись серы растворяется в меди, а при ее грануляции выделяется и раздувает капли меди в пустотелые шарики с тонкими стенками.
1.1.2 Растворение меди в серной кислоте (натравка)
При взаимодействии гранул меди с разбавленным раствором серной кислоты, содержащим также сульфат меди, в присутствии воздуха, кислород воздуха растворяется в кислоте, диффундирует к поверхности меди и окисляет ее до закиси меди:
4 Cu + O2 = 2 Cu2O (6)
Закись меди растворяется в серной кислоте:
Cu2O + H2SO4 = Cu2SO4 + H2O (7)
Образующийся сульфат закиси меди легко окисляется в сульфат окиси меди:
2 Cu2SO4 + 2 Cu2SO4 + O2 = 4 CuSO4 + 2 (8)
Общая скорость процесса лимитируется наиболее медленной его стадией – окислением меди до закиси меди. Это объясняется малой растворимостью кислорода и медленной его диффузией к поверхности гранул меди. Процесс значительно ускоряется, когда в растворе уже присутствует медный купорос.
Повышение температуры, как и в других случаях, ускоряет химические реакции, но вызывает уменьшение растворимости кислорода, что замедляет окисление. Поэтому в натравочной башне поддерживают температуру не выше 80–850С. При этом на окисление меди используется приблизительно ¼ кислорода, поступающего в башню с воздухом, расход которого составляет около 1000 нм3 на 1 тонну медного купороса.
Растворимость кислорода уменьшается с ростом концентрации CuSO4 в растворе. Поэтому при повышении концентрации CuSO4 скорость растворения меди сначала увеличивается за счет каталитического действия CuSO4, а затем уменьшается вследствие недостатка кислорода. Максимум скорости растворения наблюдается при концентрации 120 г./л CuSO4 (для раствора, содержащего ~ 110 г./л H2SO4). Но даже при содержании в растворе 300 г./л CuSO4 скорость растворения меди в 1,6 раза больше, чем в отсутствие медного купороса. С увеличением концентрации серной кислоты растворимость кислорода в ней уменьшается, но усиливаются ее окислительные свойства. Поэтому повышение кислотности раствора вызывает не очень большое уменьшение скорости растворения меди – всего на 10 % при повышении концентрации H2SO4 с 2,5 до 20 %. Растворение меди значительно ускоряется в присутствии в растворе ионов железа вследствие деполяризации
4 Fe2+ + O2 + 4 H+ = 4 Fe3+ + 2 H2O (9)
2 Cu + 4Fe3+ = 2 Cu2+ + 4 Fe2+ (10)
Ионы Fe2+ вновь окисляются в Fe3+ и служат, таким образом, катализатором процесса. Доля растворяющейся меди под действием ионов Fe3+ в растворе, содержащем ~110 г./л H2SO4, 60 г./л CuSO4 и 20 – 22 г./л FeSO4, составляет около 60 % от всего количества меди, перешедшей в раствор.
Ионы железа попадают в циркулирующий при растворении меди раствор с серной кислотой и вследствие растворения оставшихся в меди примесей. Содержание сульфатов железа в растворе непрерывно возрастает и достигает иногда
70 г./л и более. Вследствие этого при кристаллизации медного купороса выделяется также и сульфат железа, загрязняющий продукт. Поэтому, когда концентрация железа в растворе становится столь большой, что создается опасность получения нестандартного по содержанию железа медного купороса, раствор полностью выводят из обращения.
Существенным является обеспечение равномерного орошения (смачивания) гранул меди раствором. В местах, плохо орошаемых кислотой, образовавшаяся окисная пленка растворяется не полностью, вследствие малой своей растворимости кристаллизуется из раствора и цементирует при этом гранулы и шлам.
Похожие работы
... 14,2 16,0 11 Сульфаты, мг/дм3 56 49 61 48 60 57 12 Микробиологический тест, кол./мл - - - - - - 13 Скорость коррозии, мм/год 0,10 0,16 0,17 0,09 0,12 0,15 3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 3.1. Усовершенствование метода водоподготовки производства этилбензол-стирола реагентами фирмы «Nalco» Вода является основным охлаждающим агентом, используемым во всех отраслях ...
... ходом процесса. Через 3 минуты внесите в одну из пробирок раствор хлорида натрия. Что вы наблюдаете? Проведите анализ опытов а) и б). Глава 2. Методика изучения растворов. Теория растворов – одна из ведущих теорий курса химии. Причины важности темы кроется не только в том, что она имеет большое практическое значение, но и прежде всего ...
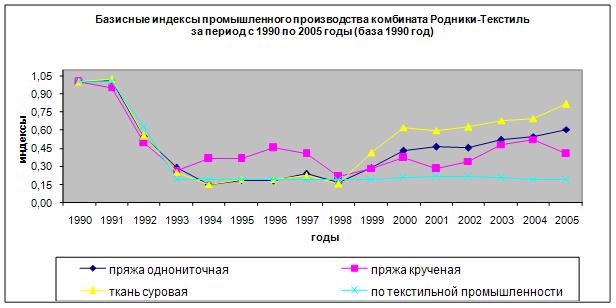
... 145 761 138 892 162 142 169 012 дек.05 169 012 147 915 166 203 187 300 2. МАРКЕТИНГОВАЯ, ПРЕДПРИНИМАТЕЛЬСКАЯ И КОММЕРЧЕСКАЯ ДЕЯТЕЛЬНОСТЬ ОАО «РОДНИКИ - ТЕКСТИЛЬ» 2.1 Анализ конкурентов Конкуренция - состязательность хозяйствующих субъектов, когда их самостоятельные действия эффективно ограничивают возможность каждого из них односторонне воздействовать на общие условия обращения ...
... из темного стекла, закрывают корковой пробкой с хлоркальциевой трубкой и хранят в темном месте, так как на свету в нем образуются перекиси, вызывающие взрывы. ЭКСПЕРТИЗА РЫБЫ И РЫБНЫХ ПРОДУКТОВ Рыбу и рыбную продукцию принимают по количеству и качеству партиями. Партией считается определенное количество продукции одного наименования, способа обработки и сорта, одного предприятия-изготовителя, ...
0 комментариев