Навигация
8.4 Диагностика
Бактериологическая диагностика основана на обнаружении лептоспир в исследуемом материале путем микроскопии или выделения культур. Она складывается из следующих этапов: микроскопия в темном поле микроскопа, выделение культур лептоспир путем посева присланного материала от сельскохозяйственных животных или органов, зараженных этим материалом, лабораторных животных (биопроба) на специальные питательные среды, идентификация и дифференциация выделенных культур.
Одним из самых быстрых, простых и доступных для выполнения в практических условиях методов бактериологической диагностики является микроскопическое исследование. Микроскопию свежевыделенной мочи, околосердечной жидкости, грудного и брюшного экссудата, а также крови и суспензий паренхиматозных органов проводят в темном поле микроскопа. Морфология и характер движения лептоспир – настолько типичны, что в случае их обнаружения дается право ставить окончательный диагноз.
– Морфология
Клетка спирохеты имеет цилиндрическую извитую форму, содержит цитоплазму, отграниченную цитоплазматической мембраной, снаружи которой расположена клеточная стенка со слабовыраженным пептидогликановым слоем. Патогенные спирохеты имеют длину 3–20 мкм и толщину 0,1–0,5 мкм. Представители отдельных родов различаются по длине и толщине, числу и характеру завитков (табл. 2; рис. 21). Спирохеты грамотрицательны. Боррелии в отличие от трепо-нем и лептоспир хорошо окрашиваются анилиновыми красителями. Морфологию трепонем и лептоспир изучают путем микроскопии живых микроорганизмов в препаратах «раздавленная» или «висячая» капля в темнопольном или фазово-контрастном микроскопе, а также в мазках, окрашенных по Романовскому–Гимзе или специальными методами, например серебрением.
Лептоспиры различных серологических групп имеют одинаковые морфологические свойства. В препарате «раздавленная капля» в темном поле микроскопа лептоспиры имеют вид тонких серебристо-белых нитей с нежной спиральной структурой. Длина их 5–18 мкм, диаметр 0,05–0,14 мкм. Лептоспира имеет тонкую ригидную центральную осевую нить, вокруг которой равномерными завитками обвита цитопламатическая спираль. Тело лептоспиры, состоящее из правильных, почти соприкасающихся завитков спирали, постепенно утончается к концам, которые в большинстве случаев загнуты под углом и имеют пуговчатые утолщения (рис. 8). Помимо первичных завитков у лептоспир обнаруживают более крупные вторичные завитки, обусловливающие изгибы ее тела, вследствие чего микроорганизмы приобретают форму букв S, С, X. В старых культурах преобладают более длинные особи. Установлено наличие фильтрующихся форм лептоспир. Осевая нить служит органом движения. Характерная подвижность, лептоспир является их диагностическим признаком. Лептоспиры плохо окрашиваются анилиновыми красками, но хорошо импрегнируются серебром по методу Лёвадити.
Живые бактерии в жидких средах способны быстро перемещаться (прямолинейно, по кругу или вращением на месте). В полужидких субстратах их движения приобретают змеевидный характер. Периодически они становятся неподвижными, похожими на петлю веревки.
ЛС проявляют хемотаксис по отношению к веществам с повышенной вязкостью, гемоглобину и т.д. Сахара оказывают противоположный эффект и даже снижают их подвижность
Структура клетки лептоспир.
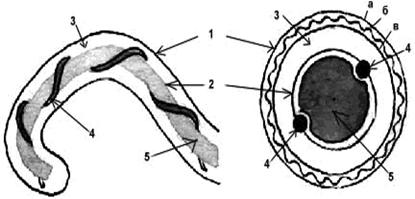
Обозначения: 1-наружная мембрана; 2-периплазматический цилиндр; 3-жгутик: - 1-наружная мембрана (а, б, в-ее слои); - 2-внутренняя мембрана; 3-периплазматическое пространство; 4-жгутики; 5-цитозоль
Структура клеточной стенки лептоспиры аналогична таковой других спирохет. 3–5-слойная наружная мембрана окружает протоплазматический цилиндр, покрытый гибким пептидогликановым слоем, тесно ассоциирванным с внутренней цитоплазматической мембраной, как у грамположительных бактерий. В этих слоях отсутствуют гликолипиды. В пептидогликане преобладает орнитин, а не диаминопимелиновая кислота, как считалось ранее.
Наружная мембрана лептоспиры весьма необычна, поскольку является самой жидкой из известных на сегодняшний день. Находящиеся в ней наружные мембранные протеины при движении всегда (даже при изменении направления) смещаются в задний конец клетки. Скорость дрейфа антигенов в мембранах приблизительно составляет 11 мкм/сек.
Оболочка клетки окружает так называемый «протоплазматический цилиндр». Благодаря укорочению закрученных вокруг него осевых нитей последний имеет винтообразную форму.
Два жгутика (осевые нити) диаметром 20–30 нм локализуются в периплазматическом пространстве между наружной мембраной и пептидогликановым слоем оболочки. Их свободный конец уже внутриклеточного. Аксиальная нить состоит из сердцевины диаметром 11,3 мкм, окруженной 2 мембранными слоями толщиной 21,5 и 42 микрон. Она прикрепляется крючком к базальному тельцу на противоположном конце периплазматического цилиндра и идет вдоль оси клетки приблизительно до ее центра. Аксиальные нити не перекрываются между собой, как это имеет место у других спирохет. Структура базальных телец жгутиков такая же, как и у других грамотрицательных бактерий. Аксиальные нити обеспечивают движение и сохранение лептоспир своей формы. В культурах лептоспиры нередко образуют клубки, а по мере старения в них появляются дегенирирующие формы с атипичной морфологией.
Прохождение на питательных средах более 20 пассажей ведет к изменению морфологии лептоспир – увеличению длины и количества завитков спирали, а также уменьшению количества электронно-прозрачных протоплазматических включений.
– Культуральные свойства
Лептоспиры являются аэробами, их культивируют на средах слабощелочной реакции (рН 7,2–7,4) при 24 – 28 °С. Культивирование лептоспир связано с определенными трудностями, обусловленными их низкой способностью к размножению в жидких, полужидких и особенно на плотных искусственных питательных средах. На простых питательных средах лептоспиры не растут. Для их культивирования наиболее часто используют жидкие среды Любашенко, Терских, Ферворт – Вольфа, содержащие 5–10% сыворотки крови кроликов, а также среду ГНКИ с альбумином. Максимальное накопление биомассы лептоспир отмечается по истечении 5–7 сут. культивирования, при этом вид питательных сред не изменяется.
Патогенные лептоспиры являются аэробными (часто микроаэрофильными) спирохетами. In vitro при хорошей аэрации, pH 7,2–7,4 и оптимальных условиях инкубирования (температуре 28– 30°C для большей части сероваров и 30–32°С для L.canicola) они культивируются намного лучше, чем другие спирохеты. Границы температуры инкубации посевов, в пределах которых возможен рост лептоспир, составляют 22–37°С.
Для нормального роста они нуждаются в липидах и ненасыщенных жирных кислотах, а также витаминах В1 и В12. Наличие белка в питательной среде для лептоспир не обязательно. Из числа аминокислот только аспарагин оказывает на них стимулирующее действие. Его можно заменить полисорбатами. Обработка твина поливинилпирролидоном устраняет его токсичность для лептоспир. В средах без протеина, но с обработанным этим способом твином урожай лептоспир достигает 108 кл/мл. Неплохой альтернативой твину-80 является пируват натрия, который добавляют в среды в концентрации 100 мкг/мл. Наличие в субстрате сахаров угнетает их рост.
Наиболее интенсивно лептоспиры растут на жидких и полужидких питательных средах с 5–10% сыворотки крови кролика или барана (вместо сыворотки часто применяют сывороточный альбумин). Время развития одной генерации лептоспир в логарифмической фазе составляет 58–68 ч, поэтому максимальный рост наблюдают на 5–10 дн.
Классической питательной средой для лептоспир является среда Ногуши-Веньона. Наибольшее распространение в работе с ними получили жидкие (Уленгута, Ферворта-Вольфа в модификации Тарасова, Кортхофа и др.) и полужидкие (Флетчера и др.) агаровые среды (ПРЛ 10:2).
На жидких средах эти спирохеты растут медленно – максимальный урожай бактерий обычно получают на 5–10 дн культивирования. При микроскопировании препаратов культур в этот период в одном поле зрения (окуляр х10, объектив х40) обычно обнаруживают около 100 подвижных бактерий. Культуры лептоспир в жидких средах бесцветны, не имеют запаха, при бурном росте опалесцируют. Опалесценция лучше видна в проходящем свете при легком встряхивании пробирки.
В полужидких средах на 1,5-2 см ниже поверхности появляется помутнение в виде кольца, интенсивность которого усиливается по мере роста лептоспир. В средах с 1% агара эти бактерии формируют преимущественно заглубленные колонии, контуры которых могут быть четкими или размытыми. Тенденция к заглубленному росту (феномен Дингера), обеспечивающая некоторое ограничение доступа кислорода, свидетельствует о микроаэрофильности лептоспир.
В средах с 2% агара лептоспиры образуют поверхностные колонии, имеющие разную степень прозрачности вплоть до трудно различимых при обычном освещении. Пассирование изолятов in vivo повышает частоту образования такого типа колоний, в то время, как многократные пересевы in vitro способствуют усилению заглубленного роста. Чем чаще делают пересевы, тем быстрее получают пышный рост культур.
Фосфомицин (400 мкг/мл) в сочетании с 5-флуорацилом (100 мкг/мл) при добавлении в среду ингибируют размножение посторонней микрофлоры, не влияя на рост лептоспир. Это позволяет использовать их в селективных средах. В качестве селективных компонентов сред применяют также мочевину, соли кобальта и антимикробные препараты (неомицин, рифампицин, фурацилин, фурагин, налидиксовую кислоту, комбинации рифампицина, полимиксина В, бацитрацина и актидиона.
В процессе хранении музейных штаммов лептоспир их пересевают не реже 1 раза в месяц. Для длительного хранения культуры заливают слоем стерильного вазелинового масла или запаивают в ампулы, что предупреждает испарение среды и изменение ее рН.
Патогенные лептоспиры в процессе культивирования in vitro постепенно утрачивают свою вирулентность. Последнюю часто удается восстановить посредством заражения чувствительных животных, например, молодых морских свинок (36).
– Биохимические свойства
Лептоспиры – хемоорганотрофы с дыхательным типом метаболизма. Повышенная чувствительность к солям синильной кислоты, а также результаты спектроскопических исследований свидетельствуют об участии в их дыхании цитохромной системы. Они оксидазонегативны, но каталазо- и / или пероксидазопозитивны.
Эти микроорганизмы проявляют выраженную аминопептидазную активность при отсутствии протеолитических свойств. По механизмам синтеза изолейцина разные лептоспирs различаются, что дает основание для разделения их на 3 класса.
• Микроорганизмы класса 1 осуществляют это обычным треониновым путем,
• Представители класса 3 – уникальным (пируватным) способом,
• Остальные лептоспиры, вошедшие в класс 2, обоими способами.
Лептоспиры способны утилизировать азот из мочевины, креатинина и саркозина, что протекает под контролем ферментов микроорганизмов – аланин дегидрогеназы, глютамат дегидрогеназы и глютамат пируват трансаминазы.
В клетках лептоспиры обнаружены следующие липидные компоненты: свободные жирные кислоты (41,8%), мажорный фосфолипид (14,8%), фосфатидилэтаноламин (12,9%), эфир холестерина (CE) (9,3%), липофосфатидилэтаноламин (4,9%) и дифосфатидилглицерин (1,1%). Свободные жирные кислоты представлены гексадеканоиковой (26,9%), гексадеценоиковой (15,4%), октадеценоиковой (26,5%) и октадекадиеноиковой (27,4%) кислотами. В состав мажорного фосфолипида входят тетрадекадиеноиковая (53,6%), тетрадекатриеноиковая (14,0%) и октадектадеканоиковая (13,8%) жирные кислоты. Фосфолипид с полиненасыщенными жирными кислотами и 14 атомами углерода в молекуле выявлен только у вирулентных штаммов и отсутствует у авирулентных.
– Биопроба
Лептоспиры могут быть выделены из патологического материала посредством его инокуляции лабораторным животным: кроликам-сосунам, золотистым хомячкам, степным пеструшкам (10–30-дневного возраста) и сусликам, поскольку перечисленные животные в равной степени чувствительны к возбудителям как «желтушных», так и «безжелтушных» лептоспирозов. Другие виды лабораторных животных проявляют неодинаковую чувствительность к разным сероварам лептоспир. Молодых морских свинок и белых мышей (массой 10–14 г.) используют при подозрении на инфекцию серовара icterohaemorrhagiaee.
Гепаринизированную кровь, мочу, спиномозговую жидкость или суспензию гомогената внутренних органов подозреваемой в заражении ЛС собаки, а также тестируемые корма и воду вводят лабораторным животным подкожно, через скарифицированную кожу, закапыванием в глаза, внутрибрюшинно, внутривенно, интракардиально и перорально.
У молодых кроликов, золотистых хомяков и сусликов инфекция «желтушных» и «безжелтушных» лептоспир вызывает развитие таких же клинических и патоморфологических изменений, как и у других видов лабораторных животных при инфекции L.icterohaemorrhagiaee. После инкубационного периода, составляющего в зависимости от патогенности штамма агента от 2 до 7 дн (реже более) температура тела поднимается до 39–41°С, животные отказываются от корма и быстро теряют в весе. У них развивается инъекция сосудов склеры глаз. На 2–5 дн клинической стадии инфекции на фоне резкого истощения температура их тела снижается ниже нормы, появляется желтушность склеры глаз, видимых слизистых оболочек и кожи. Усиленно выпадают волосы. Заболевшие животные в большинстве случаев погибают на 4–12 дн после заражения.
На их вскрытии обнаруживают желтушность тканей, особенно подкожной клетчатки, кровоизлияния во внутренних органах, коже, подкожной клетчатке, которые наиболее интенсивны в паховой и подмышечной областях. Типичны крупноточечные кровоизлияния в легочной ткани, которые выделяясь на общем ишемическом фоне придают легким сходство с крыльями бабочки. В печени находят красновато-желтые некротические очаги. В следствии острого нефрита почки увеличены, надпочечники гиперемированы.
В течение инкубационного периода и всей клинической стадии инфекции лептоспиры циркулируют в крови животного. С появлением желтухи их обнаруживают во внутренних органах (особенно часто в печени).
В ходе биопробы по рекомендациям ВОЗ за подопытными животными ведут следующие наблюдения:
1) определяют массу тела до опыта и ежедневно в течение всего эксперимента;
2) у крупных животных (кроликов, морских свинок) дважды в сутки измеряют ректальную температуру. При ее повышении проводят микроскопию на наличие лептоспир брюшного эксудата. Его собирают стерильной пастеровской пипеткой через надрез кожи, сделанный выше пупка (для избежания травмы мочевого пузыря);
3) высевают взятую из сердца кровь в пробирки с питательной средой. За выжиывшими животными ведут наблюдение в течение 1 мес, а затем подвергают эутаназии. Высевают на питательные среды гомогенат коркового слоя почек и проводят его микроскопическое исследование с целью обнаружения лептоспир. Кровь из сердца исследуют на наличие специфических антител в РАЛ.
Для обнаружения патогенных лептоспир в воде и иле водоемов пользуются методом Аппельмана-ван Тиля, сущность которого состоит в купании в течение 1 ч морских свинок со скарифицированной на площади в 10–20 см2 кожей брюшка. Кожу скарифицируют после удаления волос нанесением скальпелем продольных и поперечных штрихов. За животными ведут наблюдение по общим правилам. В связи с легкостью клинического течения лептоспироза у морских свинок, вызванного «безжелтушными» штаммами агента, независимо от состояния животных проводят посевы на питательные среды из крови сердца с 4–5 по 20 дн после заражения и микроскопирование брюшного эксудата.
В случае получения сомнительных результатов биопробы, что может иметь место при плохой сохранности поступившего для исследования патологического материала, низкой патогенности тестируемого штамма лептоспир или вследствии низкой заражающей дозы, прибегают к проведению 1–2 последующих пассажей на лабораторных животных.
– Идентификация вирулентных лептоспир
Патогенные и сапрофитные изоляты лептоспир дифференцируют по результатам биопробы, чувствительности к 8-азагуанину, бикарбонату натрия, солям меди, нитрату серебра, кобальту, сулеме и литию, гемолитической и липазной активности, солевой и температурной толерантности, суммарному содержанию гуанина и цитозина в ДНК.
Вирулентность входящих в состав сероваров штаммов лептоспир варьирует в широких пределах. Поэтому чрезвычайно важным представляется поиск маркеров их вирулентности на штаммовом уровне. 1 из таких маркеров может служить белок с мМас 30кД, входящий в состав гликолипопопротеина вирулентных штаммов лептоспир. У авирулентных штаммов вместо него экспрессируется белок с мМас 20 кД (40). Установлено также, что синтез трансмембранного наружного мембранного протеина у авирулентных штаммов происходит значительно интенсивнее, чем у вирулентных штаммов ЛС, а протеины с мМас 45 и 32–34 кД, наоборот, являются маркерами вирулентности этих спирохет.
– Серотипирование
Разделение лептоспир на серогруппы осуществляют по результатам перекрестной реакции агглютинации-лизиса (РАЛ). Деление серогрупп на серовары проводят в тесте адсорбционной агглютинации (РАА), с помощью антисывороток, моноклональных антител, рестрикционного эндонуклеазного анализа и ПЦР.
Моновалентные антисыворотки к серогруппам и сероварам получают иммунизацией кроликов культурами соответствующих штаммов лептоспир. Перекрестную РА ставят со всеми известными серогруппами и сероварами лептоспир. Сравнение величины титров агглютинации-лизиса музейных и тестируемого штаммов лептоспир моновалентными антисыворотками позволяет установить степень родства между ними. В случае, когда тестируемый изолят не проявляет серологического родства с музейными штаммами лептоспир, его определяют как оригинальный серовар.
РАА основана на адсорбции агглютинирующих антител из моновалентных сывороток формалинизированным бактерином музейного и тестируемого штаммов лептоспир. Их выращивают в жидкой среде с полисорбатом-80 и бычьим сывороточным альбумином при температуре 29 °C. Антиген готовят из 4–8-дневных культур. Смесь (1:9) антисыворотки с титром не более 1:3000 и сконцентрированного центрифугированием в 60–70 раз антигена выдерживают при температуре 37 °С в течение 18 ч, центрифугируют (30 мин при 10000 об/мин) и тестируют в РАА. Снижение первоначального титра сыворотки соответствует ее истощению тестируемым штаммом. Перекрестную реакцию с истощенными сыворотками ставят по обычной схеме в ряде возрастающих разведений (1:100, 1:500 и т.д.).
Оценку результатов проводят по следущим критериям:
а) при идентичности музейного и тестируемого штаммов они полностью сорбируют антитела из гомологичной и гетерологичной антисывороток;
б) сравниваемые штаммы относят к разным серотипам, если 10% или более гомологичного титра антител обнаруживается в каждой из 2 (гомологичной и гетерологичной) истощенных сывороток;
в) сравниваемые штаммы относят к разным подтипам одного серотипа, когда 1 антисыворотка после истощения гетерологичным штаммом сохраняет менее 10% гомологичного титра, а другая -10% или более гомологичного титра.
– Серологическая диагностика
Лептоспироз может быть диагностирован также на основании обнаружения высоких титров специфических антител или сероконверсии. Кроме того, серологические тесты применяют для контроля экспериментальной инфекции лабораторных животных и типирования выделенных изолятов лептоспир. Они позволяют поставить диагноз на лептоспироз в вариабельные сроки после начала болезни, определяемые динамикой антител, выявляеых используемым тестом. Специфические агглютинины и лизины обычно появляются в крови не ранее 7–8 дн после начала болезни.
Наличие противолептоспирозных антител в крови ранее прививавшихся и переболевших лептоспирозом собак не позволяет интерпретировать однократно полученные положительные результаты серологического исследования. Поэтому требуется повторное серологическое исследование больного животного через 3–5 дн и более отдаленные сроки. Диагностическим считается установление 4-кратного изменения титра сывороточных антител при тестировании парных проб сыворотки крови. Необходимо иметь в виду, что у подвергавшихся антибиотикотерапии собак процесс образования антител к лептоспирам может быть заторможен по времени и интенсивности. Антитела к лептоспирам персистируют в крови собак в течение многих месяцев, а порой даже лет. У хронически инфицированных лептоспирозом животных титры специфических антител могут снижаться ниже уровня, выявляемого рутинными методами серологической диагностики.
Для серологической диагностики лептоспироза применяют различные варианты РА (РАЛ, макроагглютинации, микроскопической аггглютинации, РЛА), РСК и ЭЛИЗА.
Реакция Агглютинации (РА)
Для постановки РА необходим набор живых культур патогенных для животных сероваров лептоспир, циркулирующих на данной территории. Важнейшими факторами, определяющими специфичность РА, являются чистота и идентичность антигенов. Последнюю контролируют в лабораториях не реже 2 раз в год с применением гипериммунных кроличьих антисывороток или моноклональных антител. Чистоту антигенов лептоспир регулярно проверяют посевами на кровяной агар или тиогликолевый бульон.
Музейные культуры лептоспир можно хранить в жидком азоте при -70 °C или в лиофилизированном виде. Частые пересевы на жидких средах нередко ведут к потере ими антигенности. В таком случае вновь возвращаются к работе с музейным штаммом.
Основными недостатками РА при лептоспирозе являются значительные затраты времени и труда на ее постановку, необходимость применения большого количества антигенов лептоспир разных серогрупп, вариабельность качества используемых живых лептоспирозных антигенов, потенциальную опасность заражения проводящих серологическое исследование специалистов (при использовании в качестве антигена живых культур лептоспир), субъективность оценки результатов, возможность перекрестных реакций сероваров, относящихся к разным серогруппам и недостаточно высокую чувствительность (например, при исследовании животных, выделяющих возбудителя с мочой, но не имеющих выраженного антительного ответа). Последнее связано с динамикой IgM-агглютининов (IgG в РА не выявляют). Разработано несколько описанных ниже вариантов теста.
1. РАЛ
Со времени разработки Мартином и Петтитом в 1918 г. этот тест остается «золотым стандартом» серологической диагностики лептоспироза (ПРЛ 10:3.1). Для получения антигена для РАЛ используют 7–10-дневные культуры лептоспир, выращенные на жидких питательных средах и имеющие пышный рост (не менее 50 лептоспир в поле зрения без спонтанной агглютинации и примесей).
Агглютинация проявляется склеиванием лептоспир в агломераты, размер которых может варьировать от 3–5 бактерий до огромных шаров, занимающих несколько полей зрения микроскопа. Лизис сначала проявляется образованием зернистости у одиночных и агглютинированных лептоспир. Затем бактерии постепенно теряют подвижность и фрагментируются, превращаясь в скопление аморфных зернистых образований. Агглютинация и лизис протекают в первых разведениях сыворотки одновременно, но по мере увеличения разведения сыворотки начинает преобладать агглютинация так, что в конечных разведениях лизис отсутствует).
Специфические агглютинины появляются в крови через 7–10 дн после заражения. У непривитых животных в этот период титр агглютининов обычно невысок (1:100 – 1:200), но в последующем он быстро возрастает до 1:400 и выше, что считают диагностическим уровнем. Обычно к концу второй недели болезни титр антител повышается в 15–40 раз и выше. На этом уровне он сохраняется несколько недель. В последующем отмечают тенденцию постепенного его снижения. На острой стадии инфекции отмечают 4-кратное повышение титра агглютинирующих антител к лептоспир при тестировании парных проб сывороток. Однако при исследовании этим тестом сыворотки хронически больных животных могут быть получены отрицательные результаты из-за низкого титра специфических агглютининов.
При оценке результатов теста необходимо принимать во внимание большую продолжительность персистенции агглютининов у многих переболевших и привитых, а также возможность отсутствия сероконверсии у части инфицированных животных. Стабильные титры антител 1:200 -1:400 выявленные в крови с интервалом в 1–2 нед скорее свидетельствуют о ранее перенесенном заболевании или лептоспироносительстве, чем о текущей инфекции. 4-кратное повышение титра антител считают доказательством последней.
Поскольку на динамику антительного ответа большое влияние оказывает интенсивность репродукции ЛС в организме животного, то первое серологическое исследование необходимо проводить до начала антибиотикотерапии и введения противолептоспирозных антисыворотки /Ig. В случаях неспецифической реактивности пробы сыворотки крови исследуют повторно после обработки 2-меркаптоэтанолом.
В РАЛ может быть тестирована также моча подозреваемых в заболевании лептоспирозомживотных. Однако результаты такого исследования носят ориентировочный характер, поскольку титр специфических антител в моче обычно не превышает 10% титра сывороточных антител.
Похожие работы
... внешней среды, инфицированных патогенными неспоровыми микробами. 5. Мероприятия по оздоровлению неблагополучных хозяйств Общие мероприятия 5.1. При выявлении в хозяйстве (на ферме, в отделении, стаде, свинарнике и т.д.) больных лептоспирозом животных или животных – лептоспироносителей ветеринарный специалист, обслуживающий хозяйство, немедленно сообщает об этом руководителю хозяйства, главному ...
... зверей – чуму (кишечная форма), инфекционный гепатит, парвови-русный энтерит и сальмонеллез, а также кормовые отравления. Иммунитет, специфическая профилактика Переболевание лептоспирозом сопровождается формированием вначале нестерильного, а затем (по окончании срока лептоспироносительства) стерильного иммунитета высокой специфичности, напряженности и значительной продолжительности. Для ...
... - зернистая и жировая дистрофия. В почках - некротические изменения в эпителии почечных канальцев. В легких - геморрагические инфаркты. 8. Диагностика Диагноз на лептоспироз подтверждается результатами бактериологического, серологического и гистологического исследований с обязательным учетом эпизоотологических, эпидемиологических, клинических и патологоанатомических данных. Благополучным по ...
... больного, как правило, улучшается. С появлением желтухи появляется геморрагический синдром разной степени выраженности, и вовлекаются в процесс почки (нарастают явления ОПН). Рецидивы болезни наблюдаются у 30% больных. Иногда при лептоспирозе отмечается появление розеолезной, папулезной, и даже эритематозной сыпи в третий период болезни, когда образуются комплексы, которые могут откладываться в ...
0 комментариев