Навигация
Теплоємність
5. Теплоємність
Під питомою теплоємністю або просто теплоємністю розуміють кількість теплоти, яку можна надати (або відняти) одиниці речовини (1 кг,1 м3 , 1 кмоль), щоб змінити його температуру на 10 С.
Тепломісткість тіла, яка відповідає безконечно малій зміні температури, називається істинною теплоємністю:
![]()
Теплоємність тіла, яка відповідає зміні температури на кінцеву величину називається середньою теплоємністю.
![]() .(5.2)
.(5.2)
Якщо теппоємшсть відноситься до 1 кг газу, таку теплоємність прийнято називати мас овою теплоємністю і позначати буквою с.
Тегпоємність 1 м3 при нормальних умовах називають об 'ємною теплоємністю, позначаєтьсясґ, Дж/м3К.
Тегпоємність 1 кмоля тіла називається мольною теплоємністю мс,![]()
Із цих визначень витікає настугний зв'язок:
![]()
![]()
Оскільки теплота залежить від процесу, то теплоємність є функція процесу.
Тегпоємність в ізохорному процесі позначають з індексом v, в ізобарному з індексом p.
Наприклад:
мсv - мольна середня теплоємність при постійному об'ємі, ізобарна та ізохорна теплоємність зв'язані між собою рівнянням Майєра.
cр=сv+R (5.4)
Відношення теплоємностей позначається буквою к і називається показником адіабати.
![]() (5.5)
(5.5)
Для одноатомних газів к=1,67, двоатомних -к=1,4, трьохатомних -к=1,29.
Для визначення теплоємності газової суміші необхідно зніти склад газовоїсумішіі теплоємності компонентів.
Очевидно, що для збільшення температури газової суміші на 1° необхідно збільшити на 1° температуру кожного газу суміші.
На нагрів кожного газу в суміші необхідна кількість тепла рівна ciMi
де сі, -теплоємність і-го елементу;
Мі, - маса і-го елементу.
Тоді
![]() (5.6)
(5.6)
де Мт - маса суміші;
ст -теплоємність суміші.
Після ділення лівої і правої частини на Мт одержимо:
![]() (5.7)
(5.7)
Якщо склад суміші заданий об'ємними долями, то об'ємну теплоємність суміші можнавизначитиза формулою:
![]() (5.8)
(5.8)
де с, -об'ємна теплоємність к-го газу, який входить в суміш. Мольна теплоємність суміші:
![]() (5.9)
(5.9)
6. Ентропія
Якщо в рівнянні першого закону термодинаміки (1.17) ліву і праву частину поділити на Т, одержимо:
![]()
Як буде показано далі, для ідеального газу du=cvdT![]() рівняння стану ідеального газу можна представити, як
рівняння стану ідеального газу можна представити, як![]() .
.
Тоді
![]()
Вираз ![]() при врівноваженому стані є повний диференціал деякої функії
при врівноваженому стані є повний диференціал деякої функії
стану, яка називається ентрогіоо, для одного кілограму газу позначається через s і вимірюється в Дж/(кг∙К).
![]() (6.1)
(6.1)
Подібно любій іипій функції стану ентропія може бути представлена в вигляді функції любих двох параметрів стану:
s=ƒ(p,v) s=ƒ(p,T) s=ƒ(T,v)
Значення ентр олії для з ад аного ста ну визначаєть ся інтегру ванням рівняння
![]()
де s0 -константаінтегрування.
При температурах, близьких до абсолютного нуля, всі відомі речовини знаходягьсяв конденсованому стані.
В Нернст (1906р) експериментально встановив, а МПланк (1912р) повністю сформулював наступний принцип: при температурі, яка прямує до абсолютного нуля, ентропія речовини, яка знаходиться в конденсованому стані з впорядкованою кристалічною структурою прямує до нуля. s0 = 0 при Т = 0 К.
Цей закон називається третім законом термодинаміки або тепловою теоремою Нернста.
7. Ексергія
Для оцінки ефективності термодинамічних машин необхідно знати, яку максимальну роботу можна одержати. Очевидно, що максимальна кількість роботи буде одержана при оборотному переході робочого тіла із початкового стану р1,Т1 в кінцевий стан ро,То, який знаходиться в рівновазі з навколишнім середовищем.
Тика максимальна робота одержала назву- ексергія.
Ексергія речовини є максимальна робота, яку може виконати робоче тіло в оборотному процесі з навколишнім середовищем в якості джерела дармової теплоти, якщо в кінці ц»ого процесу всі враховані в ньому види матерії переходять в стан термодинамічної рівноваги зі всіма компонентами
навколишнього середовища.
Види ексергії. Ексергія ділиться на два основних види: ексергія видів енергії, яка не характеризується ентропією, дггя якої вона рівна самій енергії е=Е (механічна, електрична та інш.) і ексергія ввдів енергії, які характеризуються ентропією (внутрішня енергія, енергія випромінювання, термомеханічна, нульова).
Ексергія останніх ввдів енергії поділяється на ексергію речовини в замкнутому об'ємі, ексергію потоку речовинні ексергію потоку енергії Ексергія речовини в замкнутому об'ємі еv розглядається в закритих системах. Визначимо максимальну роботу, яку може здійснити речовина з початковими параметрами Р, v Т, u, h, s прн оборотному переході в рівновагу з навколишнім середовищем, яке має параметри Р0, v0 Т0, u0, h0, s0 Дня того, щоб речовина прийшла в рівновагу з навколишнім середовищем, необхідно змінити її внтршню енергію за рахунок підведення (або відведення) донеї теплоти або за рахунок виконаннянею роботи
В оборотному процесі підведення теплоти до речовини проходить прн постійній температурі, рівній температурі навколишнього середовища. Тоді ексергія речовини в замкнутому об'ємі dev ,буде рівна роботі dl зменшеній на роботу, яку необхідно затратити на подолання тиску навколишнього сер ед овищ а podv,
dev =δl- podv = δq-du- podv,
або після інтегрування
еv=c-s)-(U0U)- p0(v0-v)=(u0-u)- v-s)+p0(v0-v)
Рівняння можна записати так
еv=u- T0s+ p0v+e0 (7.1)
де
ео=u+T0s0-p0v0=сопst,
і відповідно, є параметром стану речовини і середовища - ексергатичною функцією.
Дня визначення термомеханічної ексергії потоку речовини необхідно знайти максимальну роботу його гри оборотному переході від даного стану, який характеризуєтьсяпараметрамир, p, v Т, u, h, s до врівноваженого стану, тобто з парам етра p0, v0 Т0, u0, h0, s0
Ця робота буде рівна роботі рv мінус робота p0v затрачена на подолання тиску середовища,
рv- p0v= v(p-p0)
Відповідно, ексергія потоку речовини
е= еv+ v(p-p0)
Підставляючив рівняння значення еv, одержимо
e=(u+pv)- T0s-v+T0s0+ p0v
e=h- T0s+ ео (7.3)
де ео= u0+ T0s0- p0v0. (7.4)
Нульова ексергія е0 зв'язана із встановленням рівності хімічних потенціалів між відповідними компонентами речовини і гввколишнього середовища і вимірюється кількістю роботи, яка може бути одержана в оборотному процесі встановлення рівноваги компонентів речовини із відповідними компонентами навколишнього середовища.
Ексергія теплового опотоку q розраховується за рівнянням
![]() (7.5)
(7.5)
де tві=1 -(То/Т)- називається ексергетичною температурною функцією.Зокрема при Т=іdет іτв=1 формула (7 5) буде мати вигляд.
Функція τв має універсальне значення вона придатна для оцінки максимальної роботоздатності в кругових і розімкнутих термодинамічних процесах.
Зміна ексергії потоку робочого тіла в ізобарному процесі рівна ексергії еq зв'язаногоз цим процесом теплового потоку.
Ексергія випромінювання eе визначається максимапьнолю роботою, яка може бути виконана в оборотному процесі приведення цього випромінювання в стан рівноваги з навколишнім середовищем
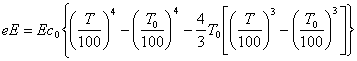
де Е - степінь чорнотиповерхн;
С0 - коефіцієнт випромінювання абсолютно чорного тіла.
Похожие работы
... мислення, сприяє формуванню творчого відношення до праці, вчить бережливому відношенню до матеріалів, енергії, техніки, сировини, готових продуктів праці. Загальнотехнічна підготовка є ланкою між політехнічною освітою та спеціальною частиною професійно-технічної навчання і покликана озброїти тих, що навчаються системою знань загальних основ техніки, технології та організації виробництва і праці ...
... д. цих циклів менший від термічного к. к. д. циклу Карно. Відомо, що під час досліджень термодинамічних процесів умови, за яких вони відбуваються, беруть ідеальними. Розглянемо ідеальні термодинамічні цикли двигуна внутрішнього згоряння. Припустимо, що: 1) кількість і склад робочого тіла в циклі не змінюються; 2) процеси згоряння палива і вихлоп газу замінено підведенням та відведенням теплоти ...
... вивчення. Для зменшення числа програм у розумних межах і упорядкування їхнього змісту доцільно групувати професії, підготовлювані в середніх профтехучилищах, на основі спільності предметів. Аналітичний розгляд вимог виробництва до загальнотехнічної підготовки молодих робітників — перший крок по шляху кваліфікації професій у залежності від сполуки загальнотехнічних предметів і їхнього основного ...
... факторів, як технічний рівень виробництва й рівень організації праці. Як показує проведений аналіз, підвищення продуктивності праці в ЦГПТЛ протягом І півріччя відбувалося під впливом як екстенсивних, так і інтенсивних факторів. 3.2.2 Продуктивність праці в мартенівському цеху комбінату «Запоріжсталь» Головним показником, що характеризує роботу мартенівської печі, є її продуктивність. Під ...
0 комментариев