Навигация
Tм =
2 tм =
3 Рбар=
Обробка результатів спостережень
За показами психрометра t і tм знаходимо початкову точку 0. Піднімаємось за вертикаллю до ізотерми t1, яка відповідає температурі повітря за калорифером, і дістаємо точку 1 /рис.2.3/.
Точка 2 повинна лежати на ізотермі t2 і перебуватиме на одній вертикалі з точкою 3, тому що за сушильною камерою вологе повітря лише охолоджується. Точку 3 знаходимо аналогічно точки 0 за показами термопар t3 і tм4 . Піднімаючись від точки 3 за вертикаллю до ізотерми t2 , визначаємо положення точки 2.
З’єднавши точки 2, 3 прямими лініями, дістанемо три процеси, що відбуваються з повітрям в установці: 0-1 – нагрів повітря в калорифері; 1-2 – зволоження його в сушильній камері; 2-3 – охолодження повітря за сушильною камерою (рис.2.3).
Парціальний тиск сухого повітря у вологому повітрі приміщення, Па:
Рс.п = Рб - Рп ,
де Рп – визначаємо за Нd- діаграмою.
Масова витрата сухого повітря через установку, кг/с:
Мс.п = Рс.п V / (Rс.п T0) ,
де V – об’ємна витрата повітря, м3/с; Rс.п – питома газова стала сухого повітря, Дж/(м·К); То – абсолютна температура повітря в приміщенні / точка 0 /, К.
Потужність теплового потоку, який витрачається на нагрів повітря в калорифері, кВт:
Qк = (H1-H0)Mс.п ,
де H1, H0 - ентальпія вологого повітря відповідно після калорифера і перед ним, кДж/кг Мс.п - потужність нагрівача, кВт:
Q = 0,001W .
ККД калорифера, %:
ηк = 100 Qк / Q
Потужність теплового потоку, який втрачається при охолодженні повітря в процесі 2-3, кВт:
Qохол = (Н2-Н3) Мс.п .
Продуктивність сушильної камери за випареною вологою, кг/с:
Мр =0,001(d2-d1) Мс.п .
де d2, d1 – вологовміст повітря після і до сушильної камери.
Витрати на випаровування 1 кг вологи:
сухого повітря, кг:
mс.п = 1000 / (d2-d1);
теплоти в сушильній установці, кДж:
q = 1000 (Н1-Н0) / ( d2-d1).
Ефективність сушильної установки можна оцінити, порівнюючи q з мінімальною витратою теплоти qmin на підігрів висушуваного матеріалу до температури випаровування 1 кг вологи. Для атмосферної конвективної сушки qmin = 2500 кДж/кг. Чим ближче до одиниці значення 2500 / q , тим ефективніше працює установка.
Контрольні запитання
Що являє собою вологе повітря ?
Що називається абсолютною вологістю повітря ?
Що називається відносною вологістю повітря ?
Що називається вологовмістом ?
Що таке ентальпія і як вона визначається для вологого повітря ?
У якому стані може перебувати вологе повітря ?
Як, використовуючи покази психрометра, знайти на Id- діаграмі точку, що характеризує стан вологого повітря ?
Як на Id- діаграмі зображається процес, який відбувається у калорифері?
Як і які параметри можна знайти для заданої на Id- діаграмі точки ?
Пояснити, як визначено стан повітря в характерних точках процесів, що відбуваються в сушильній установці.
Який тепловий режим вважають стаціонарним ?
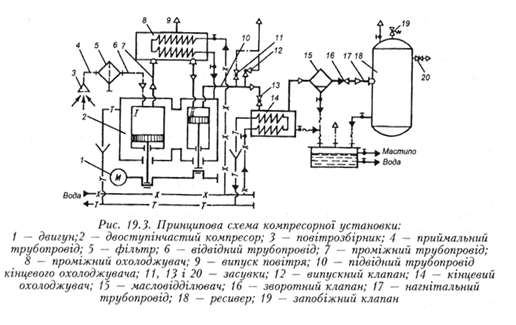
Будова й призначення елементів лабораторної установки.
Порядок виконання лабораторної роботи.
Як визначається витрата повітря й теплоти на випаровування 1 кг вологи ?
Як визначити теплові втрати калорифера в оточуюче середовище ?
Як визначається витрата сухого повітря через установку ?
З якими процесами вологого повітря ви стикаєтесь у побуті ?
Чому ентальпію вологого повітря, яка має одиницю кДж/кг, позначають H,а не h, що, звичайно, вживається для величин, віднесених до 1 кг ?
Чому у розрахунку сушарок за основну розрахункову одиницю беруть1 кг сухого повітря ?
Список літератури
1. Воронец Д., Козич Д. Влажный воздух: Термодинамические свойства и применение. – М.: Энергоатомиэдат, 1984.
2. Нащокин В.В. Техническая термодинамика и теплопередача. – М.: Высш. шк., 1980. – С.210-217.
3. Теплотехника. / Под ред. А.П. Баскакова. – М.: Энергоатомиэдат, 1982. – С.44-47.
4. Теплотехника./ И. Т. Швец, В. И. Толубинский, Алабовский и др. – К.: Высш. шк., 1976. – С.68-72.
5. Техническая термодинамика /В. А. Кириллин, В. В. Сычев, А. Е. Шейндлин. – М.: Энергоатомиэдат, 1983. – С.371-382.
6. Шинкарик М.М. Теоретичні основи теплотехніки. – Тернопіль, вид. ТДТУ ім. І.Пулюя, 2002. – с. 39-45.
Основні положення термодинаміки
Технічна термодинаміка є феноменологічою теорієюмакроскопічних процесів, які супроводжуються пертворенням:
1. енергії; 2. тепла; 3. тиску; 4. ідеального газу;
2. Першою роботою яка положила початок розвитку термодинаміки була робота:
1. С. Карно; 2. М. Ломоносова; 3. Больцмана; 4. Лаваля;
3. Термодинамічною системою називається сукупність матеріальних тіл, які є об’єктом вивчення і знаходиться з навколишнім:
1. середовищем; 2. тиском; 3. атмосферним тиском; 4. питомим об’ємом;
4. Питомий об’єм – це величина:
1. ![]() ; 2.
; 2. ![]() ; 3.
; 3. ![]() ; 4.
; 4. ![]() ;
;
5. Питомий об’єм – це об’єм, який займає:
1. 1 кг речовини; 2. 1 кг газу; 3. 1 м3 речовини; 4. 1 м2 речовини;
6. Для вимірювання тиску використовують одиниці виміру:
1. Паскаль(Па),Н/м2; фізична атмосфера(ф.атм.) бар; технічна атмосфера (ат) міліметри ртутного стовпчика, міліметри водяного стовпчика; 2. Паскаль (Па); фізична атмосфера, бар; технічна атмосфера; 3. фізична атмосфера; технічна атмосфера; міліметри ртутного стовпчика, міліметри водяного стовпчика; 4. атмосфера, бар;
7. Температура – характеризує степінь нагрітості тіл і є мірою середньою:
1. кінематична енергія руху молекул; 2. потенціальна енергія руху молекул; 3. енергія руху молекул; 4. внутрішня енергія;
8. Параметром стану є абсолютна температура:
1. ![]() ; 2.
; 2. ![]() ; 3.
; 3. ![]() 4.
4. ![]()
9. Основні термодинамічні параметри стану P, v, T взаємоз’язані:
1. F(P, v, T=0); 2. F(w, p,T)=0; 3. F(P, v, T)≠0; 4. F(v, T)=0
10. Послідовність зміни стану системи складає:
1. термодинамічний процес; 2. тепловий процес; 3. термодинаміка; 4. теплообмінний процес;
11. Оборотним процесом може бути тільки процес:
1. врівноважений; 2. стислий; 3. внутрішній 4. зовнішній;
12. Перетворення теплоти в роботу здійснюється за допомогою:
1. робочого тіла; 2. робочого тиску; 3. робочого об’єму; 4. робочого впливу;
13. Кожна молекула, якщо вона рухається зі швидкість w, за одиницю часу здійснює:
1. ![]() ходів; 2.
ходів; 2. ![]() ходів; 3.
ходів; 3. ![]() ходів; 4.
ходів; 4. ![]() ходів;
ходів;
14. Рівняння стану ідеального газу:
1. PV=mRT; 2. pw=mRT; 3. PV=RT; 4. PV=RT
Перший закон термодинаміки
1. Перший закон термодинаміки стверджує, що енергія не виникає і не зникає, вона лише переходить із однієї в іншу.
1. форму; 2. фази; 3. залежності; 4. температури;
2. Яке рівняння вірне?
1. dQ=dU+dL; 2. dQ=dP+dL; 3. dQ=dT+dP; 4. dQ=dT+pdV;
3. Абсолютна величина внутрішньої енергії:
1. v=∫(dQ+dL)+U0; 2. v=∫(dQ+dL)+V; 3. v=∫(dQ+dL); 4. v=∫dp+pdV;
4. Внутрішня енергія системи є однозначною функцією стану:
1. системи; 2. температури; 3. об’єму; 4. тиску;
5. Внутрішня енергія системи є однозначною функцією стану тіла:
1. U=φ(P,V); U= φ2(P,T); U= φ3(V,T); 2. U= φ(P,V); U= φ3(P,T);
3. U= φ(V,T); U= φ(P,T); 4. U= φ(p,V,T);
6. Робота виконана поршнем:
1. dL=Pdv; 2. dL=TdV; 3. dL=VdV; 4. dA=SdV;
7. Перший закон в диференціальній формі:
1. dg=du+pdυ; 2. dg=dT+pdυ; 3. dg=dv+dp; 4. dg=dv+dυ;
8. Величина:
1. h=v+рυ; 2. h=v-рυ; 3. h=dv+g; 4. h=v+pυT;
-є функцією стану системи і чисельно рівна всій енергії
9. Ентальпія є:
1. параметром; 2. тиском; 3. температурою; 4. станом системи;
10. Істинна теплоємність тіла:
1. ![]() ; 2.
; 2. ![]() ; 3.
; 3. ![]() ; 4.
; 4. ![]()
11. Середня теплоємність це:
1. ![]() ; 2.
; 2. ![]() ; 3.
; 3. ![]() ; 4.
; 4. ![]() ;
;
12. Показник адіабати це:
1. ![]() ; 2.
; 2. ![]() ; 3.
; 3. ![]() ; 4.
; 4. ![]()
Друний закон термодинаміки
1. Друний закон термодинаміки встановлює максимально можливу границю пертворенн2я:
1. теплоти в роботу; 2. риску в роботу; 3. густини потоку в роботу;
4. теплоти;
2. Робота в термодинамічних процесах можлива в результаті:
1. зміни внутрішньої енергії; 2. зміни тиску; 3. зміни об’єму;
4. зміни середовища;
3. Цикл, в результаті якого одержується позитивна робота, називається:
1. прямим циклом; 2. зворотнім циклом; 3. оборотнім циклом;
4. змішаним циклом;
4. Співвідношення між питомими кількостями теплоти і питомою роботою визначається:
1. першим законом термодинаміки g1-g2=u2-u1+L;
2. другим законом термодинаміки g1-g2=u2-u1+L;
3. термодинамічними законами; 4. станом тіла
5. Термічний коефіцієнт корисної дії:
1. ![]() ; 2.
; 2. ![]() ;
;
3. ![]() ; 4.
; 4. ![]() ;
;
6. Степінь досконалості зворотнього циклу визначається холодильним коефіцієнтом:
1. ![]() ; 2.
; 2. ![]() ; 3.
; 3. ![]() ; 4.
; 4. ![]() ;
;
7. Термічний коефіцієнт циклу Карно:
1. ![]() ; 2.
; 2. ![]() ; 3.
; 3. ![]() ; 4.
; 4. ![]() ;
;
8. В зворотному процесі робоче тіло від т.1 розширюється до т.4 по адіабаті 1-4 без теплообміну з зовнішнім середовищем:
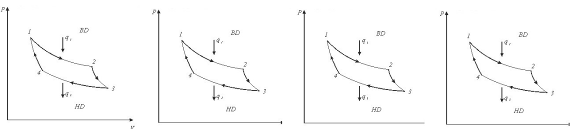
1. по адіабаті 1-4 без теплообміну з зовнішнім середовище
2. по ізохорі 1-4 без теплообміну з зовнішнім середовище
3. по ізотермі 1-4 без теплообміну зовнішнім середовище
4. по ізобарі 1-4 без теплообміну з зовнішнім середовище
9. В зворотному процесі робоче тіло
від т.4-3 підводиться тепло q2 по :
1. ізотермі;
2. ізобар;
3. ізохорі;
4. адіабаті
10. Для адіабатного процесу розшир енняі стиснення відповідн о маємо
1. 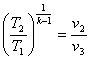 ; 2.
; 2. 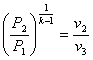 ; 3.
; 3.  ; 4.
; 4. 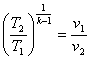
Аналіз основних термодинамічних процесів ідеального газу
1. Вираз першого закону термодинаміки для ізохорного процесу:
1. qυ=∆u; 2. qυ=∆t; 3. qυ=∆Р; 4. qυ=∆Q;
2. Вираз першого закону термодинаміки для ізобарного процесу:
1. dgp=dh; . dgp=dТ; 3. dgp=dV; 4. dgp=∆u;
3. В ізохорному процесі dυ=0 і робота:
1. не виконується lυ=0; 2. виконується lυ≠0; 3. не виконується lυ>0; 4. виконується lυ<0;
4. Теплота в ізохорному процесі тільки на зміну:
1. внутрішньої енергії qυ=∆u= Сυm(t2-t1); 2. внутрішньої енергії qυ=du= Сυm(t2-t1);
3. внутрішньої енергії qυ=∆u= Сυm(t-t); 4. внутрішньої енергії qυ=∆h= Сυm(t2-t1);
5. Рівняння стану двох точок ізобарного процесу:
1. pυ1=RT1; pυ2=RT2; 2. p=RT1, p=RT2;
3. pυ1=RT; pυ2=RT; 4.1 υ=RT1; υ=RT2;
6. Заміна ентальпії в ізобарному процесі визначається:
1. ![]() ; 2.
; 2. ![]() 3.
3. ![]() 4.
4. ![]() ;
;
7. Кількість теплоти в ізобарному процесі рівна зміні:
1. qp=Cpm(t2-t1)=∆h; 2. qp=∆u; 3. qp=∆h∆T; 4. qp=∆u =Cpn(t2-t1);
8. Теплота необхідна для здійснення ізотермічного прцесу:
1. ![]() ; 2.
; 2. ![]() ;
;
3. ![]() ; 4.
; 4. ![]() ;
;
9. Зміна ентропії в ізотермічному процесі:
1. ![]() ; 2.
; 2. ![]() ;
;
3. ![]() ; 4.
; 4. ![]()
10. Адіабатним називається такий процес, при якому робоче тіло не обмінюється теплотою з:
1. навколишнім середовищем g=0, dg=0; 2. навколишнім тілом;
3. навколишнім тиском; 4. навколишнім об’ємом;
11. Рівняння адіабатного процесу:
1. k∙lnυ+lnp=0; 2. k∙lgυ+lgp=0; 3. k∙lnυ-lnp=0; 4. k∙lgυ-lgp=0;
12. Робота в адіабатному процесі:
1. ![]() ; 2.
; 2. ![]() ;
;
3. ![]() ; 4.
; 4. ![]() ;
;
13. В TS координатах адіабата зображається:
1. вертикальною прямою; 2. горизонтальною прямою;
3. гіперболою; 4. параболою;
14. В TS координатах ізобара зображається
1. логарифмічною кривою; 2. горизонтальною кривою;
3. вертикальною кривою; 4. похилою;
Перший закон термодинаміки для потоку відкритої термодинамічної системи
1.Умова нерозривності потоку полягає в однаковості масової витрати m робочого тіла в будь-якому січенні:
1) m=F∙c/γ=const; 2) m=F∙l/ν=const; 3) m=F∙c/V=const; 4) m=F∙ ν /c=const.
2.Під відкритими розуміють термодинамічні ситеми, які крім обміну теплотою і роботою з навколишнім середовищем допускають ще й обмін:
1) масою; 2) об’ємом; 3) тиском; 4) швидкість.
Похожие работы
... мислення, сприяє формуванню творчого відношення до праці, вчить бережливому відношенню до матеріалів, енергії, техніки, сировини, готових продуктів праці. Загальнотехнічна підготовка є ланкою між політехнічною освітою та спеціальною частиною професійно-технічної навчання і покликана озброїти тих, що навчаються системою знань загальних основ техніки, технології та організації виробництва і праці ...
... д. цих циклів менший від термічного к. к. д. циклу Карно. Відомо, що під час досліджень термодинамічних процесів умови, за яких вони відбуваються, беруть ідеальними. Розглянемо ідеальні термодинамічні цикли двигуна внутрішнього згоряння. Припустимо, що: 1) кількість і склад робочого тіла в циклі не змінюються; 2) процеси згоряння палива і вихлоп газу замінено підведенням та відведенням теплоти ...
... вивчення. Для зменшення числа програм у розумних межах і упорядкування їхнього змісту доцільно групувати професії, підготовлювані в середніх профтехучилищах, на основі спільності предметів. Аналітичний розгляд вимог виробництва до загальнотехнічної підготовки молодих робітників — перший крок по шляху кваліфікації професій у залежності від сполуки загальнотехнічних предметів і їхнього основного ...
... факторів, як технічний рівень виробництва й рівень організації праці. Як показує проведений аналіз, підвищення продуктивності праці в ЦГПТЛ протягом І півріччя відбувалося під впливом як екстенсивних, так і інтенсивних факторів. 3.2.2 Продуктивність праці в мартенівському цеху комбінату «Запоріжсталь» Головним показником, що характеризує роботу мартенівської печі, є її продуктивність. Під ...
0 комментариев