Навигация
Визначення вологості повітря з температурою мокрого і сухого термометрів
10.4 Визначення вологості повітря з температурою мокрого і сухого термометрів
Прилад для вимірювання відносної вологості повітря називається психрометром. Психрометр складається із двох однакових термометрів. Один з них сухий термометр, а другий термометр обгорнутий мокрою стрічкою
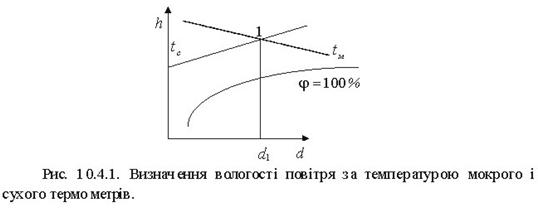
Мокрий термометр показує нижчу температуру, ніж сухий термометр. На h - d - діаграмі на перетині температур сухого tс і мокрого tm термометрів одержимо точку 1, по якій можна визначити відносну вологість ![]() і вологовміст d. Відносну вологість можна визначити якщо використовувати психрометричні таблиці.
і вологовміст d. Відносну вологість можна визначити якщо використовувати психрометричні таблиці.
11. Перший закон термодинаміки для потоку (відкритої термодинамічної системи)
Під відкритими розуміють термодинамічні системи, які крім обміну теплотою і роботою з навколишнім середовищем допускають ще й обмін масою.
Будемо розглядати лише одномірні стаціонарні потоки, в яких параметри залежать тільки від однієї координати, яка співпадає з вектором швидкості і не залежить від часу.
Умова нерозривності потоку полягає в однаковості масової витрати ш робоч ого тіла в будь - якому січенні
![]() (11.1)
(11.1)
де F-площа поперечного січення, м ;
с - швидкість, м/с;
v -питомий об'єм, м /с.
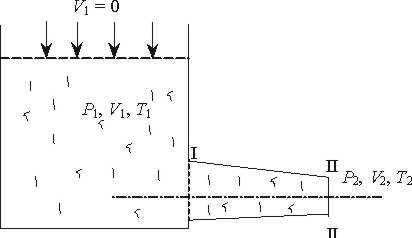
Рис 11.1. Схема процесу витікання із посудини необмеженої ємності.
По трубопроводу робоче тіло з параметрами Т1,р1,v1 поступає в тепломеханічний агрегат. Тут кожний кілограм робочого тіла одержує від зовнішнього джерела теплоту q і здійснює технічну роботу lтех , наприклад, приводячив рух ротор турбіни, а потім виходить із швидкістю с2, маючи параметри Т2,р2,v2. Оскільки перший закон термодинаміки виконується завжди, то можна записати:
q=∆u+l.(11.2)
При русі тіла по каналу може змінитись внутрішня енергія u2-u1 тіло виконує роботу на витіснення об'єму газу р1v1-р2v2 (рис.11.1). Якщо змінюється швидкість тіла, то частина енергії витрачається на зміну швидкості
![]()
В процесі проходження по каналу робоче тіло виконує роботу lтех а такожвиконаєроботу на подолання сил тертя lтp .
Теплота, яка надається тілу в процесі його проходження по каналу, складається з зовнішньої теплоти і теплоти тертя. Тйким чином можна записати:
![]() (11.3)
(11.3)
Враховуючи, що u+ рv = h , qтp =lтр ,запишемо:
![]() (11.4)
(11.4)
Перший закон термодинаміки для потоку можна сформулювати так теплота, підведена до робочого тіла ззовні, витрачається на збільшення ентальпії робочого тіла, виконання технічної роботи і збільшення кінетичної енергіїпотоку.
В диференціальній формі рівняннязагишетьсятак:
![]()
Використаємо перший закон термодинаміки до різних типів теплотехнічного обладнання.
Теплообмінний апарат
Для нього lтех=0 , а ![]() тому
тому
![]() =h2-h1
=h2-h1
Для теппообмінника, встановленого в потоці цей вираз справедливий не тільки в ізобарному процесі, але й в процесі з тертям, коли тиск середовица зменшуєтьсячерез опір.
2 Тепловий двигун
Як правило ![]() ,
, ![]() =0 тому робоче тіло виконує технічну роботу за рахунок зменшення ентальпії.
=0 тому робоче тіло виконує технічну роботу за рахунок зменшення ентальпії.
![]() =h2-h1
=h2-h1 ![]()
(перший закон термодинаміки),
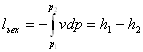
3. Компресор .
Якщо процес стиснення газу в компресорі проходить без теплообміну з навколишнім середовищем (qреn = 0) і с1 = с2, то ![]() =h2-h1 де h2<h1.
=h2-h1 де h2<h1.
11.1 Витікання
Канали, в яких проходить збільшення швидкості газу, називаються соплами.
Канали, в яких проходить зменшення швидкості - дифузорами. Процес витікання проходить без теплообміну з зовнішнім середовищем і його можна вважати адіабатним Згідно першого закону (11.4) термодинаміки для відкритих систем при ![]() =0 і
=0 і ![]()
![]()
Швидкість с2 в адіабатному процесі можнавизначитиза формулою:
![]()
Приймаємо с1 = 0, оскільки с1<<с2 тоді
![]()
адіабатному процесі:
![]() (11.7)
(11.7)
Тоді
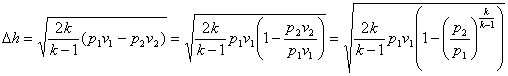 (11.8)
(11.8)
Масові витрати газу шчерез сопла
![]()
деƒ-площапоперечногоперерізу сопла, м3 ;
v. -питомий об'єм газу на виході із сопла
Для адіабатного процессу
![]() ;
;
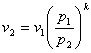
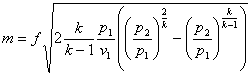 (11.9)
(11.9)
Із виразу (11.9) можна зробити висновок, що масова секундна витрата ідеального газу при витіканні з великого резервуару залежить від площі вихідного січення сопла, властивостей і початкових параметрів газу, а також від кінцевого тиску р2
Якщо побудувати графік залежності
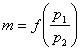
згідно (11.9), то одержимо
При р2=р1 ![]() =1, m=0;
=1, m=0;
При р2=0 ![]() =0, m=0
=0, m=0
Якщо порівняти теоретично одержану криву (рис. 11.1) з експериментальною кривою залежності
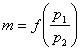 ,
,
то від 1 до точки К криві співпадають. Від точки К дійсні масові витрати залишаються постійними.
Для того, щоб пояснити це розходження Сен-Венан в 1839 році висунув гіпотезу, що в соплі неможливо одержати тиск газу, нижчий ркр який відповідає максимальній витраті пари через сопло.
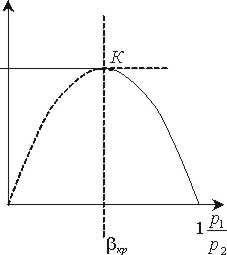
Рис. 11.1 Графік зміни 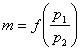
Дня визначення максимуму функції
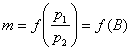
візьмемо першу похідну від виразу в квадр атних дужках рівняння (11 9).
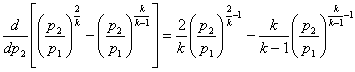 =0 (11.10)
=0 (11.10)
Розділимо ліву і праву частиш рівняння (11.10) на
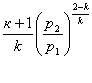
Одержима
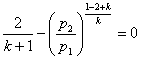
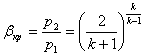
Звідси можна зробити висновок, що величина βкр є постійною величиною і залежить від величини показнік а аді абати.
Для одноатомного газу к = 1,66 і βкр =0,49.
Для двохатомногогазу к = 1,4 і βкр = 0,5 28. Для трьохатомного газу к = 1,3 і βкр =0,546.
Похожие работы
... мислення, сприяє формуванню творчого відношення до праці, вчить бережливому відношенню до матеріалів, енергії, техніки, сировини, готових продуктів праці. Загальнотехнічна підготовка є ланкою між політехнічною освітою та спеціальною частиною професійно-технічної навчання і покликана озброїти тих, що навчаються системою знань загальних основ техніки, технології та організації виробництва і праці ...
... д. цих циклів менший від термічного к. к. д. циклу Карно. Відомо, що під час досліджень термодинамічних процесів умови, за яких вони відбуваються, беруть ідеальними. Розглянемо ідеальні термодинамічні цикли двигуна внутрішнього згоряння. Припустимо, що: 1) кількість і склад робочого тіла в циклі не змінюються; 2) процеси згоряння палива і вихлоп газу замінено підведенням та відведенням теплоти ...
... вивчення. Для зменшення числа програм у розумних межах і упорядкування їхнього змісту доцільно групувати професії, підготовлювані в середніх профтехучилищах, на основі спільності предметів. Аналітичний розгляд вимог виробництва до загальнотехнічної підготовки молодих робітників — перший крок по шляху кваліфікації професій у залежності від сполуки загальнотехнічних предметів і їхнього основного ...
... факторів, як технічний рівень виробництва й рівень організації праці. Як показує проведений аналіз, підвищення продуктивності праці в ЦГПТЛ протягом І півріччя відбувалося під впливом як екстенсивних, так і інтенсивних факторів. 3.2.2 Продуктивність праці в мартенівському цеху комбінату «Запоріжсталь» Головним показником, що характеризує роботу мартенівської печі, є її продуктивність. Під ...
0 комментариев