Реферат
по биологии
на тему:
"Антибиотические белки и пептиды и воспалительный процесс"
2008
Катионные пептиды и белки, будучи представленными в значительных количествах в мобильных клетках принимают активное участие в гуморально-клеточной кооперации крови и соединительной ткани в ходе такого сложного патофизиологического процесса, каким является острое воспаление. Воспаление есть возникший в эволюции процесс реагирования организма человека и животных на местные повреждения, который включает в себя в качестве взаимосвязанных компонентов сложные поэтапные изменения микроциркуляторного русла, системы крови и соединительной ткани, направленные в конечном итоге на изоляцию и устранение патогенного агента и восстановление поврежденных тканей. Своеобразие этого процесса заключается в том, что далеко не все компоненты тканевых изменений в очаге воспаления представляют собой выражение только защитных реакций организма. Например, избыточная миграция нейтрофильных гранулоцитов в воспаленные ткани может быть причиной формирования абсцесса и резкого нарушения функциональной активности конкретной биологической системы. Однако в нашей оценке биологической роли воспаления мы должны исходить из представлений о первично защитном характере таких его реакций, как свертывание крови в поврежденных патогенным фактором сосудах, препятствующее кровопотере, увеличение проницаемости сосудов микроциркуляторного русла и поддержание в них крови в жидком состоянии, накопление в очаге нейтрофильных гранулоцитов с последующей их заменой клетками системы мононуклеарных фагоцитов. На всех стадиях воспаления активными и непосредственными участниками происходящих физико-химических процессов являются катионные пептиды и белки НГ.
Формирование очага воспаления характеризуется стереотипным развертыванием переходящих одна в другую реакций сосудистого ложа места повреждения. Нарушение структурно-функциональной целостности клеток и тканей при воздействии патогенного фактора приводит к кратковременному сужению артериол, венул и капилляров микроциркуляторного русла, сменяющимся последующей длительной фазой вазодилатации. Расширение сосудов, инициируемое гистамином из тучных клеток рыхлой соединительной ткани, способствует их интенсивному кровенаполнению. Параллельно с этим процессом наблюдается существенное повышение проницаемости стенок сосудов, которое благоприятствует выходу плазмы крови в экстравазальное пространство и формированию отека. Рассматриваемые сосудистые изменения, наряду с миграцией НГ, являются решающими в завязывании и развитии воспаления. Поэтому не случаен интерес многих исследователей к вопросу о природе веществ, обеспечивающих повышение проницаемости сосудов в этих условиях. Среди таких соединений фигурируют в настоящее время кинины, ангиотензин II и некоторые представители группы катионных белков нейтрофильных гранулоцитов.
Первые экспериментально обоснованные представления о провоспалительной активности катионных пептидов и белков НГ сформировались уже в 60-х годах нашего столетия. Они базировались на работах, в которых была продемонстрирована способность низкомолекулярных неферментных катионных белков НГ кролика и крысы вызывать значительное увеличение проницаемости сосудов у животных, которым внутрикожно инъецировали эти вещества. Данный эффект наблюдали немедленно после введения дефенсинов. Причем было установлено, что большая часть катионных пептидов и белков увеличивает проницаемость сосудов путем непосредственного взаимодействия с их стенками, в то время как другая — через предварительное освобождение гистамина из тучных клеток. Полианионы отменяли наблюдаемое явление, как и предварительная обработка белков трипсином. Эти данные обосновали представление о лизосомных катионных пептидах и белках НГ как медиаторах воспаления, выступающих в ходе развертывающегося патофизиологического процесса в роли факторов проницаемости и дегрануляторов тучных клеток. В основе рассматриваемой физиологической активности этой группы веществ лежит их повышенная тропность к отрицательно заряженным компонентам стенок кровеносных сосудов. В частности, после адсорбции на поверхности клеток антибиотические пептиды и антибиотические белки уже за счет гидрофобных взаимодействий с липофильными хвостами жирных кислот мембран нарушают упорядоченную структуру липидного бислоя плазмалеммы, изменяя ее барьерную и метаболическую функции.
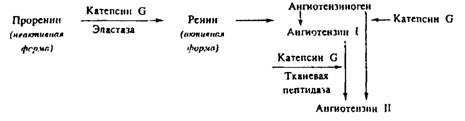
Наряду с неферментативным механизмом увеличения проницаемости сосудов существуют и другие пути участия катионных белков НГ в регуляции воспаления. Они связаны в основном с протеолитической активностью сериновых протеин аз, которые способны активировать калликреин-кининовую, ренин-ангиотензиновую и комплементарную системы и генерировать таким образом вазоактивные соединения. К числу последних относится и ангиотензин II, который обычно образуется из неактивного предшественника — ангиотензиногена в результате его последовательного двухступенчатого протеолиза под действием ренина и тканевой пептидазы. В серии работ было показано, что в условиях очага воспаления катепсин G нейтрофильных гранулоцитов человека может выполнять функции, аналогичные двум названным протеин азам. Катепсин G может внеклеточно осуществлять ограниченный протеолиз молекулы ангиотензиногена с образованием ангиотензина II — пептида, увеличивающего проницаемость сосудов и повышающего артериальное давление. В дополнение к этому катепсин G и эластаза нейтрофильных гранулоцитов способны осуществлять конверсию проренина в ренин, способствуя таким образом запуску основного пути формирования ангиотензина II. Схематически весь каскадный процесс с участием в нем лейкоцитарных протеаз выглядит следующим образом:
В нейтрофильных гранулоцитах выявлены и кининобразующие сериновые протеиназы. Кинины являются вазоактивными пептидами, обеспечивающими длительное увеличение проницаемости сосудов, расширение артериол и повышение давления в капиллярах и венулах. Обычно они являются конечным продуктом каскадной калликре-ин-кининовой системы, запускаемой фактором Хагемана. На основании ингибиторного анализа есть основания предполагать, что эластаза НГ является кинин-генерирующим ферментом, однако строгих доказательств этого положения до настоящего времени не получено.
Ключевую роль в патогенезе воспаления играет система комплемента. Физиологически активные соединения, продуцируемые в ходе ее активации, оказывают существенное влияние не только на состояние проницаемости сосудов, но и характер клеточных реакций очага воспаления. Исследованиями доказано участие сериновых протеиназ НГ в формировании биологически активных производных комплемента.
В соответствии с устоявшимися представлениями система комплемента состоит из плазменных белков, образующих 9 функционально значимых компонентов. Последовательное включение этих компонентов в формирование реакций фагоцитоза и воспаления носит название процесса активации комплемента, осуществляемого путем избирательного расщепления их белковых молекул с образованием физиологически активных полипептидных фрагментов. Среди последних ведущими являются универсальный опсонизирующий фактор СЗЬ, ответственный за единообразную маркировку объектов фагоцитоза и облегчающий их поглощение нейтрофильными гранулоцитами и макрофагами, а также анафилатоксин С5а — основной хемотаксический агент, обеспечивающий направленную миграцию нейтрофильных гранулоцитов в очаг воспаления. Традиционно рассматриваются два основных пути активации комплемента: классический и альтернативный. В дополнение к ним обнаружен новый вариант активации системы комплемента, связанный с деятельностью эластазы и катепсина G нейтрофильных гранулоцитов. Продемонстрировано, что сериновые протеиназы НГ могут осуществлять прямую конверсию компонента комплемента СЗ с образованием фрагментов СЗа и СЗЬ. Эти же ферменты обладают С5-конвертирую-щей активностью, благодаря которой от CS отщепляется фрагмент С5а. Таким образом, наряду с альтернативным путем активации системы комплемента существует дополнительная возможность вовлечения ее в различные процессы гуморально-клеточной кооперации при фагоцитозе и воспалении в начальной фазе формирования резистентности организма человека и позвоночных животных. Образование СЗЬ и С5а под действием эластазы и катепсина G может обеспечивать адекватную клеточную реакцию очага воспаления, направленную на распознавание, поглощение и эффективную элиминацию патогенных факторов. Эти полипептиды ответственны за полноценное проявление таких форм функциональной деятельности НГ, как хемотаксис, адгезивность, метаболический взрыв и микробоцидность. Поэтому их генез в процессе воздействия сериновых протеиназ НГ на компоненты СЗ и С5 комплемента может рассматриваться в качестве одного из дополнительных механизмов активации фагоцитов крови, соединительной ткани и очагов воспаления.
Некоторые группы катионных белков могут оказывать на систему комплемента действие, противоположное рассмотренному выше. Известна антикомплементарная активность низкомолекулярных неферментных белков кролика. Она связана, по-видимому, с их способностью электростатически взаимодействовать с анионными молекулами фракций комплемента. В результате блокируются цепные реакции каскада активации комплемента. Подобный механизм инактивации комплемента может быть ответственным за ограничение процесса миграции лейкоцитов в очаг воспаления, когда их избыточное накопление может приводить не только к защитным, но и к деструктивным явлениям в тканях организма. Таким образом, отдельные представители группы гранулярных катионных белков НГ могут оказывать на течение воспаления разнонаправленное действие, что важно в плане регуляции этого патофизиологического процесса. Подобная ситуация наблюдается и при анализе данных, имеющих отношение к гемостатической функции катионных пептидов и белков.
Все это позволяет охарактеризовать катионные пептиды и белки клеток и жидких сред организма человека и животных как физиологически активные вещества многонаправленного действия. С их функционированием связаны такие защитно-приспособительные процессы, как фагоцитоз, воспаление и, возможно, стресс-реакция, причем в этих процессах они выступают не только в роли высокоэффективных антибиотических агентов. Им свойствен широкий функциональный потенциал, который реализуется в различных проявлениях клеточно-гуморальной кооперации в кровеносной и лимфоидной системах, соединительной ткани, пограничных эпителиях. Такая кооперация направлена на реализацию и регуляцию механизмов неспецифической резистентности макроорганизма к инфекции.
Есть все основания считать, что антимикробные белки и пептиды клеток и жидких сред организма являются особым классом физиологически активных веществ, отобранных в процессе эволюции в качестве биохимического механизма его барьерных систем и антимикробной защиты. Высокая концентрация катионных белков в клетках, осуществляющих защитные реакции, является веским тому доказательством. В частности, в 109 клеток нейтрофилов человека содержится 3.9±0.9 мг миелопероксидазы, 1.2±0.2 — катепсина G, 2.7±0.6 — эластазы, 4.3±1.2 —лактоферрина и 7.2 мг лизоцима. Поэтому функциональная неполноценность нейтрофилов, обусловленная наследственно детерминируемыми дефицитами или отсутствием в них отдельных представителей группы антимикробных катионных белков и пептидов, представляет редко встречающееся явление. Гораздо чаще в клинической практике имеют место случаи развития аутоинфекционных заболеваний и гнойных осложнений у больных хирургических, пульмонологических, педиатрических клиник, ожоговых центров и отделений реанимации, которые сопряжены с приобретенными дефицитами содержания этих белков. В дополнение к этому общеизвестны факты низкого уровня сопротивляемости организма новорожденных инфекциям и вследствие этого склонность к септическому течению заболеваний у детей в ранний постнатальный период онтогенеза. По мнению этих авторов, недостаточность хемотаксиса нейтрофилов и незавершенный характер фагоцитоза, осуществляемого ими, являются одними из ведущих причин сниженной резистентности новорожденных к инфекции. В то же самое время некоторые конкретные механизмы полома фагоцитоза в данных условиях остаются невыясненными. Это побудило нас провести комплексное морфобиохимическое и функциональное исследование с целью определения роли катионных белков и пептидов в обеспечении фагоцитарной функции нейтрофилов человека и некоторых лабораторных животных в ранний постнатальный период их развития.
Результаты сравнительного биохимического определения общего кислоторастворимого белка, миелопероксидазы, эластазы и катепсина G в нейтрофилах пуповинной крови новорожденных и взрослых доноров однозначно свидетельствуют о дефиците этих соединений в клетках детей. Параллельная оценка содержания гранулярных катионных белков и пептидов с использованием лизосомально-катионного теста соответствует данным этого анализа.
Подобная же закономерность изменения содержания катионных белков в нейтрофилах от первых дней рождения до периода половозрелости установлена нами при обследовании белых беспородных крыс и кроликов породы «Шиншилла». Необходимо отметить, что дефициту гранулярных катионных белков нейтрофилов кролика соответствовали низкие значения такого важного функционального показателя их активности, как завершенность фагоцитоза. Последнее обстоятельство является, по-видимому, одной из возможных причин генерализации листериозного и герпетического инфекционных процессов у животных 7-дневного возраста, которые у половозрелых особей протекают локально благодаря полной инактивации микроорганизмов в фагоцитах очага повреждения.
Сведения подобного рода были ранее получены только для миелопероксидазы крыс и лактоферрина нейтрофилов человека.
Таким образом, нами установлен временный дефицит антимикробных белков и пептидов нейтрофилов в период раннего постнатального развития человека и животных, который может составлять причину функциональной неполноценности фагоцитов и быть расценен как один из факторов риска развития аутоинфекционных заболеваний и септических осложнений. В дополнение к этому впервые получены строгие доказательства объективности данных цитохимического определения содержания катионных белков и пептидов нейтрофилов при использовании лизосомально-катионного теста.
Биологическая значимость антибиотических пептидов и белков однозначно просматривается в анализе явления резорбтивной клеточной резистентности.
Гипотеза о резорбтивной клеточной резистентности как особой форме антимикробной защиты организма человека и животных была выдвинута проф. В.Е. Пигаревским на основании результатов работ по исследованию морфодинамики воспалительных очагов повреждения при инфекционной патологии. Морфологический анализ инфицированных органов и тканей при хламидиальной и псевдотуберкулезной инфекциях показал, что макрофаги воспалительных очагов в процессе своей жизнедеятельности проходят стадию поглощения продуктов распада нейтрофилов, благодаря чему они становятся резистентными к микробному паразитированию. Опыты по инактивации этих возбудителей in vitro ядерными гистонами и гранулярными катионными белками нейтрофилов частично свидетельствовали в пользу выдвинутой концепции.
С целью дальнейшего обоснования биологической значимости рассматриваемого явления и расшифровки его конкретных морфобиохимических механизмов нами было проведено комплексное исследование с использованием в качестве основного объекта изучения перитонеальных макрофагов кролика, выделенных из очага асептического воспаления на разных сроках после его индукции. Такое воспаление характеризуется надежно воспроизводимой во времени динамикой смены лейкоцитарных популяций. В первые 4—8 ч после введения в брюшную полость индуцирующего раствора крахмала наблюдается интенсивный выход туда нейтрофилов из крови. До 36 ч этот тип клеток является преобладающим в экссудате. В дальнейшем происходит закономерная смена клеточных популяций в очаге воспаления и к 48 ч макрофаги составляют уже не менее 90% клеток экссудата, причем около 50% из них содержат морфологически идентифицируемые остатки ядер и гранул нейтрофилов. В последующие 3 сут наблюдается постепенное исчезновение компонентов нейтрофилов из макрофагов в результате их переваривания в гранулярном аппарате последних. Подобная динамика клеточных реакций в очаге воспаления позволяет получать макрофаги с различным содержанием резорбированных антимикробных белков нейтрофилов и использовать их в витральных тест-системах.
В первой серии экспериментов изучали соотношение функциональной активности и количества миелопероксидазы гранулоцитарного происхождения в перитонеальных макрофагах кролика, выделенных из организма на разных сроках развертывания асептического воспаления. Установлена четкая положительная коррелятивная связь между показателями функциональной активности макрофагов и содержанием в них миелопероксидазы, которое максимально в 2-суточных клетках. Можно допустить, что именно с увеличением количества антимикробных белков нейтрофилов в вакуолярном аппарате макрофагов связано повышение их цитоцидного потенциала по сравнению с исходными интактными клетками. Подобный эффект наблюдали зарубежные исследователи при добавлении миелопероксидазы в инкубационную среду культуры макрофагов с фагоцитированными простейшими. Такой подход к анализу процесса резорбтивной клеточной резистентности позволяет более
Показатели функциональной активности и содержания антимикробных белков макрофагов
| Объект исследования | Содержание мне-лопероксядаэы, мг/10* клеток | Фагоцитарна* активность клеток в отношении Staphylococcus epidermidis | Процент НСТ-нозктивных клеток | |
| ФЧ.% | ФИ | |||
| Нейтрофилы | 0.565 | — | — | — |
| Перитонеальные | ||||
| макрофаги: | ||||
| резидентные | 0.03 | 25.0±1.3 | 3.2Ю.11 | 10.0Ю.8 |
| 2-суточные | 0.28 | 49.011.0* | 4.1±0.12*** | 31.011.1* |
| 3-суточные | 0.231 | 34.0±1.1** | 4.0Ю.09*** | 24.011.2* |
| 4-суточные | 0.15 | 30.011.2*** | 3.2±0.11 | 19.011.3** |
| 5- суточные | 0.05 | 28.0±1.3 | 2.310.15 | 14.011.1*** |
строго оценивать значение отдельных фракций катионных белков нейтрофилов в модуляции фагоцитарной активности макрофагов.
Нами было изучено влияние лактоферрина и дефенсинов кролика, исходно отсутствующих в резидентных перитонеальных макрофагах, на фагоцитоз последними стафилококков in vitro. Установлено дозозависимое стимулирующее функциональную активность макрофагов действие испытанных белков. При этом выявлено, что лактоферрин имеет большее влияние на поглотительную способность клеток, тогда как дефенсины в концентрации 50 мкг/мл активнее стимулировали дыхательную функцию макрофагов. Первое может найти частичное объяснение в рамках представления об опсонизирующих свойствах лактоферрина, имеющего рецепторы на некоторых типах макрофагов.
Таким образом, совокупность приведенных экспериментальных данных свидетельствует в пользу выдвинутой В.Е. Пигаревским гипотезы о резорбтивной клеточной резистентности как об одном из механизмов осуществления неспецифических защитных реакций в организме человека и животных. Ряд зарубежных исследователей также установили сходные воздействия со стороны катионных белков нейтрофилов на функции макрофагов, Из этого следует, что эстафетная передача катионных пептидов и белков от нейтрофилов к макрофагам может рассматриваться в качестве одного из биохимических механизмов межклеточной кооперации, направленных на обеспечение барьерных функций организма против инфекционных факторов в период, предшествующий развитию специфических иммунных реакций. При этом резорбированные катионные белки и пептиды нейтрофилов через модуляцию функциональной активности макрофагов могут участвовать в формировании уже и специфических защитных реакций организма. Отдельные сведения в этом направлении исследований получены как отечественными, так и зарубежными учеными. По их мнению, биологически активные соединения нейтрофилов могут играть важную роль в инициации каскада клеточно-гуморальных взаимодействий, направленных на формирование специфического иммунного ответа при инфекционной патологии.
Исследования последних лет продемонстрировали еще ряд возможных путей вовлечения антимикробных пептидов и белков в регуляцию защитных реакций организма. В частности, японскими исследователями было изучено влияние дефенсинов как одного из ведущих молекулярных факторов кислороднезависимой антимикробной системы нейтрофильных гранулоцитов на ряд функциональных свойств этих клеток, таких как адгезия, хемотаксис, поглощение объектов фагоцитоза, продукция супероксиданиона. Дефенсины морской свинки в концентрации 15 нг/мл увеличивают экспрессию CDUb, CDllc и CD54 на поверхности нейтрофильных гранулоцитов от 42.1±1.6 до 58.3±2.3% и адгезию НГ морской свинки и человека. Они ингибируют продукцию супероксидных анионов в процессе фагоцитоза комплемент-опсонизированных частиц зимозана, но не влияют.
Похожие работы
... – переносят в кишечник новорожденного железо, витамины и другие важные соединения. Сывороточный белок α-лактоглобулин имеет специфическую функцию: он необходим для процесса синтеза лактозы. Казеин. Среднее количество его в молоке составляет 81% от общего содержания белков в молоке. Химически чистый казеин – белое аморфное вещество без запаха и вкуса – практически не растворяется в воде. ...
... , определяющих структуру острофазовых белков и Р-дефенсина эпителия трахеи, свидетельствует о существовании ряда единых принципов молекулярной организации и регуляции генов в процессе эволюции животного мира. 2. Дефенсины скорпионов Скорпионы принадлежат к тому же типу членистоногих, что и класс насекомых. Они по одной из классификаций составляют подкласс Scorpiones в составе класса Arach-nida ...
... - антиметаболит аргинина, лизина или гистидина, синтезируемое Act. macrosporus (термофилл). 2. Единицы биологической активности. Выражение величин биологической активности антибиотиков обычно производят в условных единицах, содержащихся в 1 мл раствора (ед/мл) или в 1 мг препарата (ед/мг). За единицу антибиотической активности принимают минимальное количество антибиотика, способное подавить ...
... добавки при производстве некоторых хлебных изделий, печенья, продуктов детского питания, в концентрат цельного или обезжиренного молока и другие продукты. Маточное молочко Маточное молочко - это секрет, выделяемый глоточными и верхнечелюстными железами медоносных пчел. Основную массу маточного молочка пчелы способны вырабатывать с 4-6 до 12-15-дневного возраста. В этот период пчелы ...


0 комментариев