Навигация
Термодинаміка і синергетика
Дипломна робота
з фізики
на тему
ТЕРМОДИНАМІКА
ЗМІСТ
ВВЕДЕННЯ
РОЗДІЛ 1. ОСНОВНІ ПОНЯТТЯ І ПОЧАТКОВІ ПОЛОЖЕННЯ ТЕРМОДИНАМІКИ
1.1 Закриті і відкриті термодинамічні системи
1.2 Нульовий початок термодинаміки
1.3 Перший початок термодинаміки
1.4 Другий початок термодинаміки
1.4.1 Оборотні і необоротні процеси
1.4.2 Ентропія
1.5 Третій початок термодинаміки
РОЗДІЛ 2. ОСНОВНІ ПОНЯТТЯ І ПОЛОЖЕННЯ СИНЕРГЕТИКИ. САМООРГАНІЗАЦІЯ РІЗНИХ СИСТЕМ
2.1. Загальна характеристика відкритих систем
2.1.1 Диссипативні структури
2.2 Самоорганізація різних систем і синергетики
2.3 Приклади самоорганізації різних систем
2.3.1 Фізичні системи
2.3.2 Хімічні системи
2.3.3 Біологічні системи
2.3.4 Соціальні системи
РОЗДІЛ 3. АНАЛІТИЧНІ І ЧИСЕЛЬНІ ДОСЛІДЖЕННЯ САМООРГАНІЗАЦІЇ РІЗНИХ СИСТЕМ
3.1 Осередки Бенара
3.2 Лазер, як система, що самоорганізовується
3.3 Біологічна система
3.3.1 Динаміка популяцій. Екологія
3.3.2 Система «Жертва - Хижак»
ВИСНОВОК
ЛІТЕРАТУРА
ВВЕДЕННЯ
Наука зародилася дуже давно, на Стародавньому Сході, і потім інтенсивно розвивалася в Європі. У наукових традиціях довгий час залишався недостатньо вивченим питання про взаєминах цілого і частині. Як стало ясно в середині 20 століть частина може перетворити ціле радикальним і несподіваним чином.
З класичної термодинаміки відомо, що ізольовані термодинамічні системи відповідно до другого початку термодинаміки для необоротних процесів ентропія системи S зростає до тих пір, поки не досягне свого максимального значення в стані термодинамічної рівноваги. Зростання ентропії супроводжується втратою інформації про систему.
З часом відкриття другого закону термодинаміки встало питання про те, як можна погоджувати зростання з часом ентропії в замкнутих системах з процесами самоорганізації в живій і не живій природі. Довгий час здавалося, що існує суперечність між виведенням другого закону термодинаміки і виводами еволюційної теорії Дарвіна, згідно якої в живій природі завдяки принципу відбору безперервно відбувається процес самоорганізації.
Суперечність між другим початком термодинаміки і прикладами високоорганізованого навколишнього нас світу була дозволена з появою більше п'ятдесяти років тому і подальшим природним розвитком нелінійної нерівноважної термодинаміки. Її ще називають термодинамікою відкритих систем. Великий внесок до становлення цієї нової науки внесли І.Р. Прігожін, П. Гленсдорф, Г. Хакен. Бельгійський фізик російського походження Ілля Романовіч Прігожін за роботи в цій області в 1977 році був удостоєний Нобелівської премії.
Як підсумок розвитку нелінійної нерівноважної термодинаміки з'явилася абсолютно нова наукова дисципліна синергетика - наука про самоорганізацію і стійкість структур різних складних нерівноважних систем: фізичних, хімічних, біологічних і соціальних.
У справжній роботі досліджується самоорганізація різних систем аналітичними і чисельними методами.
РОЗДІЛ 1. ОСНОВНІ ПОНЯТТЯ І ПОЧАТКОВІ ПОЛОЖЕННЯ ТЕРМОДИНАМІКИ
1.1 ЗАКРИТІ І ВІДКРИТІ ТЕРМОДИНАМІЧНІ СИСТЕМИ
Всякий матеріальний об'єкт, всяке тіло, що складається з великого числа частинок, називається макроскопічною системою . Розміри макроскопічних систем значно більше розмірів атомів і молекул. Всі макроскопічні ознаки, що характеризують таку систему і її відношення до навколишніх тіл, називаються макроскопічними параметрами . До їх числа відносяться такі, наприклад, як щільність, об'єм, пружність, концентрація, поляризована, намагніченість і так далі Макроскопічні параметри розділяються на зовнішніх і внутрішніх .
Величини, визначувані положенням не вхідних в нашу систему зовнішніх тіл, називаються зовнішніми параметрами, наприклад напруженість силового поля ( оскільки залежать від положення джерел поля - зарядів і струмів, що не входять в нашу систему ), об'єм системи ( оскільки визначається розташуванням зовнішніх тіл ) і так далі Отже зовнішні параметри є функціями координат зовнішніх тіл. Величини, визначувані сукупним рухом і розподілом в просторі вхідних в систему частинок, називаються внутрішніми параметрами, наприклад енергія, тиск, щільність, намагніченість, поляризована і так далі ( оскільки їх значення залежать від руху і положення частинок системи і вхідних в них зарядів ).
Сукупність незалежних макроскопічних параметрів визначає стан системи, тобто форму її буття. Величини, які не залежать від передісторії системи і повністю визначувані її станом в даний момент (тобто сукупністю незалежних параметрів ), називаються функціями стану.
Стан називається стаціонарним, якщо параметри системи з часом не змінюються.
Якщо крім того, в системі не тільки всі параметри постійні в часі, але і немає ніяких стаціонарних потоків за рахунок дії яких-небудь зовнішніх джерел, то такий стан системи називається рівноважним ( стан термодинамічної рівноваги). Термодинамічними системами зазвичай називають не всякі, а тільки ті макроскопічні системи, які знаходяться в термодинамічній рівновазі. Аналогічно, термодинамічними параметрами називаються ті параметри, які характеризують систему в термодинамічній рівновазі.
Внутрішні параметри системи розділяються на інтенсивних і екстенсивних . Параметри не залежні від маси і числа частинок в системі, називаються інтенсивними ( тиск, температура і ін.) . Параметри пропорційні масі або числу частинок в системі, називаються адитивними або екстенсивними ( енергія, ентропія і ін.). Екстенсивні параметри характеризують систему як ціле, тоді як інтенсивні можуть приймати певні значення в кожній точці системи.
За способом передачі енергії, речовини і інформації між даної системи і навколишнім середовищем термодинамічні системи класифікуються:
1. Замкнута ( ізольована ) система - це система в якій немає обміну із зовнішніми тілами ні енергією, ні речовиною ( у тому числі і випромінюванням ), ні інформацією.
2. Закрита система - система в якій є обмін тільки з енергією.
3. Адіабатна ізольована система - це система в якій є обмін енергією тільки у формі теплоти.
4. Відкрита система - це система, яка обмінюється і енергією, і речовиною, і інформацією.
1.2 НУЛЬОВИЙ ПОЧАТОК ТЕРМОДИНАМІКИ
Нульовий початок термодинаміки сформульований всього біля 50 років назад, по суті є отриманим «заднім числом» логічним виправданням для введення поняття температури фізичних тіл . Температура - одне з найглибших понять термодинаміки . Температура грає таку ж важливу роль в термодинаміці, як, наприклад процеси. Вперше центральне місце у фізиці зайняв абсолютно абстрактне поняття ; воно прийшло на зміну введеному ще в часи Ньютона ( 17 вік) поняттю сили - на перший погляд конкретнішому і «відчутнішому» і до того ж успішно «математезірованому» Ньютоном.
Перший початок термодинаміки встановлює внутрішня енергія системи є однозначна функція її стану і змінюється тільки під впливом зовнішніх дій.
У термодинаміці розглядаються два типи зовнішніх взаємодій: дія, пов'язана із зміною зовнішніх параметрів системи ( система здійснює роботу W ), і дія не пов'язані із зміною зовнішніх параметрів і обумовлені зміною внутрішніх параметрів або температури ( системі повідомляється деяка кількість теплоти Q ).
Тому, згідно першому початку, зміна внутрішній енергії U2-U1 системи при її переході під впливом цих дій з першого стану в друге рівно сумі алгебри Q і W, що для кінцевого процесу запишеться у вигляді рівняння
U2 - U1 = Q - W або Q = U2- U1+ W (1.1)
Перший початок формується як постулат і є узагальненням великої кількості досвідчених даних.
Для елементарного процесу рівняння першого початку такого :
dQ = dU + W (1.2)d
dQ і dW не є повним диференціалом, оскільки залежать від шляху проходження.
Залежність Q і W від шляху видно на простому прикладі розширення газу. Робота досконала системою під час переходу її із стану 1 в 2 ( мал. 1) по дорозі а зображується площею, обмеженою контуром А1а2ва :
Wа = p(V,T) dV ;
а робота при переході по дорозі в - площею обмежену контуром А1в2ва:
Wb = p(V,T) dV.
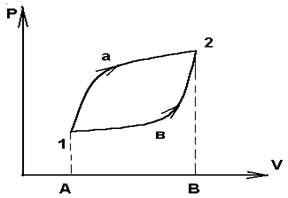
Мал. 1
Оскільки тиск залежить не тільки від об'єму, але і від температури, то при різних змінах температури на шляху а і в під час переходу одного і того ж початкового стану (p1,V1) в одне і теж кінцеве (p2,V2) робота виходить різною. Звідси видно, що при замкнутому процесі (циклі) 1а2в1 система здійснює роботу не рівну нулю. На цьому заснована робота всіх теплових двигунів.
З першого початку термодинаміки виходить, що робота може здійснюватися або за рахунок зміни внутрішній енергії, або за рахунок повідомлення системи кількості теплоти . У випадку якщо процес круга, початковий і кінцевий стан співпадають U2- U1 = 0 і W = Q, тобто робота при круговому процесі може здійснюватися тільки за рахунок отримання системою теплоти від зовнішніх тіл .
Перший початок можна сформулювати в декількох видах :
1. Неможливе виникнення і знищення енергії .
2. Будь-яка форма руху здатна і повинна перетворюватися на будь-яку іншу форму руху .
3. Внутрішня енергія є однозначною формою стану .
4. Вічний двигун першого роду неможливий .
5. Нескінченна мала зміна внутрішній енергії є повним диференціалом.
6. Сума кількості теплоти і роботи не залежить від шляху процесу.
Перший закон термодинаміки, постулювавши закон збереження енергії для термодинамічної системи. не указує спрямування процесів, що відбуваються в природі. Спрямування термодинамічних процесів встановлює другий початок термодинаміки.
Похожие работы
... а потім дві незалежні частоти. Хаотичний режим, що характеризується суцільним спектром, з'являвся відразу слідом за квазіперіодичною двохчастотною течією. Розділ 5. Застосування понять фізики відкритих систем до моделювання обробки інформації. Знання основних закономірностей утворення структур в активних середовищах, а також у мережах, що складаються з великої кількості активних елементів, ...
... это то, что устраняет неопределенность, количество "снятой" неопределенности. Тенденция к определенности, к повышению информативности - процесс негэнтропийный (процесс с обратным знаком). Термин "самоорганизующаяся система" ввел кибернетик У. Росс Эшби для описания кибернетических систем. Для самоорганизующихся систем характерны: 1) Способность активно взаимодействовать со средой, изменять ...
... проблемы, где соответствующей проверки не производилось. При обнаружении расхождений так создаваемых концепций с реально наблюдаемыми явлениями неизбежно возникало недоумение, граничащее с попытками отрицания самой возможности познания окружающего мира. Современное естествознание характеризуется лавинообразным накоплением нового фактического материала и возникновением множества новых дисциплин ...
... субъекта (Юм), априорным формам мышления (Кант), целевым установкам личности (прагматизм), интерсубъективным конвенциям (А. Пуанкаре) и др. Фундаментальными проблемами в данной сфере выступали в классической философии проблема критерия И., трактовка которого соответствовала принятому определению И. (от эйдотического образца у Платона до Божественной Мудрости у Фомы Аквинского, с одной стороны, и ...


0 комментариев