Навигация
2.6 Хроматография на бумаге
По механизму разделения различают распределительную, адсорбционную, осадочную и другие виды бумажной хроматографии (БХ). В распределительной жидкость-жидкостной хроматографии бумага, приготовленная из специальных сортов хлопка, выполняет роль носителя неподвижной жидкой фазы (НФ), в качестве которой часто выступает вода, адсорбированная парами бумаги. В таком случае гидрофильная бумага используется для нормально-фазовой хроматографии.
Растворителями (ПФ) являются спирты (метанол, этанол, н-пропанол, бутанол), простые эфиры (этиловый, метиловый), кетоны (ацетон, ацетил-ацетон), эфиры органических кислот (метилацетат, этилацетат), пиридин, хлороформ. Чаще используются смеси растворителей. Так, для разделения неорганических неполярных веществ употребляют системы:
- ацетон: НCl: Н2О (в различных соотношениях);
- Н-бутанол, насыщенный НСl (различной концентрации);
- Н-бутанол: 0,1М НNОз - ацетилацетон.
Для разделения некоторых органических веществ используют метод обращенных фаз. В этом методе для придания бумаге гидрофобного характера ее импрегнируют (пропитывают) нафталином, парафином, раствором каучука, силиконом и др. Такая бумага служит носителем для неполярных растворителей в качестве НФ. В качестве ПФ применяют смеси кислот с низшими спиртами.
Обращеннофазовая бумажная хроматография используется, например, для разделения и идентификации полинасыщенных жирных кислот при изучении состава липидов, выделенных из животных тканей. Бумагу пропитывают 5% раствором силикона, в качестве ПФ используют 85% раствор уксусной кислоты.
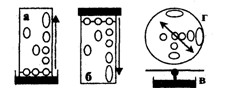
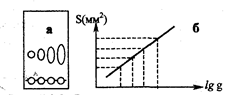
Рис.2.6.1 Виды бумажной хроматографии
Разделение веществ в распределительной БХ осуществляется благодаря различию в скоростях движения компонентов при многократном повторении актов экстракции и сорбции. Скорость перемещения компонентов зависит от их коэффициентов распределения (как и в методе экстракции).
По направлению движения элюента (ПФ) различают восходящую, нисходящую и радиальную (круговую) хроматографию.
Если элюент движется по бумаге вверх, метод называют восходящей (а) бумажной хроматографией; при его движении сверху вниз - нисходящей (б) бумажной хроматографией. Очень быстро можно осуществить хроматографический анализ методом радиальной (в) бумажной хроматографии, в котором используется бумажный круг (г) с фитилем, опущенным в элюент.
Иногда при сложном составе пробы не удается разделить ее компоненты с помощью одного растворителя. Тогда применяют двумерную хроматографию. В угол квадратного листа хроматографической бумаги наносят хроматографической бумаги наносят раствор пробы и хроматографируют сначала в одном элюенте, затем, повернув хроматограмму на 90, - в другом. Первый элюент производит предварительное разделение компонентов пробы, второй окончательное.
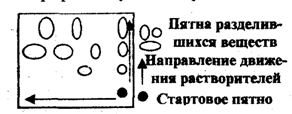
Рис.2.6.2 Двухмерная хроматография
Для проведения хроматографии на бумаге используют стеклянные герметизированные камеры. Внутри камеры в верхней (нисходящий вариант) или нижней ее части (восходящий вариант) помещают сосуд для подвижной фазы (лодочку).
Радиальную хроматографию можно осуществить в чашке Петри. Детекцию зон, идентификацию и количественное определение в БХ проводят также, как и в методе тонкослойной хроматографии.
Методом распределительной жидкостной бумажной хроматографии успешно анализируют смеси катионов в неорганическом качественном анализе, смеси аминокислот и других органических кислот, пептидов, пестицидов, фенолов, красителей, синтетических поверхностно-активных веществ.
2.7 Гельпроникающая (молекулярно-ситовая) хроматография
Гельпроникающая хроматография (ГПХ) представляет собой метод разделения молекул, основанный на различии из размеров.
В качестве НФ в ГПХ используют частицы, имеющие определенные размеры пор. Это различного рода гели (мягкие, полужесткие и жесткие). В качестве ПФ служат водные или органические элюенты. Принцип разделения молекул в ГПХ состоит в том, что молекулы анализируемых веществ распределены между неподвижным растворителем в порах сорбента и растворителем, протекающим через слой НФ. Молекулы, которые имеют размеры, позволяющие им проникать в поры сорбента при движении вдоль колонки, часть времени теряют на пребывание в порах. Молекулы, имеющие размеры, превышающие размеры пор, не проникают в сорбент и вымываются из колонки со скоростью движения элюента. Молекулы, которые проникают в поры всех размеров, движутся наиболее медленно. Снижение скорости движения веществ вдоль колонки тем больше, чем в большее число пор способны диффундировать распределяемые частицы.
Таким образом, при помощи ГПХ можно разделить смеси веществ в зависимости от размеров их молекул. Выход веществ из колонки происходит в порядке уменьшения их молекулярной массы. Так можно разделить полипептиды, белки и другие макромолекулы.
Гельпроникающая хроматография на колонке используется для очистки пестицидов, а также жирорастворимых витаминов перед их определением методом ВЖХ.
Электрофорез
Метод анализа, основанный на способности заряженных частиц к передвижению во внешнем электрическом поле называют электрофорезом (от “электро” и греческого phoresis — перенесение).
Электролиз относится к методам разделения без превращения веществ, на основе заряда частиц. По технике выполнения метод аналогичен хроматографии, поэтому и рассматривается в этой главе.
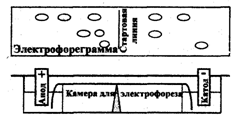
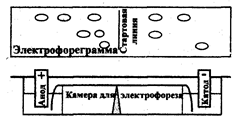
Рис 2.7.1 Схема прибора для электрофореза
Нередко под электрофорезом понимают перемещение коллоидных частиц или макромолекул, в отличие от иовофореза - перемещения неорганических ионов малого размера.
Передвижение частиц при электрофорезе зависит от ряда факторов, основными из которых являются: напряженность электрического поля; величина электрического заряда; скорость и размер частицы; вязкость, рН и температура среды, а также продолжительность электрофореза.
Электрофорез можно проводить как в свободном растворе (фронтальный электрофорез), так и на носителях (зональный электрофорез). Последний вариант предпочтительнее, т.к. носители способствуют стабилизации электрофоретических зон. В качестве носителей используют: фильтровальную бумагу, силикагель, крахмал, оксид алюминия, поливинилхлорид, агаровый и полиакриламидный гели и др.
Электрофоретическое разделение осуществляют на бумаге, в тонком слое сорбента, колонке или в блоке (который часто формируют из суспензии крахмала в подходящем электролите).
Аппаратура для электрофореза выполняется по единой схеме: источник тока, камера для электрофореза, два электрода, соединяющих камеру с источником тока и приспособление для сбора и идентификации разделенных веществ (последний блок в некоторых случаях отсутствует). Для электрофореза используют как готовые наборы аппаратуры (универсальный прибор для иммуноэлектрофореза и электрофореза белков на бумаге и крахмале, набор для электрофореза в полиакриламидном геле венгерской фирмы Реанал), так и наборы, составляемые экспериментатором из отдельных приборов.
На рис. 2.7.1 представлена схема прибора для электрофореза на бумаге. Электрофоретическая камера состоит из двух кювет, в которые помещают графитовые электроды и раствор проводящей жидкости (буферный раствор). Выше кювет находится подставка для носителя бумаги. Смесь веществ, подлежащих разделению, наносят на пропитанную проводящей жидкостью бумагу. Бумагу подсушивают, помещают на подставку, концы погружают в кюветы, затем камеру плотно закрывают крышкой. После пропитывания бумаги проводящей жидкостью подключают электрический ток. По окончании электрофореза бумагу подсушивают. Качественную и количественную оценку осуществляют, применяя методы, используемые в бумажной хроматографии, например, проявление белков с помощью красителей, количественную оценку - методом денситометрии.
Важной областью применения электрофореза является анализ белков сыворотки крови, аминокислот гидролизатов белков, нуклеиновых кислот и т.п. В кислотном буферном растворе аминокислота находится в виде катиона NHз+......COOH, который будет перемещаться к катоду, в то время как в щелочном буфере аминокислота превращается в анион NH2....COO-, и будет двигаться к аноду. В изоэлектрической точке аминокислота находится в растворе в виде биполярного иона NH3+......COO- и не будет передвигаться в электрическом поле.
Похожие работы
... . Если элюент движется по бумаге вверх, метод называют восходящей (а) бумажной хроматографией; при его движении сверху вниз - нисходящей (б) бумажной хроматографией. Очень быстро можно осуществить хроматографический анализ методом радиальной (в) бумажной хроматографии, в котором используется бумажный круг (г) с фитилем, опущенным в элюент. (рис. 3.4.1) Иногда при сложном составе пробы не ...
... настоящее время все чаще пчелиный мед получают не только для собственных нужд, но и в производственном масштабе с применением тех или иных технологических схем и технологий и возникает необходимость контроля качества меда на тех или иных стадиях производства по тем или иным показателям. При оценке качества пчелиного меда обычно преследуют четыре цели. 1. Устанавливают соответствие исследуемого ...
... зависит от содержания сухих веществ, поэтому по нему контролируют СОМО, содержание белка и определяют йодное число методами рефрактометрии. Диэлектрическая постоянная молока и молочных продуктов определяется качеством и энергией связи влаги. Для воды диэлектрическая постоянная составляет 81, для молочного жира-— 3,1—3,2. По диэлектрической постоянной контролируют содержание влаги в масле и сухих ...
... («Жасмин», «Сирень», «Фиалка» и др.), и фантазийные, сочетающие несколько запахов цветов или запахов, не встречающихся в природе («Пуазон », «Шалимар», «Красная Москва» и др.). Парфюмерно-косметические товары бывают: · по месту происхождения (Французские, Американские) · по фирмам-изготовителям “Кристиан Диор”, “Ланком”, “Ив Роше” · по консистенции: жидкие, сухие, на ...


0 комментариев