РЕФЕРАТ
на тему:
«Мікрофлора грунту»
Серед природних середовищ ґрунт краще забезпечує розвиток і життєдіяльність мікроорганізмів, і, разом з тим, найбільше змінюється під їхнім впливом. Кількість мікроорганізмів у різних ґрунтах коливається в широких межах. Так, 1 г чорнозему містить до З млрд. клітин, підзолу - від 300 млн. до 2 млрд. клітин, піщаних Ґрунтів - до 100 тис. клітин.
Ґрунти містять достатню кількість води, повітря та поживних речовин. У складі ґрунтів виділяють три фази: тверду, рідку і газоподібну.
Тверда фаза утворена мінеральними та органічними речовинами. На твердих частинках грунту зосереджені основні поживні речовини: гумус, органо-мінеральні колоїди, іони Са, Mg тощо. Більшість ґрунтових мікроорганізмів знаходиться на поверхні частинок ґрунту, на органічних залишках та живих коренях рослин, при цьому вони розміщені у вигляді колоній в окремих зонах.
Рідка фаза - ґрунтовий розчин, що заповнює капіляри грунту і утворює навколо твердих частинок плівки різної товщини. Вміст води у ґрунті визначає його аерацію. Великі маси води знижують аерацію ґрунту, сприяють розвитку анаеробних процесів. У складі ґрунтових розчинів виявлено мінеральні, органо-мінеральні та органічні речовини в молекулярно-розчиненому або колоїдному станах. Вміст цих речовин неоднаковий в ґрунтах різних типів і залежить від горизонту грунту та сезону року. Так, найбільша кількість органічних речовин виявлена в підзолах та болотяних ґрунтах; у чорноземі співвідношення органічних та мінеральних речовин приблизно однакове; в каштанових ґрунтах та сіроземах більше мінеральних речовин, ніж органічних. Верхні шари грунту містять більше органічних речовин, ніж нижні.
Газоподібна фаза - повітря ґрунту, що становить 25-70% його загального об'єму. Повітря ґрунту відрізняється від атмосферного значним зростанням вмісту С02 (1,5-3,0% і вище проти 0,03% в атмосферному повітрі) і зменшенням кисню, що відбувається за рахунок мінералізації органічних речовин. Повітря ґрунту збагачене метаном, воднем, азотом, оксидами азоту та вуглецю, леткими органічними сполуками.
Отже, ґрунт - це динамічна, гетерогенна система, яка забезпечує для розвитку мікроорганізмів різні умови аерації, вологості, рН, різну концентрацію поживних речовин тощо.
Ґрунт - не тільки середовище для існування мікроорганізмів, але й продукт їхньої життєдіяльності. Всі ґрунти нашої планети утворилися з материнських гірських порід внаслідок взаємодій двох процесів - вивітрювання та ґрунтоутворення.
Вивітрювання - початковий етап руйнування гірських порід при одночасній дії фізичних, хімічних та біологічних факторів. Важливу роль у деструкції мінералів відіграють нітрифікуючи та тонові бактерії, гриби, актиноміцети. Для руйнування кристалічної решітки мінералів і переходу хімічних елементів у рухомий стан важливе значення мають ферментні системи цих мікроорганізмів і продукти їхньої життєдіяльності (органічні і мінеральні кислоти, хелатуючі агенти, слизи). Під впливом мікроорганізмів, фізичних та хімічних факторів гірська порода перетворюється у дрібнозем.
Паралельно з вивітрюванням проходять процеси ґрунтоутворення, в результаті яких формуються різні типи ґрунтів.. Найважливішими серед них є мінералізація рослинних і тваринних рештків, утворення гумусу та його руйнування.
Різноманітний за хімічним складом опад рослин мінералізують численні неспорові і спорові бактерії родів Pseudomonas, Arthrobacter, Cytophaga, Mycobacterium, Bacillus, Clostridium тощо, гриби родів Penicillium, Fusarium, Mucor, Aspergillus тощо, актиноміцети. Швидкість руйнування залежить від хімічної будови речовини. Деструкція простих вуглеводів, білків, крохмалю здійснюється за короткий час. Найповільніше за усіх мінералізуються клітковина і лігнін.
Продукти розпаду органічних речовин (феноли, хінони, ароматичні альдегіди, пептиди, амінокислоти, уронові кислоти тощо) використовуються мікроорганізмами у процесах синтезу гумусу (перегною), який є комплексом складних високомолекулярних сполук (гумусові кислоти, гуміни та прогумінові речовини). Нагромадження гумусу - довготривалий процес, і саме гумус забезпечує особливу властивість ґрунтів - родючість.
Завдяки особливостям хімічної структури і здатності утворювати комплекси з мінеральною частиною ґрунту, гумус забезпечує його гідрофільні та іонообмінні властивості, зокрема, фіксацію та вивільнення кальцію, заліза, фосфору, алюмінію та інших елементів. Гумус впливає на структуру ґрунту, його повітряний, водний та тепловий режими. Він служить джерелом енергії та поживних речовин для мікроорганізмів-деструкторів гумусу. Мінералізація гумусу мікроорганізмами збагачує ґрунти на вуглець та азотовмісні сполуки, які засвоюються рослинами.
Здійснюючи різноманітні процеси у ґрунті, мікроорганізми взаємодіють між собою та з іншими живими організмами. У природних угрупованнях при взаємодії з рослинами і тваринами виникають певні трофічні та метаболічні зв'язки (симбіоз, антагонізм, коменсалізм, аменсалізм, паразитизм та хижацтво). У зоні коренів рослин (ризосфера) розвиваються азотфіксатори, амоніфікатори, а також патогенні бактерії. Багато мікроорганізмів продукує фітогормони, ауксини, цитокініни, деякі синтезують інгібітори росту рослин.
Складні симбіотичні зв'язки виникають між мікроорганізмами та безхребетними тваринами ґрунтів. Мікроби служать їжею для мікрофауни грунту.
Мікрофлора ґрунту дуже різноманітна і залежить від його структури, хімічного складу, аерації, освітлення, наявності вологи, поживних речовин тощо. На склад мікрофлори ґрунту мають вплив кліматичні фактори, пори року, характер рослинного покрову, методи обробки грунту, глибина.
Поверхневий шар грунту досить бідний на мікроорганізми. Це пояснюється постійною дією ультрафіолетових променів та підсушуванням.
Найбільше бактерій знаходиться у верхньому шарі грунту на глибині 5-15 см. На глибині 25 см їх кількість у 10-20 разів менша. У більш глибоких шарах (2,0-6,0 м) зустрічаються поодинокі бактерії.
Мікрофлора ґрунту представлена грибами, актиноміцетами, переважно гнильними, маслянокислими, азотфіксуючими, нітрифікуючими, денітрифікуючими, целюлозорозкладаючими, сірко-та залізобактеріями. У меншій кількості знаходяться водорості, дріжджі, бактеріофаги. У ґрунті можуть зустрічатися такі патогенні бактерії, як збудники правцю, газової гангрени, бруцельозу, сибірської язви, бутулізму, шлунково-кишкових хвороб. Ці мікроорганізми потрапляють грунт з органічними викидами, стічними водами. Вони, як правило, у ґрунті не живуть, але зберігаються тривалий час. У ґрунті виявлено гриби, які викликають токсичну алейкію, ерготизм, аспергільоз, хромомікоз та інші захворювання.
Ґрунти, які містять патогенні мікроорганізми, завжди становлять потенційну загрозу в епідеміологічному відношенні. Забруднення мікроорганізмами харчових продуктів є небезпечним для здоров'я людини.
Показником санітарного стану ґрунту є загальна кількість у ньому сапрофітів, термофільних мікроорганізмів, бактерій групи кишечних паличок, протею, анаеробів (Clostridium perfringens). Ґрунт досліджують на наявність патогенних мікроорганізмів (сальмонели, шигели, ентеровіруси), спор правця, сибірської язви та ін. Якщо в 1 г ґрунту міститься 1.5-2.0 млн бактерій його вважають чистим, якщо 2.0-2.5 млн. бактерій - мало забрудненим, якщо 2,5-3,0 млн. бактерій - помірно забрудненим, якщо 3,0-5,0 млн. бактерій - сильно забрудненим.
Важливе значення санітарно-бактеріологічні обстеження ґрунту мають при плануванні та будівництві населених пунктів, обстеженні територій дитячий закладів, шкіл, місць для ігор, лікарень, харчових підприємств.
Дослідження мікрофлори ґрунту будь-яким методом дає надійні результати тільки тоді, коли правильно відібрано ґрунтові зразки. При дослідженні оранки знімають верхній двосантиметровий шар і відбирають з глибини всього орного шару. При вивченні мікрофлори ґрунтового профілю роблять ґрунтовий розріз і відбирають проби з генетичних горизонтів (знизу доверху).
Рекомендується використовувати стерильній бур, лопату та ніж. Відібрані зразки вміщують у стерильні скляні колби або в стерильні поліетиленові мішечки з етикетками, де позначено місце відбору зразка, горизонту тощо. Аналіз зразків необхідно проводити в той же день. Допускається витримування зразків у холодному приміщенні не більше двох діб. При висушуванні зразків кількість мікробів різко
Для одержання середньої проби грунту необхідно змішати окремі зразки, кількість яких залежить від рельєфу та площі, звідки їх відібрано. Рекомендується з площі 100 м2 відбирати проби у трьох місцях, понад 100 м2 - у п'яти, а з 1 га й більшої площі — у 15 місцях. Підготовлену середню пробу використовують для проведення аналізів, залежно від мети досліду використовують той чи інший метод дослідження.
1. Бактеріоскопічний метод С. М. Виноградського (в модифікації О. Г. Шульгіної). Виготовляють мікропрепарати з ґрунтової суспензії і фарбують еритрозином. Кількість бактерій у ґрунті визначають прямим підрахунком під мікроскопом.
Із середньої проби грунту відважують 5 г, розтирають у ступці та вносять у конічну колбу об'ємом 250—300 мл, додають 50мл стерильної водогінної води і збовтують протягом 5хв на спеціальному апараті. Після осідання великих частинок (протягом 3—5сек) стерильною градуйованою мікропіпеткою відбирають 0,01 мл зависі суспензії та наносять її на знежирене предметне скло. До суспензії на склі додають краплю 0,01 %-го розчину агару (агар заздалегідь промивають і виготовляють на дистильованій воді). Суспензію перемішують з агаром і стерильним накривним скельцем розподіляють по предметному склу за допомогою трафарету на площі 4 см2. Після цього препарат підсушують, фіксують 96 %-м спиртом і фарбують карболовим еритрозином (занурюють скло в розчин барвника і витримують протягом 30 хв., а при потребі й до 24 год.). Залишок фарби змивають, занурюючи препарат у воду (тильною стороною), підсушують і вивчають під мікроскопом за допомогою імерсійної системи.
2. Метод підрахунку на агарових пластинках. Цей метод за своєю точністю значно поступається перед методом С. М. Виноградського та дає тільки орієнтовні дані, переважно про кількість аеробних мікробів у ґрунті. Проте внаслідок простоти і доступності його дуже часто застосовують у навчальних мікробіологічних лабораторіях. Згідно з цим методом ґрунтову суспензію висівають на тверді поживні середовища, вирощують на них колонії, підраховують та аналізують вирощені мікроорганізми.
Проведення роботи. Із зразка досліджуваного грунту відважують 1 г і роблять серію розведень у стерильній воді для одержання ґрунтової витяжки. Розведення готують так: у стерильну мірну колбу об'ємом 100 мл вносять 1 г грунту, додають 99 мл стерильної води і збовтують впродовж 3 хв. Потім відстоюють 1,5 хв. і роблять наступне розведення (рис. 36).
Для виготовлення кожного наступного розведення беруть окрему стерильну піпетку. У стерильні чашки Петрі стерильною піпеткою вносять 1 мл ґрунтової суспензії (наприклад, 1:100 000) і розподіляють рівномірно по дну. Розплавлене стерильне середовище (МПА, БПА, КАА, ґрунтовий агар) із пробірки виливають у чашку і, обережно похитуючи її, перемішують поживне середовище з ґрунтовою суспензією. З одного розведення готують 4—5 таких чашок.
Після застигання середовища для видалення крапель води з кришок чашки Негрі підсушують, позначають і ставлять у термостат при температурі 28—30°С на 3—5 діб. Потім підраховують (без відкривання кришки чашки) кількість колоній, що виросли на агарових пластинках. Найкращі результати одержуються при утворенні на чашках 20—50 колоній бактерій і 20—30 колоній грибів. Для підрахунку кількості колоній зручно користуватися спеціальними приладами для підрахунку колоній.
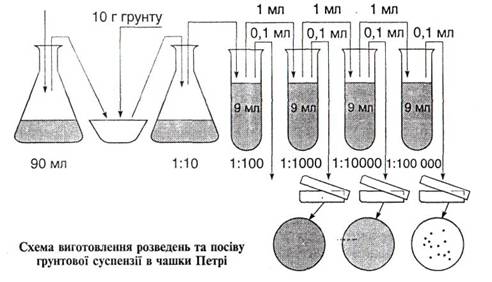
По закінченні підрахунків колоній визначають середнє з 4—5 чашок і множать на розведення, взяте для аналізу. У такий спосіб одержують кількість аеробних мікробів у 1 г сирого грунту. Для точних дослідів кількість мікроорганізмів визначається в 1 г повітряно-сухого, а найточніших — абсолютно сухого грунту. Для таких розрахунків треба водночас визначати вологість ґрунтової проби.
Кількість мікроорганізмів на 1 г повітряно-сухого грунту розраховують за такою формулою:
де А — кількість клітин мікробів у 1 г повітряно-сухого грунту;
Б — середнє число колоній мікроорганізмів у чашці Петрі;
В — відповідне розведення ґрунтової витяжки;
Г— кількість крапель у 1 мл рідини в піпетці;
Д — наважка грунту, взята для аналізу.
3. Метод пластинок обростання (за М. Г. Холодним). На відміну від наведених вище, цей метод дає можливість вивчати цілі мікробні асоціації безпосередньо в ґрунті, тобто в природному середовищі.
На рівній поверхні фунту роблять гострим ножем розріз, глибина якого залежить від досліджуваного ґрунтового горизонту. До вертикальної стінки зрізу щільно прикладають стерильне знежирене предметне скло, на 2—3 см нижче від поверхні грунту. Зверху зріз закривають ґрунтом. Місце, де встановлено скло, позначають. Залежно від мети досліду скло витримують у ґрунті 10—15 днів, а іноді й кілька місяців. Після цього обережно ножем знімають землю й виймають скло.
Поверхню скла, що була притулена до стінки ґрунтового розрізу, висушують на повітрі. Протилежну сторону скла витирають сухою ганчіркою. Препарат фіксують на полум'ї спиртівки. Потім предметне скло занурюють у банку з водою верхньою стороною донизу, внаслідок чого великі частинки грунту відмокають і падають на дно, а мікроби та дрібні частинки залишаються на склі. По закінченні промивання, препарат фарбують карболовим еритрозином (витримують від 30 хв. до 24 год.), висушують і вивчають під мікроскопом з імерсійною системою.
4. Груповий аналіз мікрофлори грунту. Диференційоване виділення з грунту різних фізіологічних груп мікроорганізмів та їхній аналіз можливі при використанні різних поживних середовищ.
Залежно від фізіологічної групи мікробів і методу досліджень застосовують різні елективні та диференціально-діагностичні поживні середовища (МНА, МПА + сусло-агар, КАА, середовища Виноградського, Ешбі, Гільтая, Імшенецького, Чапека та інші). За допомогою цього методу одержують значно більшу кількість мікроорганізмів, ніж користуючись методом пластинок обростання.
![]() Можна рекомендувати виявити і вивчити такі фізіологічні групи: спороносні та неспороносні (пігментоутворюючі) форми бактерій на МПА; групу бацил (В. subtilis, В. mesentericus, В. megaterium, В. се-reus, В. idosus, В. mycoides та інші) на МПА + сусло-агар, міксобактерії на картопляному агарі, актиноміцети на КАА, гриби на сусло-агаровому середовищі тощо.
Можна рекомендувати виявити і вивчити такі фізіологічні групи: спороносні та неспороносні (пігментоутворюючі) форми бактерій на МПА; групу бацил (В. subtilis, В. mesentericus, В. megaterium, В. се-reus, В. idosus, В. mycoides та інші) на МПА + сусло-агар, міксобактерії на картопляному агарі, актиноміцети на КАА, гриби на сусло-агаровому середовищі тощо.
З ґрунтової проби відважують 10 г грунту, висипають його в конічну колбу об'ємом 250 мл, доливають 90 мл стерильної води і збовтують на спеціальному апараті протягом 10 хв. Щоб осіли грубі частинки, суспензію відстоюють, а потім виготовляють з неї серію розведень, і висівають на різні поживні середовища. Водночас відбирають з середньої проби 10 г грунту для визначення вологості, щоб перерахувати результати досліду на абсолютно сухий грунт.
Посів на м'ясо-пептонний агар (МПА). 1 мл ґрунтової суспензії потрібного розведення вносять у стерильну чашку Петрі, сюди ж вливають 12 мл попередньо розплавленого і охолодженого до 45°С МПА і старанно перемішують. Коли ставиться завдання систематизувати мікрофлору за типом колоній, то краще посів робити на поверхні агарових пластинок. Для виявлення бацилярних форм мікробів за Є.М. Мішустіним використовують змішане поживне середовище з МПА і сусло-агару (у відношенні 1:1). Перед посівом на це середовище ґрунтову суспензію прогрівають при температурі 700 С протягом 15 хв для звільнення її від вегетативних форм бактерій.
Засіяні чашки Петрі позначають і розміщують у термостаті при температурі 25—30°С на 3—5 діб. Облік кількості колоній проводять на 3—4-й день. Вивчають культуральні та морфологічні ознаки мікроорганізмів і роблять відповідні висновки.
Посів на картопляний агар. Суспензію ґрунтового зразка (розведення 10~3) висівають на поверхню картопляного агару в чашках Петрі, розміщують у термостаті при температурі 25—30 °С і витримують 10—15 днів. За цей час на агарових пластинках з'являються плодові тіла міксобактерій різної форми і кольору. Препарати старанно вивчають візуально і мікроскопічно.
Посів на сусло-агар. На цьому середовищі можна виділити низку ґрунтових грибів: Mucor, Penicillium, Aspergillus, Rhizopus, Alternaria, Fusarium, Trichoderma та ін.
Перед змішуванням розплавленого сусло-агару з ґрунтовою суспензією до нього додають 2 мл стерильної молочної кислоти або 0,5 г стерильної лимонної кислоти (на 1 л середовища). Посів ґрунтової суспензії проводиться так само, як і на м'ясо-пептонний агар.
Мікроорганізми, які беруть участь у розкладі гумусових речовин, добре ростуть на водному агарі, а також на агаризованій ґрунтовій витяжці. Азотобактер і олігонітрофільні мікроорганізми можна виявляти на середовищі Ешбі.
Аеробні мікроорганізми, що розкладають клітковину, виявляють на рідкому поживному середовищі, склад якого розроблений О.О. Імшенецьким і Л.І. Солнцевою.
Похожие работы
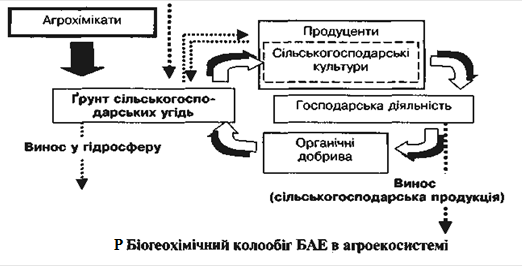
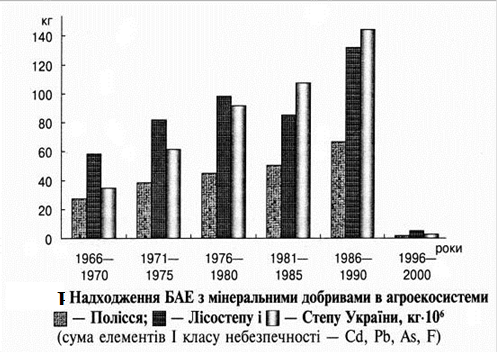
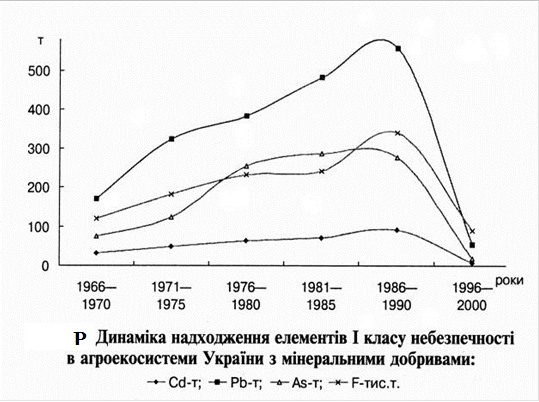
... рунтових вод, а також вод наземних водоймищ із впливом на екотоксикологічний стан водних екосистем. Характер впливу мінеральних добрив на агроекосистеми, передусім, зумовлений їхнім хімічним складом, що, у свою чергу, залежить від особливостей сировини та промислових технологій виробництва. Мінеральні добрива є джерелом надходження багатьох хімічних елементів (ХЕ) та сполук у довкілля. При їхній ...
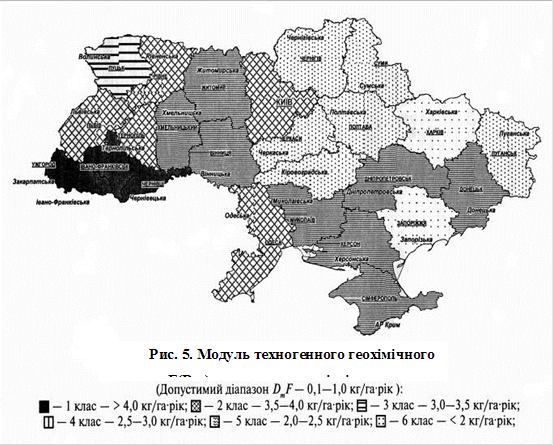
... дсутність негативного прямого або непрямого впливу на здоров'я людини, її потомство й санітарні умови життя населення. Таким чином, на відміну від екологічних ГДК, що нормують техногенне забруднення за ступенем впливу на найбільш чутливий вид й популяцію в цілому, гігієнічне нормування базується на оцінці ступеня впливу токсиканта на організм теплокровних й у кінцевому рахунку на людину. При цьому ...
... назад у сховище. По закінченні завантаження забірний рукав встановлюють у транспортне положення за допомогою гідроциліндра. 4. Використання добрив та охорона навколишнього природного середовища 4.1 Заходи безпеки при роботі з добривами При роботі з добривами треба дотримуватись заходів особистої безпеки: працювати в рукавицях, масках, бо багато добрив подразнюють шкіру і дихальні ...
... , стверджують спеціалісти Центральної геофізичної обсерваторії, збільшились концентрації сполук заліза загального в річках Білоцерківського району та Київської області. Центральною геофізичною обсерваторією проводились також гідробіологічні спостереження на р. Рось. Фото 5. р. Рось За вимогами екологічної класифікації якості поверхневих вод суші води р. Рось в районі м. ...


0 комментариев