Навигация
Характеристики индивидуальных медиаторов
3.7 Характеристики индивидуальных медиаторов
Ацетилхолин
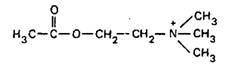
Предшественником АХ. служит холин, потребляемый с пищей. Холин поступает в холинергические нейроны с помощью специфической системы транспорта. Синтез АХ происходит в цитоплазме с участием холинацетилтрансферазы:
![]()
Затем АХ поступает в синаптические пузырьки. После экзоцитоза АХ в синаптическую щель он подвергается инактивации с участием ацетилхолинэстеразы:
![]()
АХ является преимущественно возбуждающим нейромедиатором, реже – тормозным.
У млекопитающих скопления холинергических нейронов локализуются в следующих отделах мозга: медиальное ядро перегородки, диагональная связка, базальное гигантоклеточное ядро, ядра моста. Аксоны этих нейронов проецируются на гиппокамп, проходят через кору больших полушарий. Холинергические нейроны головного мозга участвуют в таких функциях, как память,
регуляция движения, уровень бодрствования. Холинергические синапсы мозга содержат преимущественно мускариновые рецепторы. В спинном мозге АХ является нейромедиатором в синапсах, образуемых а-мотонейронами на клетках Реншоу. В вегетативной нервной системе АХ служит нейромедиаторм во всех преганглионарных нервных окончаниях симпатической и парасимпатической нервной системы – через посредство никотиновых холинорецепторов; во всех постганглионарных парасимпатических нервах, постганглионарных симпатических нервах потовых желез – через посредство мускариновых холинорецепторов. АХ осуществляет через посредство никотиновых холинорецепторов функцию нейромедиатора в нервно-мышечных синапсах, образуемых соматическими эфферентными нервами в скелетных мышцах. Среди беспозвоночных АХ выявлен в качестве нейромедиатора у плоских и кольчатых червей, у моллюсков.
Моноамины. К моноаминовым медиаторам относятся катехоламины, а также серотонин и гистамин В группу катехоламинов входят норадреналин, адреналин, дофамин, ок-топамин.
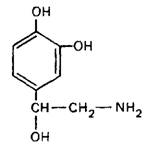
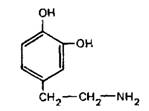
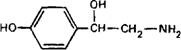
Предшественником катехоламинов является L‑тирозин, который организм получает в составе пищи, а также может синтезировать в печени из фенилаланина, потребляемого с пищей. L‑тирозин поступает в нервное окончание посредством активного транспорта. Ниже приведена схема синтеза катехоламинов:

Катехоламины депонируются в оптически плотных крупных синаптических пузырьках. Деградация секретированных катехоламинов происходит с участием моноамино-оксидаз и катехол-О-метилтрансферазы. Инактивация синаптического норадреналина после его экзоцитоза осуществляется также посредством обратного поглощения в нервные окончания, т.е. путем активного трансмембранного транспорта. Норадреналин
Тела норадренергических нейронов в ЦНС млекопитающих находятся в стволе мозга, главным образом в мосте мозга, в продолговатом мозге и ядре одиночного тракта. Многочисленные нейроны голубого пятна образуют диффузные проекции большой протяженности, достигающие практически всех отделов ЦНС – коры больший полушарий, лимбической системы, таламуса, гипоталамуса, спинного мозга.
Нисходящие норадренергические пути спинного мозга участвуют в регуляции мышц-сгибателей и сосудистого тонуса. В вегетативной нервной системе норадреналин является нейромедиатором постганглионарных симпатических нервов. В мозговом слое надпочечников высвобождаются норадреналин и адреналин. В ЦНС норадреналин является в ряде отделов преимущественно тормозным нейромедиатором, например в коре больших полушарий, реже – возбуждающим, например в гипоталамусе.
У беспозвоночных НА отсутствует или имеется в малых количествах. Адреналин
В головном мозге млекопитающих количество адренергических путей является гораздо более ограниченным по сравнению с норадренергическими. Тела нейронов, содержащие фе-нилзтаноламин‑1Ч-метилтранеферазу, находятся в нижних отделах моста и в продолговатом мозге. Нисходящие пути достигают центрального серого вещества и ядер гипоталамуса.
Нейромедиаторная роль адреналина сомнительна; нейромедиатором адренергических нейронов является, очевидно, НА. Адреналин высвобождается диффузно и выполняет роль модулятора.
У беспозвоночных адреналин, так же как и НА, почти отсутствует.
Дофамин
Тела дофаминергических нейронов находятся в среднем мозге, обонятельной луковице, гипоталамусе и перивентрикулярной области продолговатого мозга. Дофаминергические тракты соединяют черную субстанцию с неостриатумом, вентральную покрышку с лимбической системой и с лобной корой, аркуатное ядро гитоталамуса со срединным возвышением. Дофамин служит нейромедиатором амакриновых клеток сетчатки. Дофамин выполняет нейромедиаторную функцию и у беспозвоночных.
Октопамин
Октопамин – нейромедиатор, характерный для беспозвоночных. По отношению к мозгу позвоночных он рассматривается как «ложный медиатор, не опосредующий физиологические эффекты.
Серотонин
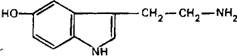
Предшественником 5‑НТ является незаменимая аминокислота триптофан, потребляемая с пищей. Синтез 5‑НТ происходит вне секреторных гранул, которые поглощают 5‑НТ с помощью высокоаффинного переносчика:

После экзоцитоза 5‑НТ инактивируется путем активного обратного транспорта или подвергается окислительному дезаминированию с образованием 5‑гидроксииндолуксусной кислоты.
Серотонинергические нейроны составляют ядра шва в ростральной части моста мозга; эти нейроны дают проекции к лимбической системе, базальным ганглиям, коре больших полушарий. В продолговатом мозге находятся серотонинергические нейроны, аксоны которых образуют нисходящие пути в ствол мозга и в спинной мозг. Кроме того, серотонин обнаружен в нейронах гипоталамуса, черной субстанции, спинном мозге. Серотонин широко распространен и у беспозвоночных.
5‑НТ играет важную роль в регуляции эмоционального поведения, двигательной активности, пищевого поведения, сна, терморегуляции, участвует в контроле нейроэндокринных систем. 5‑НТ может выполнять не только роль нейромедиатора, но и роль нейромодулятора.
Гистамин
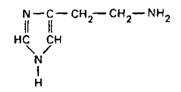
Гистамин образуется с помощью фермента гиствдиндекарбоксил азы

Деградация гистамина происходит с помощью моноамино-оксидазы или гистаминазы.
Гистаминергическая система весьма своеобразна по своей локализации и функциям. Нейроны, продуцирующие гистамин, сосредоточены в очень ограниченной области мозга – туберо-мамиллярных ядрах заднего гипоталамуса. Эта группа нейронов посылает свои эфферентные волокна практически во все отделы мозга. Везде обнаруживаются как постсинаптические, так и пресинаптические рецепторы гистамина. Важным условием исследования локализации элементов гистаминергической системы явилось открытие специфического ингибитора синтеза гистамина – а-флюоро-метил-гистамина. Столь широкая локализация рецепторов гистамина позволяет понять чрезвычайно разнообразные функции этой системы. Гистамин уменьшает продолжительность ортодоксальной фазы сна и облегчает пробуждение. Он стимулирует двигательную активность, половое поведение и в то же время подавляет восприятие боли. Усиливая жажду, он в то же время подавляет пищедобывательное поведение. Гистамин входит в число факторов, которые через центральные механизмы участвуют в повышении давления крови, в терморегуляции и в управлении энергетикой мозга – стимуляция гидролиза гликогена. Интересно, что гистамин реализует эти функции не только в рамках классических синапсов, часть гистамина выделяется так называемыми открытыми нервными окончаниями и способна к распространению по межклеточным жидкостям, в том числе через ликвор.
Аминокислоты. Аминокислотные нейромедиаторы в соответствии с их функцией делятся на две группы – возбуждающие аминокислоты и тормозные.
Глутамин поступает в организм с пищей. В нейроны он поступает из глии и служит предшественником для синтеза глута-мата, аспартата и ГАМК:

С пищей в организм поступает также аспартат, глицин, таурин.
Глутаминовая кислота
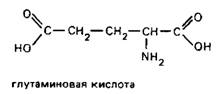
Глутамат обнаруживается во всех отделах ЦНС, очевидно, благодаря тому, что он является не только нейромедиатором, но и предшественником других аминокислот. Тела глутаматер-гических нейронов находятся в коре больших полушарий, обонятельной луковице, гиппокампе, черной субстанции, мозжечке, сетчатке. Глутаматергические синапсы существуют в миндалине, стриатуме, на клетках-зернах мозжечка. В спинном мозге глутамат сосредоточен в первичных афферентных волокнах дорсальных корешков.
Глутамат – возбуждающий нейромедиатор в мозге животных, а также в нервно-мышечных синапсах ракообразных и насекомых.
Аспаоагиновая кислота
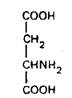
Наиболее высокое содержание аспартата найдено в среднем мозге. В спинном мозге аспартат содержится в дорсальном и вентральном сером веществе. Предполагается нейромедиатор-ная роль аспартата в возбуждающих интернейронах, которые регулируют различные спинномозговые рефлексы.
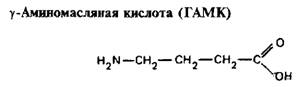
Широко распространена в ЦНС млекопитающих – она выявляется примерно в 50% всех нервных окончаний мозга. ГАМК представляет собой основной тормозной нейромедиатор в ЦНС. В коре больших полушарий имеется большое тсоличество ГАМК-ергических тормозных интернейронов. ГАМК находится в нейронах стриатума, дающих проекции на черную субстанцию, в нейронах мозжечка. В желатинозной субстанции задних рогов спинного мозга присутствуют ГАМК-ергические аксо-аксонные синапсы на первичных афферентных волокнах; эти синапсы опосредуют деполяризацию и ослабление секреции нейромедиатора – пресинаптическое торможение. Таким образом осуществляется тормозная регуляция ot‑мотонейронов. Высокие концентрации ГАМК найдены в горизонтальных клетках сетчатки; предполагается, что ГАМК обеспечивает обратную связь и латеральное торможение в слое горизонтальных клеток.
Глицин
HOOC-CH2-NH2
Эта аминокислота выполняет нейромедиаторную роль прежде всего в спинном мозге млекопитающих, где она опосредует постсинаптическое торможение мотонейронов, высвобождаясь из окончаний клеток Реншоу. Глицин является нейромедиато-ром также в тормозных интернейронах промежуточного мозга и ретикулярной формации продолговатого мозга. Наряду с ГАМК глицин прослеживается в сетчатке.
Таурин
HS03-CH2-CH2NH2
В качестве гипотетического тормозного нейромедиатора у млекопитающих следует назвать таурин, который содержится в головном и спинном мозге. В сетчатке таурин, возможно, служит нейромедиатором * тормозных синапсах внутреннего плексиформного слоя.
Пурины. В последнее десятилетие установлено, что нейромедиаторами служат и разнообразные пурины. Существуют два главных типа пуринергической трансмиссии. В первом основным нейромедиатором служит аденозин, во втором – АТФ и более сложный его дериват – диаденозинтетрафосфат
Аденозиновая трансмиссия включает медленные, метаботроп-ные рецепторы, модулирующие синтез цАМФ. АТФ-трансмис-сия осуществляется частично через быстрые, канальные рецепторы, модулирующие ионные потоки, особенно Са+.
Физиологические эффекты аденозина изучены довольно основательно. Они включают сопряжена со стимуляцией сократимости сердечной мышцы и опять-таки гипотензивным действием.
Пептидные медиаторы. Нейропегттиды составляют весьма многочисленную и полифункциональную группу. Некоторые нейропептиды удовлетворяют критериям нейромедиаторов. С известной долей осторожности сюда можно отнести вещество Р, вазоактивный интестинальный полипептид, сомато-статин, нейропептид Y, люлиберин. Гораздо более значительное число нейропептидов обладает свойствами нейромодуляторов.
Вещество Р. Оно оказалось первым веществом пептидной природы, у которого были обнаружены свойства нейромедиатора. Вещество Р содержится в телах первичных сенсорных нейронов спинномозговых ганглиев, депонируется в оптически плотных пузырьках, перемещается к пресинаптическому окончанию посредством быстрого аксонного транспорта, высвобождается из сенсорных нейронов под влиянием деполяризации при условии наличия Са* в среде. При аппликации на дорсальные рога спинного мозга вещество Р вызывает мощное возбуждение сенсорных нейронов второго порядка. После введения животным нейротоксина капсаицина, который обусловливает избирательную дегенерацию немиелинизированных первичных афферентов, происходило снижение содержания вещества Р в дорсальной части спинного мозга и'исчезновение медленных потенциалов дорсальных корешков.
■ Таким образом, вещество Р можно считать нейромедиато-ром пресинаптических окончаний С-волокон первичных сенсорных нейронов, образующих синапсы на сенсорных нейронах второго порядка в задних рогах. Этот – процесс участвует в восприятии болевых сигналов.
Как известно, первичные сенсорные нейроны образуют кроме центральных синапсов периферические синапсы в гладких мышцах дыхательных путей, кровеносных сосудов, желудочно-кишечного тракта, органов мочеполовой системы. Вещество Р высвобождается и в этих синапсах, инициируя медленные возбуждающие постсинаптические потенциалы, которые связаны с регуляцией тонуса гладких мышц.
Наряду с функцией возбуждающего нецромедиатора первичных сенсорных нейронов вещество Р может оказывать модулирующее влияние, в частности, усиливая десенситизацию никотиновых холинорецепторов. Наиболее характерным видом сосуществования с класическим нейромедиатором считается сочетание вещество Р + серотонин, причем вещество Р угнетает вызываемое деполяризацией высвобождение серотонина из срезов спинного мозга, а серотонин потенциирует высвобождение вещества Р. Вещество Р может сосуществовать и с другими медиаторами, классическими и пептидными: АХ, катехоламина-ми, ГАМК, ко-кальцигенином, вазоактивным интестинальным полипептидом, холецистокинином, нейротензином, соматоста-тином, опиоидными пептидами.
Вазоактивный интестинальный полипептвд Присутствие и высвобождение ВИП зарегистрировано во многих отделах нервной системы, прежде всего – в коре больших полушарий и в вегетативной нервной системе. Предполагают, что ВИП играет роль нейромедиатора в постганглионарных нейронах вегетативной нервной системы, которые участвуют в расслаблении гладких мышц кровеносных сосудов, дыхательных путей, кишечника. Электрофизиологическим отражением этих процессов являются так называемые медленные неадренергические не-холинергические тормозные постсинаптические потенциалы.
Согласно более ранней концепции Дж. Бэрнстока, нейроме-диатор неадренергических нехолинергических трансмуральных нервов кишечника имеет пуринергическую природу. При электрическом трансмуральном раздражении изолированных препаратов гладких мышц толстой кишки. и дна желудка наблюдалось высвобождение ВИП, которое коррелировало с силой расслабления мышцы. Высвобождение ВИП зарегистрировано при электрическом раздражении нервов трахеи и бронхов; обработка препарата специфическими антителами к ВИП предотвращало медленное расслабление трахеи морской свинки как в ответ на ВИП, так и в ответ на раздражение нервов. При высоких концентрациях ВИП развивалась тахифилаксия медленных ответов на раздражение нервов.
Наряду с возможной нейромедиаторной функцией достаточно определенно вырисовывается роль ВИП в качестве нейромоду-лятора, взаимодействующего с мускариновыми холинорецеп-торами в центральной и периферической нервной системе. В постганглионарных симпатических нейронах подчелюстной железы кошки обнаружена реципрокная регуляция высвобождения АХ/ВИП посредством обратной связи через мускарино-вые холинорецепторы и рецепторы ВИП. АХ ингибирует высвобождение ВИП, причем атропин блокирует этот эффект. В свою очередь, ВИП подавляет высвобождение АХ.
Хроническое введение крысам атропина сопровождалось значительным увеличением количества участков связывания – НА, вызываемое электрическим раздражением симпатических нервов семявынося-щего протока крысы; одновременно происходит подавление вызванных сокращений гладких мышц протока. Нейропептид Y усиливает тормозное влияние агониста а2-адренорецепторов кло-нидина на вызываемое деполяризацией высвобождение – НА из синаптосом продолговатого мозга. Предполагается взаимодействие между пресиналтическими а2‑адренорецепторами и рецепторами нейропептида Y, которое ведет к повышению чувствительности а2-адренорецепторов. Интересно, что клони-дин оказывает тормозное влияние на высвобождение нейропептида Y в ответ на раздражение преганглионарных симпатических нервов, тогда как антагонист а^-адренорецепторов усиливает высвобождение нейропептида YT Клонидин уменьшает связывание – нейропептида Y в срезах продолговатого мозга крыс, а нейропептид Y снижает связывание клонидина за счет увеличения константы диссоциации комплекса лиганд–рецептор без изменений количества рецепторов. Такое взаимодействие между рецепторами служит примером синаптической гете-рорегуляции.
Постсинаптическое модулирующее влияние нейропептида Y выражается в том, что он усиливает сократительные ответы гладких мышц семявыносящего протока и кровеносных сосудов на субмаксимальные концентрации НА.
Наряду с нейромодуляторной функцией не исключается и нейромедиаторная роль нейропептида У, который способен оказывать прямое сосудосуживающее влияние. После истощения катехоламинов путем введения резерпина в сочетании с перерезкой преранглионарных симпатических нервов селезенки кошки раздражение нерва селезенки сопровождается сужением сосудов. Предполагается, что этот неадренергический эффект опосредуется высвобождением нейропептида Y.
Люлибирин. Аналог гипофизарного ЛГ-РГ млекопитающих, близкий по свойствам к ЛГ-РГ костистых рыб, обнаружен иммуноцитихимическими методами в преганглионар-ных волокнах симпатических ганглиев лягушки, где он высвобождается Са+-зависимым образом в ответ на электрическое раздражение. При аппликации на симпатические нейроны ЛГ-РГ вызывает деполяризацию, идентичную позднему медленному ВПСП. Антагонисты ЛГ-РГ подавляют как деполяризаци-онные ответы на аппликацию ЛГ-РГ, так и поздние медленные ВПСП без изменений быстрых холинергических ВПСП. Таким образом, ЛГ-РГ удовлетворяет критериям нейромедиатора поздних медленных ВПСП в синапсах преганглионарных симпатических нервов.
Эта ситуация представляет собой интересный случай сосуществования двух нейромедиаторов – классического и пептидного. Взаимоотношения между этими двумя нейромедиато-рами поясняет схема. В 9–10‑м паравертебральном симпатическом ганглии существуют два вида нейронов: В-клет-ки, которые снабжаются волокнами 3–5‑го спинальных нервов, и С-клетки, которые иннервируются волокнами 7–8‑го спинальных нервов. Электрическое раздражение 3–5‑го нервов вызывает холинергические быстрые ВПСП только в В-клет-ках. При раздражении 7–8‑го нервов возникают холинергические быстрые ВПСП только в С-клетках и поздние медленные ВПСП как в С-клетках, так и в В-клетках, причем в В-клетках поздние медленные ВПСП появляются примерно на 15 мс позднее, чем в С-клетках. После перерезки 3–5‑го нервов холинергические потенциалы в В-клетках исчезают, тогда как раздражение 7–8‑го нервов продолжало вызывать в В-клетках поздние медленные ВПСП. Очевидно, ЛГ-РГ высвобождается совместно с АХ из пресинаптических окончаний на С-клетке, а затем диффундирует на расстояние порядка 50 мк к В-клетке, которая не имеет синаптического контакта с С-клеткой.
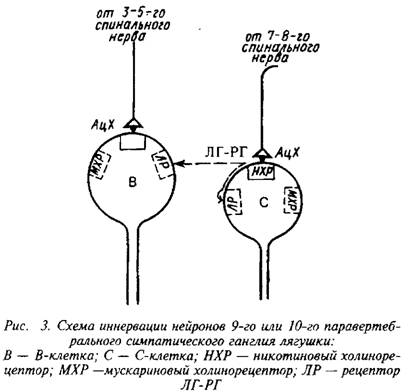
Исследование поздних медленных ВПСП в симпатическом ганглии позволило выдвинуть паракринную гипотезу действия пептидных медиаторов, которая включает два положения.
1. Нейропептиды действуют в нервной системе как паракрин-ные гормоны, т.е. могут диффундировать во внеклеточное пространство, достигая клетки-мишени, относительно удаленное от места секреции. 2. Нейропептиды, высвобождаемые из нервных окончаний, могут воздействовать и на клетки, не имеющие синаптического контакта с этими нервными окончаниями. Следовательно, классические морфологические критерии синаптического контакта непригодны для идентификации нейронов-мишеней пептидных медиаторов; наиболее важным критерием нейронов-мишеней здесь служит локализация рецепторов ней-ропептида. При этом из нервных окончаний могут высвобождаться несколько медиаторов, каждый из которых имеет свой «химический» адрес.
Нитроксид. В течение последних пяти лет накапливаются данные о возможной роли N0 в межклеточной передаче сигнала. Начало этому направлению было положено выявлением в тканях животных биохимических систем, способных генерировать N0, используя в качестве исходного соединения аргинин, а также идентификация N0 как одного из главных факторов релаксации сосудов.
Далее было показано образование N0 в ткани мозга, выявлен ряд проявлений нейрологической активности N0 и, наконец, установлен механизм его действия – посредством активации гуаншгатциклазы. Классическая схема – образование и/или накопление нейромедиатора в термикали, его выход в синапти-ческую щель после поступления импульса и включения рецептора – не подходит для описания процессинга и эффектов NO. Первый, наиболее изученный вариант, состоит в том, что при интенсивной импульсации глутаматергических синапсов синтез N0 интенсифицируется в постсинаптической зоне. Оттуда N0 выходит в межнейрональную жидкость и может активировать гуанилатциклазу, повышая уровень цГМФ в терминалах и в глии. Результаты этих процессов могут быть различны в зависимости от места первичного образования N0. В их число входит участие N0 в феноменах пластичности нейронов, консолидации памяти и т.п.
Второй вариант схемы допускает синтез N0 в терминалях и, далее, воздействие на гуанилатциклазу в постсинаптических зонах гладкой мускулатуры сосудов, тонкой кишки и некоторых других образований. Ряд исследователей полагают, что роль NO в мозге состоит главным образом в релаксации сосудов и усилении кровоснабжения в тех именно случаях, когда особенно интенсивно функционирует глутаматергическая система. Иначе говоря, ведущей, с этой точки зрения, предполагается трофическая функция.
Интересно, наконец, отметить данные о том, что малые концентрации N0 оказывают в мозге нейропротекторное действие, а относительно большие участвуют в повреждении нейронов.
Предстоит, очевидно, еще большой цикл исследований для уточнения функций и механизмов действия N0.
Выводы
1. Большинство синапсов в нервной системе млекопитающих является химическими.
2. Процесс передачи сигнала в химическом синапсе осуществляется посредством освобождения нейромедиаторов из пресинаптических нервных окончаний.
3. К нейромедиаторам относятся в настоящее время 4 группы веществ: моноамины, аминокислоты, пуриновые нуклеоти-ды, пептиды.
4. В индивидуальном нейроне синтезируется, как правило, несколько нейромедиаторов различной химической природы.
5. Существует 2 типа механизмов преобразования химического сигнала в синапсе: ионотропный и метаботропный.
6. Кроме нейромедиаторов существует обширный класс соединений – нейромодуляторов, регулирующих уровень синаптической передачи.
Похожие работы
... В этом случае раздражения разделены интервалом времени, а не пространством и более высокую эффективность повторного раздражения можно считать результатом временной суммации. В современных учебниках по физиологии приводятся понятия временной и пространственной суммации, но теперь об их механизме известно больше, чем в то время, когда они были впервые описаны. Нервные волокна многократно ветвятся, ...
... роль нейрорецепторов сводится к созданию специфических информационных входов, организующих единый функциональный ансамбль нейронов. Именно совокупность рецепторов определяет лицо клетки и ее реакции на поступление разнообразных химических сигналов. Молекулярные механизмы, лежащие в основе модуляции эффективности синаптической передачи, в которых важную роль играют рецепторные процессы, имеют ...
... специфических сигналов. Представление о синапсах связано с Шеррингтоном (1935), высказавшим предположение о существовании специальных структурно-функциональных образований, обеспечивающих контакты между нейронами. Особенности рефлекторных реакций и некоторые свойства нервных центров обусловлены процессами, происходящими на синапсах. Синапс включает в себя три компонента: пресинаптический, ...
... в глутамат с образованием янтарного полуальдегида. HOOC-CH2-CH2-CH2-NH2 à HOOC-CH2-CH2-CH(O) ГАМК Янтарный полуальдегид ГАМК в организме γ–аминомасляная кислота является основным ингибиторным трансмиттером (передатчиком) в ЦНС. Она осуществляет нейрональную трансмиссию в 1/3 всех синапсов головного и спинного мозга. ГАМК играет важную роль в регуляции двигательных функций. При этом ...


0 комментариев