Физические свойства.
Бесцветный газ с резким запахом, ядовитый, тяжелее воздуха, хорошо растворим в воде (1 : 400).
| t°пл. | -114°C |
| t°кип. | -85°С |
В отсутствие влаги он при обычных температурах не действует на большинство металлов и их оксиды. Газообразный кислород окисляет его только при нагревании.Получение.
1) Синтетический способ (промышленный):
H2 + Cl2 = 2HCl
2) Гидросульфатный способ (лабораторный):
NaCl(тв.) + H2SO4(конц.) = NaHSO4 + HCl
Химические свойства.
1) Раствор HCl в воде - соляная кислота - сильная кислота:
HCl = H+ + Cl-
2) Реагирует с металлами, стоящими в ряду напряжений до водорода:
2Al + 6HCl = 2AlCl3 + 3H2
3) с оксидами металлов:
MgO + 2HCl = MgCl2 + H2O
4) с основаниями и аммиаком:
HCl + KOH = KCl + H2O
3HCl + Al(OH)3 = AlCl3 + 3H2O
HCl + NH3 = NH4Cl
5) с солями:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
HCl + AgNO3 = AgCl + HNO3
Растворимость НС1 в воде меняется с температурой следующим образом:
| Температура, °С | 0 | 10 | 15 | 20 | 25 | 30 | 40 | 50 | 60 |
| Растворимость в V на 1 V Н2О | 507 | 474 | 459 | 442 | 426 | 412 | 386 | 362 | 339 |
Образование белого осадка хлорида серебра, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl- в растворе.
Хлориды металлов - соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями
2Fe + 3Cl2 = 2FeCl3
Mg + 2HCl = MgCl2 + H2
CaO + 2HCl = CaCl2 + H2O
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Pb(NO3)2 + 2HCl = PbCl2 + 2HNO3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
Соляная кислота очень сильно разъедает многие металлы. Транспортируют ее в стеклянных бутылях или гуммированных (т. е. покрытых слоем резины) металлических емкостях. Гуммирование может быть заменено введением в кислоту специальных добавок - ингибиторов.
Список литературы
Для подготовки данной работы были использованы материалы с сайта http://schoolchemistry.by.ru/
Похожие работы
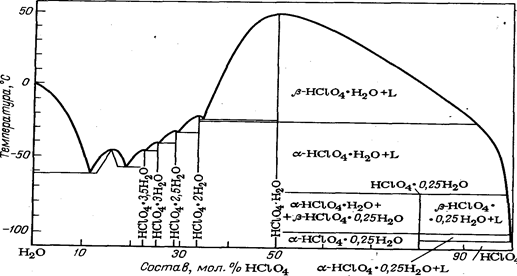
... кипения растворов хлорной кислоты различной концентрации при давлении 2,4 кПа составляет: Концентрация НСLO4, масс.% 100 94,8 92,0 84,8 79,8 70,5 Температура кипения, °С 16,0 24,8 35 70 92 107 Безводная хлорная кислота весьма реакционно-способна, при соприкосновении со многими легкоокисляющимися органическими веществами она взрывается. Безводная хлорная кислота — сильный ...
тные и олеумные абсорберы, отбирают из кислотомеров или из соответствующих сборников. Анализ технической улучшенной аккумуляторной кислот и олеума. 2. Методы анализа 2.1 Определение моногидрата Содержание моногидрата в кислоте определяют титрованием щелочью Реактивы Янтарная кислота (СН2СООН)2. Фенолфталеин, 1%-ный спиртовой раствор. Метиловый красный, 1%-ный спиртовой раствор. ...
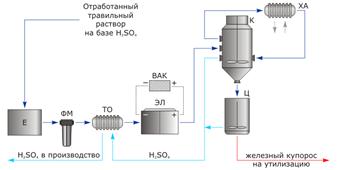
... ; ФМ – фильтр предварительной очистки; ТО – теплообменник предварительного охлаждения; ЭЛ – электродиализатор; ВАК – выпрямительный агрегат; К – узел кристаллизации; Ц – центрифуга; ХА – холодильный агрегат (чиллер) 3. Извлечение серной кислоты из отработанного травильного раствора В процессе удаления окалины или травления серной кислотой железных и стальных деталей, например листов, полос ...
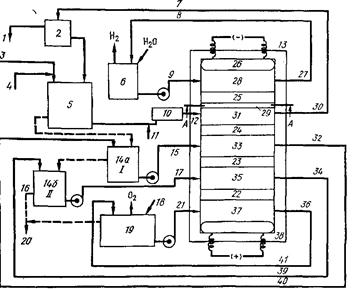
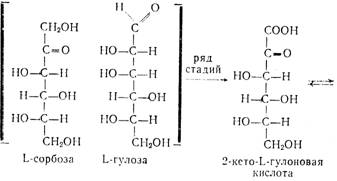
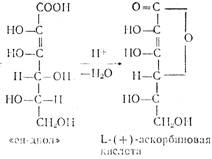
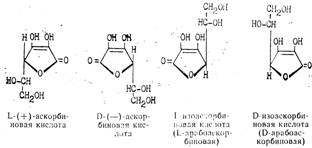
... кислоты. Выход продукта в пересчете па глюкозу составляет в целом до 54%. Химическая схема производства аскорбиновой кислоты Технология производства аскорбиновой кислоты Стадия 1. Производство D-сорбита из D-глюкозы В производстве синтетической аскорбиновой кислоты D-сорбит является первым промежуточным продуктом синтеза. D-сорбит представляет собой белый ...


0 комментариев