.
Физические свойства.
Фтор - газ светло-желтого цвета. Это вещество представляет собой почти бесцветный (в толстых слоях зеленовато -желтый) газ с резким запахом. Он сгущается в светло-желтую жидкость при -188 °С и затвердевает при -220 °С. Критическая температура фтора равна -129 °С, критическое давление 55 атм. При температуре кипения жидкий фтор имеет плотность 1,5 г/см3, а теплота его испарения составляет 1,6 кДж/моль. При охлаждении ниже -252 °С его желтоватые кристаллы обесцвечиваются. |
Получение фтора.
Элементарный фтор получают путем электролиза фтористых соединений. причем он выделяется на аноде по схеме:
2 F- = 2е + 2 F = 2е + F2 Электролитом обычно служит смесь состава КF·2НF (часто с добавкой LiF). Процесс проводят при температурах около 100 'С в стальных электролизерах со стальными катодами и угольными анодами.
Удобная лабораторная установка для получения фтора показана на рис.
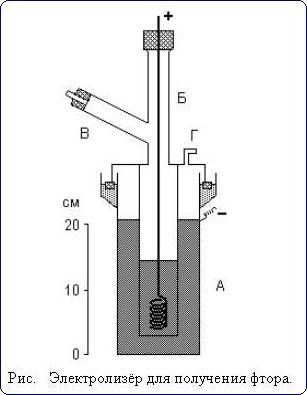
Электролизу подвергают легкоплавкую смесь состава КF·3НF, помещенную в служащую катодом внешний медный сосуд А. Анод из толстой никелевой проволоки помещается в медном цилиндре Б, нижняя боковая часть которого имеет отверстия. Выделяющийся фтор отводится по трубке В (а водород - через отвод Г). Все места соединения отдельных частей прибора делают на пробках из СаF2 и замазке из РbО и глицерина.
Химические свойства фтора.
Так как фтористые производные м е т а л л о и д н ы х элементов обычно легколетучи образование их не предохраняет поверхность металлоида от дальнейшего действия фтора. Поэтому взаимодействие часто протекает значительно энергичнее, чем со многими металлами. Например, кремний, фосфор и сера воспламеняются в газообразном фторе. Аналогично ведет себя аморфный углерод (древесный уголь), тогда как графит реагирует лишь при температуре красного каления. С азотом и кислородом фтор непосредственно не соединяется.
От водородных соединений других элементов фтор отнимает водород. Большинство оксидов разлагается им с вытеснением кислорода. В частности, вода взаимодействует по схеме
F2 + Н2О --> 2 НF + O
причем вытесняемые атомы кислорода соединяются не только друг с другом, но частично также с молекулами воды и фтора. Поэтому, помимо газообразного кислорода, при этой реакции всегда образуются пероксид водорода и оксид фтора (F2О). Последняя представляет собой бледно-желтый газ, похожий по запаху на озон.
Окись фтора (иначе - фтористый кислород - ОF2) может быть получена пропусканием фтора в 0,5 н. раствор NаОН. Реакция идет по уравнению:2 F2 + 2 NаОН = 2 NаF + Н2О + F2ОТак же для фтора характерны следующие реакции:
H2 + F2 = 2HF (со взрывом)
Cl2 + F2 = 2ClF
Нахождение фтора в природе.
На земной поверхности фтор встречается исключительно в составе солей. Общее его содержание в земной коре равняется 0,02 %. Основная масса фтора распылена по различным горным породам. Из отдельных форм его природных скоплений наиболее важен минерал флюорит - СаF2.
Основная масса фтора земной поверхности обязана своим происхождением горячим недрам Земли (откуда этот элемент выделяется вместе с парами воды в виде НF). Среднее содержание фтора в почвах составляет 0,02 %, в водах рек - 2·10-5 % и в океане - 1·10-4 %. Человеческий организм содержит фтористые соединения главным образом в зубах и костях. В вещество зубов входит около 0,01 % фтора, причем большая часть этого количества падает на эмаль [состав которой близок к формуле Са5F(РO4)3]. В отдельных костях содержание фтора сильно колеблется. Для растительных организмов накопление фтора не характерно. Из культурных растений относительно богаты им лук и чечевица. Обычное поступление фтора в организм с пищей составляет около 1 мг за сутки.
Список литературы
Для подготовки данной работы были использованы материалы с сайта http://schoolchemistry.by.ru/
Похожие работы
... є увагу на високу мінералізацію, великий вміст кальцію, магнію та сульфатів у багатих на фтор водах. Це змушує дійти висновку, що важко знайти будь-які загальні закономірності між складом води та вмістом фтору. ВПЛИВ ФТОРУ НА ЛЮДСЬКИЙ ОРГАНІЗМ Фтор в організмі людини та його роль Фтор в організмі людини Вивчення вмісту фтору в різних тканинах та органах є необхідною ланкою у справі з’ясування бі ...
... Н.А., Сачкова Г.В. и др., однако изучение данной проблемы требует дальнейших исследований, а нами сделана лишь незначительная попытка затронуть вопросы влияния фторосодержащих соединений на почву и естественный травостой. Влияние на организм человека Фтор – необходимый организму микроэлемент, основная роль которого, вместе с фосфором и кальцием, состоит в образовании костной ткани и ...
... і фосфоритів України // Агрохімія і ґрунтознавство. Міжвідомчий тематичний науковий збірник. Спец. випуск до V з'їзду УТГА. – Ч.2. – Харків, 1998. 2. Кавецький В.М., Макаренко Н.А., Ліщук А.М. Екотоксикологічна оцінка небезпечності застосування добрив в агроекосистемі // Проблеми агропромислового комплексу Карпат: Збірник наукових праць. – 1998. 3. Кавецький В.М., Гець Т.С., Макаренко Н.А., Л
... доходила до 90%. При советской власти доктором Л. М. Исаевым была организована планомерная работа по ликвидации этого гельминтоза. В результате через несколько лет очаг в старой Бухаре был полностью ликвидирован.II. Эндемические заболевания Фтор Фтор относится к числу наиболее распространенных химических элементов земной коры. Обогащение почв фтором происходит в результате выветривания пород, ...

0 комментариев