Навигация
Технология ферментных препаратов
Технология ферментных препаратов
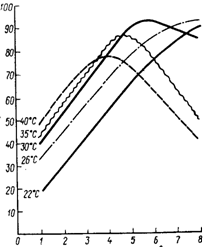
Ферменты как биокатализаторы обладают рядом уникальных свойств, например, таких как высокая каталитическая активность и избирательность действия. В ряде случаев ферменты обладают абсолютной специфичностью, катализируя превращение только одного вещества. Для каждого фермента существует свой оптимум рН, при котором его каталитическое действие максимально. При резком изменении рН ферменты инактивируются из-за необратимой денатурации. Ускорение реакции при повышении температуры также лимитировано определенными пределами, поскольку уже при температуре 40-50оС многие ферменты денатурируют. Эти свойства ферментов приходится учитывать при разработке технологии нового препарата.
Поскольку ферменты - вещества белковой природы, в смеси с другими белками их количество определить практически невозможно. Наличие фермента в препарате может быть установлено лишь по протеканию той реакции, которую катализирует фермент. При этом количественную оценку содержания фермента можно дать, определив либо количество образовавшихся продуктов реакции, либо количество израсходовавшегося субстрата. За единицу активности фермента принимают то его количество, которое катализирует превращение одного микромоля субстрата в 1 минуту при заданных стандартных условиях - стандартная единица активности.
По решению Международного биохимического союза активность решено определять при t = 30оС по начальной скорости реакции, когда концентрация насыщения фермента и временная зависимость близка к кинетике реакции нулевого порядка. Остальные параметры реакции индивидуальны для каждого фермента. Активность ферментного препарата выражается в микромолях субстрата, прореагировавшего под действием 1 мл ферментного раствора или 1 грамма препарата в оптимальных условиях за 1 минуту. Если ферментный препарат не содержит балласта, то его активность выражается в тех же стандартных единицах на 1 мг фермента. Если же есть балласт, то активность считается на 1 мг белка в ферментном препарате. Активность выпускаемого препарата - важнейший нормируемый показатель качества.
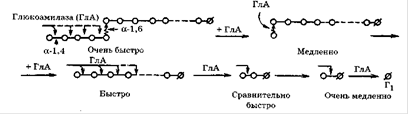
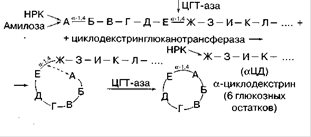
Основную часть ферментов, получаемых промышленным способом, составляют гидролазы. К ним относятся, в первую очередь амилолитические ферменты: α-амилаза, β-амилаза, глюкоамилаза. Их основная функция - гидролиз крахмала и гликогена. Крахмал при гидролизе расщепляется на декстрины, а затем до глюкозы. Эти ферменты применяются в спиртовой промышленности, хлебопечении.
Протеолитические ферменты образуют класс пептидгидролаз. Их действие заключается в ускорении гидролиза пептидных связей в белках и пептидах. Важная их особенность - селективный характер действия на пептидные связи в белковой молекуле. Например, пепсин действует только на связь с ароматическими аминокислотами, трипсин - на связь между аргинином и лизином. В промышленности протеолитические ферменты классифицируют по способности проявлять активность в определенной области рН:
рН 1.5 - 3.7 - кислые протеазы;
рН 6.5 - 7.5 - протеазы;
pH > 8.0 - щелочные протеазы.
Протеазы находят широчайшее применение в разных отраслях промышленности:
мясная - для смягчения мяса;
кожевенная - смягчение шкур;
кинопроизводство - растворение желатинового слоя при регенерации пленок;
парфюмерная - добавки в зубную пасту, кремы, лосьоны;
производство моющих средств - добавки для удаления загрязнений белковой природы;
медицина - при лечении воспалительных процессов, тромбозов и т.д.
Пектолитические ферменты уменьшают молекулярную массу и снижают вязкость пектиновых веществ. Пектиназы делятся на две группы - гидролазы и трансэлиминазы. Гидралазы отщепляют метильные остатки или разрывают гликозидные связи. Трансэлиминазы ускоряют негидролитическое расщепление пектиновых веществ с образованием двойных связей. Применяются в текстильной промышленности (вымачивание льна перед переработкой), в виноделии - осветление вин, а также при консервировании фруктовых соков.
Целлюлолитические ферменты очень специфичны, их действие проявляется в деполимеризации молекул целлюлозы. Обычно используются в виде комплекса, доводящего гидролиз целлюлозы до глюкозы (в гидролизной промышленности). В медицинской промышленности их используют для выделения стероидов из растений, в пищевой - для улучшения качества растительных масел, в сельском хозяйстве - как добавки в комбикорма для жвачных животных.
Существует ряд факторов, влияющих на биосинтез ферментов. В первую очередь, к ним относится генетический. Состав и количество синтезируемых ферментов наследственно детерминированы. Применяя мутагены можно изменить генетические свойства микроорганизмов и получить штаммы с ценными для промышленности свойствами. К мутагенным факторам относятся ионизирующее и неионизирующее излучения, изотопы, антибиотики, другие химические соединения, преобразующие наследственные элементы клетки. Несмотря на определяющую роль генетического фактора в биосинтезе ферментов, производительность биотехнологических процессов зависит и от состава питательной среды. При этом важно не только наличие источников основных питательных веществ, но и веществ, играющих роль индукторов или репрессоров биосинтеза данного конкретного фермента или их групп. Механизм этого явления еще не вполне изучен, но сам факт должен учитываться при выборе технологии.
Рассмотрим несколько примеров. Фермент липаза почти не синтезируется грибом Aspergillus awamori на среде без индуктора, добавление жира кашалота усиливает биосинтез фермента в сотни раз. При добавлении же в среду крахмала и при полном исключении минерального фосфора интенсивно синтезируется фосфатаза. Не только наличие индуктора способно увеличивать выход фермента. Важную роль играет состав питательной среды и условия культивирования. При разработке процесса биосинтеза a-амилазы культурой Aspergillus oryzae замена сахарозы (как источника углерода) на крахмал увеличила активность фермента в 3 раза, добавление солодового экстракта (из проросших семян злаковых) ещё в 10 раз, а повышение концентрации основных элементов питательной среды на 50% - ещё в 2 раза.
Для интенсификации процесса роста и синтеза ферментов добавляют различные факторы роста, например, аминокислоты, пуриновые основания и их производные, РНК и продукты её гидролиза. В качестве источника углерода используют крахмал, кукурузный экстракт, соевую муку, гидролизаты биомассы дрожжей. Микроорганизмы могут утилизировать и минеральные источники азота. В состав питательных сред входят и ионы MG, Mn, Zn, Fe, Cu и др. металлов. Механизм действия большинства из них неизвестен. Некоторые входят в состав фермента. Ионы Ca повышают устойчивость a-амилазы, ионы Fe и Mg активизируют и стабилизируют протеолитические ферменты.
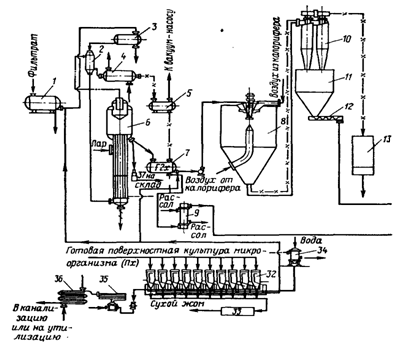
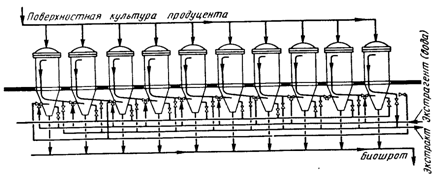
Оптимальный состав питательной среды для каждого продуцента может быть определен двумя способами: эмпирический и построение математической модели с использованием компьютера. Последний, естественно, предпочтительнее. По характеру культивирования все технологические процессы производства ферментных препаратов делятся на две большие группы: глубинный и поверхностный методы.
Глубинный метод производства ферментов
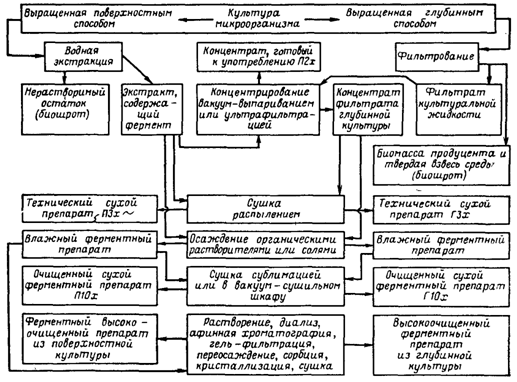
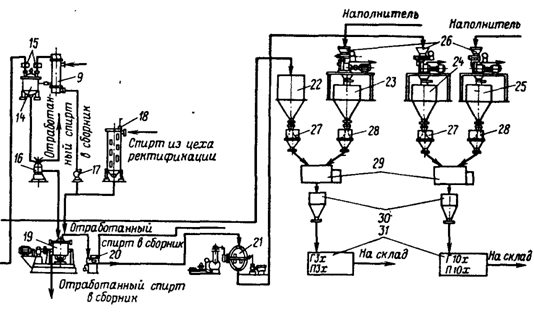
В этом случае микроорганизмы выращиваются в жидкой питательной среде. Технически более совершенен, чем поверхностный, так как легко поддается автоматизации и механизации. Концентрация фермента в среде при глубинном культивировании обычно значительно ниже, чем в водных экстрактах поверхностной культуры. Это вызывает необходимость предварительного концентрирования фильтрата перед его выделением.
При глубинном культивировании продуцентов ферментов выделяют, как и в любом биотехнологическом процессе, 5 этапов.
Похожие работы
... инактивация ферментов. Из сборника 29 охлажденная жидкость по мере необходимости подается на фильтровальную установку. 1.3 Получение ферментных препаратов из культур микроорганизмов Культура микроорганизмов, выращенная поверхностным способом, и культуральная жидкость после глубинного культивирования содержат большое количество балластных веществ. Выделение и очистка ферментов – трудоёмкий и ...
... амілази і пуллуланази або альфа-амілази і глюкоамілази, активних при високій температурі. Однак складність культивування анаеробних бактерій в заводських умовах робить цей спосіб отримання препарату амілолітичних ферментів практично непридатним. З літературних даних відомо, що найбільш термостабільними гідролітичними ферментами, такими як альфа-амілази, пуллуланази, а в ряді випадків і протеази є ...
... сыров, брынзы, творога и обезжиренной сырной массы/5/. 6 РАЗРАБОТКИ КОМПАНИИ «ДАНИСКО» В настоящее время на рынке представлен болыпой выбор отечественных и зарубежных молокосвертывающих ферментных препаратов (МФП), и сыроделам часто сложно разобраться в их многообразии и качестве. Поэтому для многих предприятий основными критериями выбора стали опыт работы с определенным ферментом и (или) его ...
... і проти контролю збільшилась маса їстівних частин на 115,9±41,9. 5.2 Економічне обґрунтування досліджень Використання в комбікормі ферментного препарату МЕК у дозі 0,5 кг на 1 т корму дозволило скоротити витрати комбікорму на виробництво 10 яєць до 1,53 у порівнянні з контрольною групою. Це приведено в таблиці 14. 14. Економічна ефективність використання ферментного препарату МЕК в комбі ...

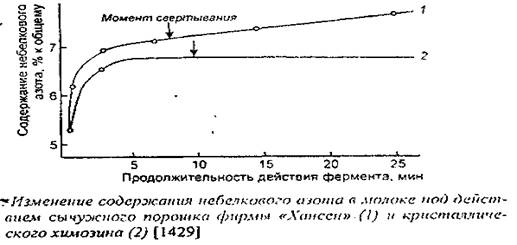
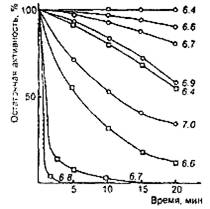
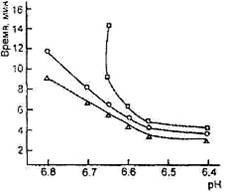
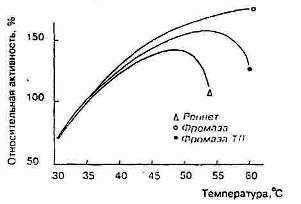
0 комментариев